香菇多糖增强5-FU抑制结肠癌细胞增殖机制研究
2012-05-30袁昌劲孔庆志卢宏达孔双喜
袁昌劲,孔庆志,卢宏达,孔双喜
(1.武汉市中心医院 肿瘤科,湖北 武汉430014;2.华中科技大学附属同济医院 肿瘤科)
香菇多糖主要为甘露糖甘肽,其余为多种糖分和各种氨基酸等,对光和热稳定,不溶于甲醇、乙醇和丙酮等有机溶剂[1],联合抗肿瘤药物对胃癌[2]、结肠癌[3]、肺癌[4]等肿瘤具有良好的疗效,显著延长肿瘤患者存活时间。目前对香菇多糖的抗肿瘤机制仍然不清楚,一般认为和免疫调节有关。香菇多糖是典型的T细胞激活剂,体内外均能促进细胞毒T淋巴细胞(CTL)的产生,提高CTL细胞杀伤力,增强正常或免疫功能低下小鼠的迟发型超敏反应,提高抗体依赖性细胞毒作用,同时能结合到人单核细胞上激活内源性信号传导通路[5,6]。本文应用香菇多糖及5-FU处理SW480结肠癌细胞,探讨其对细胞增殖和凋亡的影响,并研究其可能作用机制。
1 材料与方法
1.1 材料
SW480结肠癌细胞购于美国ATCC,RPMI-1640、双抗和FBS购于Gibco公司,MTT试剂购于Sigma公司,RNA 提取和 RT-PCR试剂盒购于Takara公司,引物由上海生工公司合成,香菇多糖采用南京康海药业有限公司的香菇多糖冻干粉剂,5-FU购于Sigma公司。
1.2 细胞培养和药物处理
SW480结肠癌细胞完全培养基为10%FBS、89%RPMI-1640和1%双抗,培养条件为37℃、5%CO2恒温培养箱,实验时取对数生长期细胞。香菇多糖冻干粉剂用生理盐水配制成5μmol/ml,5-FU用生理盐水配制成500mg/L存储液,根据王峻[7]和Harada[8]等研究,使用时加入完全培养基配制如下浓度工作液①Len组:Lentinan终浓度0.05 μmol/ml;②FU组:5-FU终浓度100mg/L;③L+F组:Lentinan终浓度0.05μmol/ml和100mg/L 5-FU终浓度。
1.3 MTT法检测细胞增殖
每孔1000个细胞接种于96孔板,每孔200μl,加入工作液处理24h后,PBS洗涤3次更换新鲜培养基培养。每天MTT法检测一孔,每孔加入5 mg/ml MTT溶液20μl,37℃孵育4h后弃去,加入DMSO 50μl,振荡15min充分溶解结晶,酶标检测仪上测定波长为490nm下的吸光值(A值),每孔细胞吸光度=测得值-空白对照孔值。以吸光值为纵坐标,以时间(天)为横坐标,绘制Len组、FU组、L+F组和正常未处理组SW480结肠癌细胞增殖曲线。
1.4 流式细胞仪检测细胞周期及细胞凋亡
药物处理24h后收集细胞并离心,细胞沉淀用PBS洗涤,加入标记有异硫氰酸荧光素的连接素Annexin V-FITC和碘化丙锭,避光孵育15min后检测细胞凋亡,另制成200μl细胞悬液,加入70%的冰乙醇5ml-20℃固定24h以上,加入RNase A 200μl,37℃温育30min,加入碘化丙啶至终浓度50mg/L,检测细胞周期。增殖指数(PI)=(S+G2/M)/(G0/G1+S+G2/M)。
1.5 RT-PCR检测多药耐药基因 MDR1、MRP1和LRP表达
按照RNA提取试剂盒说明提取细胞总RNA,用β-actin作为内参照进行RT-PCR扩增,引物序列参见表1。PCR反应体系为25μl,反应参数:94℃预变性5min,94℃变性45s,表1基因对应退火温度退火30s,72℃延伸30s,共35个循环,最后一轮72℃延伸10min。PCR产物经20g/L琼脂糖凝胶电泳后检测。
1.6 统计学分析
应用SPSS12.0进行数据处理与统计分析。采用t检验,P<0.05认为差异具有统计学意义。
2 结果
2.1 SW480结肠癌细胞增殖
正常对照组SW480结肠癌细胞表现为对数增殖状态,单独5-FU处理后,增殖速度较对照组显著降低,增殖速度降低,细胞增殖受到抑制;单独香菇多糖对细胞增殖无明显影响,联合5-FU作用后的细胞增殖速度显著降低(图1)。

表1 MDR1、MRP1和LRP基因RT-PCR反应序列和退火温度
2.2 细胞形态与凋亡
镜下观察,FU组SW480结肠癌细胞体积缩小、死亡,细胞密度较对照组降低;Len组结肠癌细胞无明显细胞体积缩小和死亡,细胞密度和对照组无明显区别;香菇多糖联合5-FU处理后,死亡细胞增加,细胞密度较对照组显著降低,明显低于FU组。Len组与对照组相比,差异无统计学意义(P>0.05),FU组G0/G1期细胞明显增加,S期细胞降低,PI明显降低,细胞凋亡率显著提高(P<0.05),L+F组与FU组和对照组相比,细胞凋亡率显著增加,PI降低,细胞停滞于G0/G1期,差异具有统计学意义(P<0.05)(表2)。

图1 SW480结肠癌细胞增殖曲线
表2 SW480结肠癌细胞细胞周期与凋亡(±s)

表2 SW480结肠癌细胞细胞周期与凋亡(±s)
与对照组相比,*P<0.05,#P>0.05;a、b和c之间,P<0.05
?
2.3 RT-PCR检测耐药基因表达
正常对照组SW480结肠癌细胞均可检测到MDR1、MRP1和LRP基因mRNA表达,加入5-FU药物处理后,MDR1基因表达增加,MRP1和LRP基因表达无明显变化。香菇多糖能显著降低MDR1和MRP1基因表达,而对LRP表达无影响。香菇多糖联合5-FU抑制MDR1和MRP1基因表达,表达呈缺失状态,而对LRP基因表达无影响(图2、图3和图4)。
3 讨论

图2 MDR1基因mRNA表达
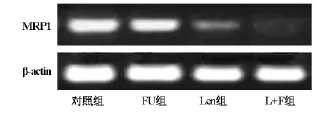
图3 MRP1基因mRNA表达

图4 LRP基因mRNA表达
接受化疗的患者在初次或再次接受化疗时可能出现耐药现象,药物敏感度低于正常人。目前认为肿瘤细胞的耐药主要和诱导表达多药耐药基因相关,多药耐药基因主要包括MDR1、MRP1和LRP[9]。MDR1基因编码产物P-糖蛋白位于细胞膜,由两个完全相同的单体结构构成每个单体有一个ATP结合位点,跨膜区域构成药物通道盒式结构,ATP结合位点与能量供应有关,P-糖蛋白利用ATP水解功能将抗肿瘤药物泵出胞膜外[10]。MRP1基因编码的多药耐药相关蛋白1属于非P-gp跨膜糖蛋白ATP依赖泵,能将带负电荷的药物分子逆浓度泵出到胞外,减少胞内药物浓度,还可改变细胞浆及细胞器的pH值,使药物到达作用部位的靶位点时浓度减少,避免药物与靶点结合,直接参与肿瘤的转移[11]。LRP广泛分布于正常组织,使顺铂不能通过核孔进入细胞核,阻止以胞核为效应点的药物转运到胞浆中;将进入胞浆的药物转运到运输囊泡中,起隔绝药物作用,最终通过胞吐的方式到细胞外,主要介导烷化剂的耐药[12]。目前研究表明,人工抑制多药耐药基因表达能显著改善耐药现象,提高化疗药物的疗效。
5-FU为细胞周期特异性药,主要抑制S期细胞。在体内转变为5-氟-2-脱氧尿嘧啶核苷酸,抑制胸腺嘧啶核苷酸合成酶,阻断脱氧尿嘧啶核苷酸转变为脱氧胸腺嘧啶核苷酸而抑制DNA的生物合成。研究表明,梯度5-FU浓度刺激导致细胞多药耐药基因表达增加,利用该机制已经成功制备5-FU耐药细胞株[13,14]。本研究表明 5-FU 接触 SW480结肠癌细胞后,MDR1表达增加,该现象与Theile等[15]研究一致。香菇多糖能显著降低 MDR1和MRP1基因表达,而对LRP表达无影响,其具体作用机制有待进一步研究。
5-FU为S周期特异性抑制剂,抑制细胞进入有丝分裂器,本研究也证实该现象。5-FU联合香菇多糖后,细胞仍然表现为停滞于G0/G1期特点,表明香菇多糖并没有改变5-FU作用特点,但细胞增殖速度明显降低,凋亡增加,我们推测是香菇多糖增加了SW480结肠癌细胞对5-FU的敏感性。香菇多糖能显著降低多药耐药基因表达,正是该机制导致SW480对5-FU诱导耐药作用减少,从而增加了细胞对5-FU的敏感度,但两者之间是否存在因果关系,有待进一步研究。
[1]赵 军.香菇多糖联合奥沙利铂治疗恶性胸腔积液疗效观察[J].实用医学杂志,2010,26(14):2631.
[2]Yoshino S,Watanabe S,Imano M,et al.Improvement of QOL and prognosis by treatment of superfine dispersed lentinan in patients with advanced gastric cancer[J].Hepatogastroenterology,2010.57(97):172.
[3]Ng ML,Yap AT.Inhibition of human colon carcinoma development by lentinan from shiitake mushrooms(Lentinus edodes)[J].J Altern Complement Med,2002,8(5):581.
[4]李志英,朱应群,张 平,等.香菇多糖联合GP方案对晚期非小细胞肺癌的疗效观察[J].实用医学杂志,2009,25(20):3480.
[5]Zhou LD,Zhang QH,Zhang Y,et al.The shiitake mushroom-derived immuno-stimulant lentinan protects against murine malaria blood-stage infection by evoking adaptive immune-responses[J].Int Immunopharmacol,2009.9(4):455.
[6]庞志东,李文锋.DC联合香菇多糖激活TIL体外抗小鼠肝癌研究[J].广西医科大学学报,2009,26(6):909.
[7]王 峻,周智东,夏大静.香菇多糖增强树突状细胞瘤苗的抗肿瘤作用及其机制研究[J].中国中西医结合杂志,2007,27(1):60.
[8]Harada K,Itashiki Y,Takenawa T,et al.Effects of lentinan alone and in combination with fluoropyrimidine anticancer agent on growth of human oral squamous cell carcinoma in vitro and in vivo[J].Int J Oncol,2010,37(3):623.
[9]Perez-Sayans M,Somoza-Martin JM,Barros-Angueira F,et al.Multidrug resistance in oral squamous cell carcinoma:The role of vacuolar ATPases[J].Cancer Lett,2010,295(2):135.
[10]Susa M,Iyer AK,Ryu K,et al.Inhibition of ABCB1(MDR1)expression by an siRNA nanoparticulate delivery system to overcome drug resistance in osteosarcoma[J].PLoS ONE,2010,5(5):e10764.
[11]Donmez Y,Akhmetova L,Iseri OD,et al.Effect of MDR modulators verapamil and promethazine on gene expression levels of MDR1and MRP1in doxorubicin-resistant MCF-7cells[J].Cancer Chemother Pharmacol,2010,145.
[12]El-Sharnouby JA,Abou El-Enein AM,Ghannam EI,et al.Expression of lung resistance protein and multidrug resistance-related protein(MRP1)in pediatric acute lymphoblastic leukemia[J].J Oncol Pharm Pract,2010,16(3):179.
[13]Tentes IK,Schmidt WM,Krupitza G,et al.Long-term persistence of acquired resistance to 5-fluorouracil in the colon cancer cell line SW620[J].Exp Cell Res,2010,316(19):3172.
[14]Zhou Y,Ling XL,Li SW,et al.Establishment of a human hepatoma multidrug resistant cell line in vitro[J].World J Gastroenterol,2010,16(18):2291.
[15]Theile D,Ketabi-Kiyanvash N,Herold-Mende C,et al.Evaluation of drug transporters'significance for multidrug resistance in head and neck squamous cell carcinoma(Head Neck,2010)1031.
