薄膜分散联合冻融法制备小菜蛾抗菌肽脂质体研究
2012-04-15邱瑞桂靳世英徐和徐平华靳士晓孟小林袁海龙韩晋
邱瑞桂 靳世英 徐和 徐平华 靳士晓 孟小林 袁海龙 韩晋
小菜蛾抗菌肽(pxCECA1 from Plutella xylostella,CA)属于动物抗菌肽,是从昆虫小菜蛾幼虫体内提取分离而得,具有抗菌活性高,抗菌谱广的特点[1]。而且由于抗菌肽作用于细菌细胞膜,破坏其完整性并产生穿孔现象,造成细胞内容物溢出胞外而死亡。这一独特的抗菌靶位点和新的抗菌机制,使得细菌难以对抗菌肽产生抗药性,从而能有效抑制和杀死耐药性病原菌[2]。但CA 易降解变质,经纯化的CA 在室温下放置5 天将会发生降解,而且随温度的增高,降解速率越快,注射给药后,体内分解破坏快[1]。
脂质体(liposomes)是由一种或多种两亲性分子双层膜包裹而成的具有一个或多个水性腔室的微泡,将药物包裹或镶嵌在脂质体中形成脂质体药品。脂质体作为活性物质的载体,具有缓释和促进透皮吸收作用的功能,若将CA 制成脂质体,有望提高药物的稳定性及利用率[3]。脂质体的制备方法很多,有薄膜法、复乳法、逆相蒸发法、乙醚注入法、反复冻融法等[4],由于CA 的热不稳定性,笔者采用薄膜超声联合反复冻融法制备CA 脂质体,最后将其冷冻干燥成粉末,并对其形态、粒径及分布、包封率、加速稳定性进行了考察,为CA 脂质体剂型提供必要的实验依据。
1 仪器与试药
Agilent ll00 高效液相色谱仪(含在线脱气机;四元梯度泵;自动进样器;DAD 检测器;HP Chem.station 化学作站,Agilent 公司);扫描电镜(S-4800,日立,日本);NanoZS90 粒径分析仪(Malvern 公司);涡旋混合器(WH861,北京科尔德科贸有限公司);旋转蒸发仪(上海医械专机厂);冷冻干燥机(美国Labconco 公司)。
CA 原料药(98.6%,批号:20120421,由解放军302 医院药学部制剂研究室自制)、CA 对照品(99.8%,批号:20120405,由武汉大学提供);卵磷脂(上海太伟药业有限公司);胆固醇(天津市博迪化工有限公司);甘露醇(天津市科密欧化学试剂有限公司)。
2 方法与结果
2.1 CA 脂质体的制备
采用薄膜分散法制备。按优化处方,称取卵磷脂、胆固醇,置圆底烧瓶中,加入氯仿20 ml 溶解,40 ℃水浴旋转蒸除有机溶剂,使脂质在器壁上形成一层均匀的薄膜。将300 μg CA 溶入含有5%甘露醇的磷酸盐缓冲溶液(pH=6.5),旋转洗膜,水化一定时间后,冰水浴探头超声15 分钟,即得CA 脂质体混悬液。混悬液放入-20 ℃冰箱冷冻24 小时一定时间,然后在室温下解冻,反复冻融,经冷冻干燥后即得CA 脂质体冻干粉。
2.2 正交试验优化脂质体处方
经单因素试验预试,确定对包封率影响较大的因素为卵磷脂与胆固醇比值(A),卵磷脂与CA 比值(B),水化体积(C),冻融次数(D),各因素设3 个水平(如表1)。以药物包封率为主要评价指标,脂质体粒径及分布为辅助,按L9(34)正交设计表安排正交试验,确定CA 脂质体的最优处方及工艺。
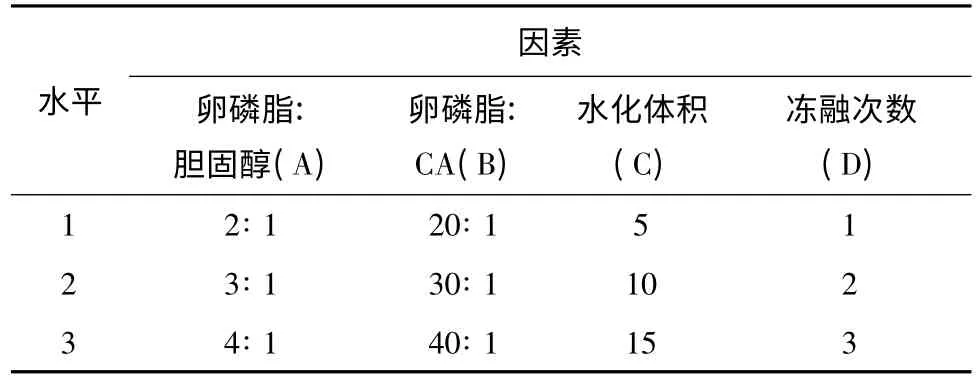
表1 正交设计因素水平表
由试验结果分析可知,各因素对药物包封率影响大小的顺序为B >A >D >C。得到各因素的最佳组合为A3B2C2D3,即卵磷脂与胆固醇比值为4∶ 1,卵磷脂与CA 比值为20∶ 1,水化体积为10 mL,冻融3 次。随着冻融次数的增加,药物的包封率得到了增加,但脂质体的粒径分布也随之增大,从而增大了CA 脂质体的不稳定性。综合考虑对包封率与粒径的影响,最终确定以冻融2 次为佳。
2.3 CA 脂质体扫描电镜形态观察
将脂质体粉末均匀涂在扫描电镜样品池上,表层喷金以获得更好的导电率,将样品池置于扫描电镜内观察,扫描电压设为1.5 KV。可见CA 脂质体粒子均匀、圆整,为球形或类球形,见图1。
2.4 CA 脂质体粒径及分布测定
CA 脂质体复溶后用水稀释,经激光散射粒度分析仪测定脂质体粒径及分布。结果表明,CA 脂质体粒度分布较均匀,平均粒径为(223.1±31.2)nm,多分散性指数为0.189。粒径分布图见图2。

图1 CA 脂质体扫描电镜图
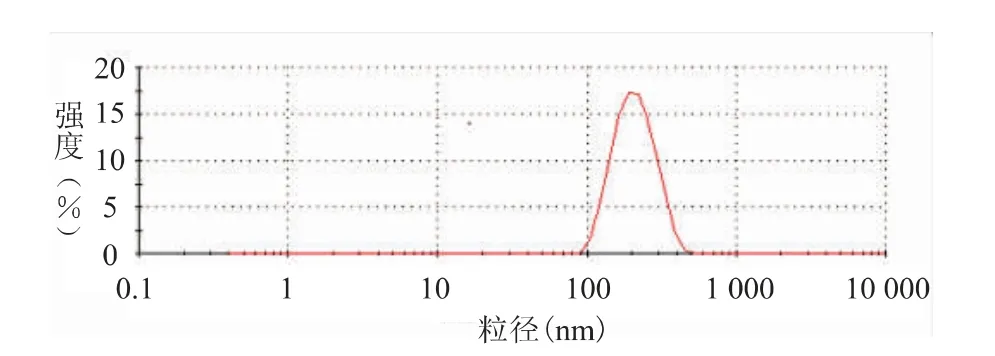
图2 CA 脂质体粒径分布图
2.5 CA 脂质体包封率的测定
2.5.1 HPLC 测定CA 含量方法的建立
HPLC 色谱条件:色谱柱为Agilent Alltima C18(250 mm×4.6 mm,5 μm),流动相为0.05%三氟乙酸(TFA)溶液-甲醇-乙腈(95∶ 2.5∶ 2.5),用前经0.45 μm 滤膜滤过,流速1.0 ml/min,进样量10 μl,检测波长275 nm,柱温25 ℃。
对照品溶液的制备:精密称取CA 对照品5.0 mg,置50 ml 量瓶中,加纯净水溶解并稀释至刻度,得100 μg/ml CA 对照品储备液。
线性关系考察:精密吸取对照品溶液适量,用流动 相 分 别 配 制 成1.25、2.5、5、12.5、25 和50 μg/ml系列浓度的标准溶液,按上述色谱条件,分别精密吸取10 μl 进样,以峰面积对进样量(μg)作线性回归。得线性回归方程为(n=6):Y=4.046×104X+1.034×103,r=0.9994。结果表明,抗菌肽浓度在1.25 ~50 μg/ml 范围内与峰面积线性关系良好。
精密度与回收率:分别取低、中、高三个浓度(2.5、12.5、37.5 μg/ml)的CA 标准溶液,重复测定6 次,连续6 天测定,计算得出日内、日间RSD 分别为1.87%、1.65%、1.53%和2.51%、1.97%、1.59%。平均回收率为99.7%、100.4%、100.7%,RSD 为1.68%。
2.5.2 包封率的测定
冻干前:精密量取CA 脂质体混悬液200 μl 置10 ml 量瓶中,加入1 ml 乙醇,超声20 分钟,放冷至室温,用流动相定容,进样测定总药物量。另取脂质体混悬液适量置1.5 ml 离心管中,8000 转/分离心10 分钟,精密量取上清液200 μl 置10 ml 量瓶中,同上操作,测定游离药物量,计算包封率。
冻干后:精密称取CA 脂质体冻干粉5 mg 置5 ml量瓶中,加蒸馏水复溶,摇匀,得脂质体混悬液。精密量取脂质体混悬液200 μl 置10 ml 量瓶中,加乙醇1 ml,超声20 分钟,放冷至室温,用流动相定容,进样测定总药物量。另取脂质体混悬液适量置1.5 ml 离心管中,8000 转/分离心10 分钟,精密量取上清液200 μl 置10 ml 量瓶中,同上操作,测定游离药物量,计算包封率。结果,CA 脂质体在冷冻干燥前的平均包封率为59%,在经过冷冻干燥处理后,其包封率得到了提高。同时,粒径和多分散指数也相应增大。见表2。

表2 CA 脂质体冻干前后的指标变化
2.6 CA 脂质体稳定性考察
分别在4 ℃和25 ℃下,将冻干后的CA 脂质体样品放置3 个月,于0、1、2、3 月取样,考察脂质体的外观、再分散性、含量、渗漏率、粒径及多分散指数。考察结果显示,4 ℃下保存的脂质体冻干品为类白色块状物,随时间无明显变化,而25 ℃下保存的样品随时间的推移逐渐变为淡黄色块状物。各时间点取样加水振摇进行再分散,25 ℃下贮存的CA 脂质体的再分散性明显比4 ℃条件下的样品要慢,且伴有胶状物长时间不能分散。4 ℃条件下的各时间点CA 脂质体样品均能在2 分钟内快速分散成均匀的混悬液,再分散性良好。25 ℃条件下,CA 脂质体渗透率、粒径及多分散性均显著高于4 ℃下样品的相应指标,稳定性显著降低。见表3。(渗漏率=储存一定时间后渗漏到介质中的药量/储存前包封的药量×100%)
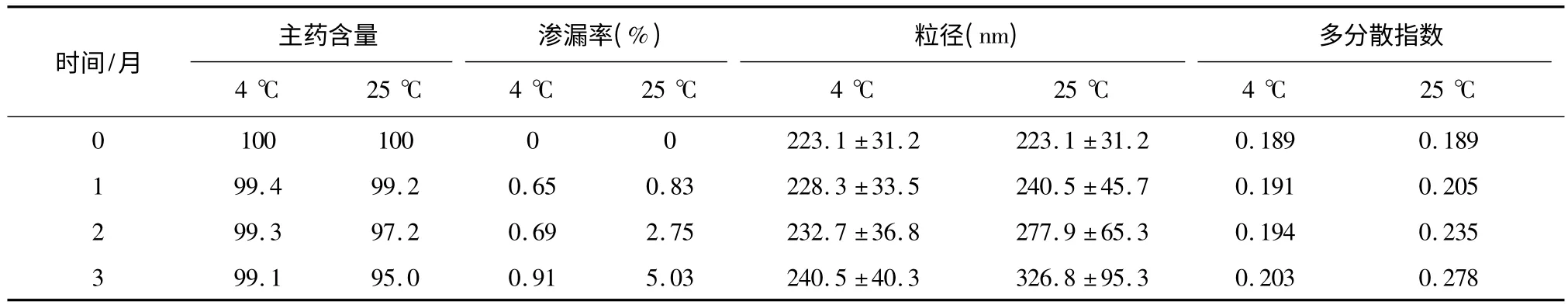
表3 CA 脂质体稳定性考察指标变化表
3 讨论
亲水性药物脂质体无论是在制备还是储存过程中都存在一个渗漏的问题,药物分配在外水相增多,使包封率降低。反复冻融法被证明是一种有效的保护药物不渗漏的方法[4-5]。与其他方法相比,冻融法具有操作简单、包封率高、药物避免接触有机溶媒等特点,且制备过程无需加热,尤其适用于对热不稳定的水溶性药物。本研究采用薄膜分散联合冻融法制备了CA 脂质体,并对其形态、粒径、zeta 电位、包封率及贮存稳定性进行了考察。
试验结果表明,经正交试验优选制备的CA 脂质体粒子均匀、圆整,为球形或类球形,平均粒径为(223.1±31.2)nm,多分散性指数为0.189,zeta 电位为-35.8 mV。多分散指数与zeta 电位是评价胶体分散体系物理稳定性的重要指标,上述试验结果预示了CA 脂质体具有较好的稳定性。
为了降低CA 脂质体在冷冻、融化和水合过程中的破坏,作者在处方中加入了甘露醇作为冷冻防护剂。采用薄膜分散联合冻融法制备的CA 脂质体包封率为62%,相比未经过冻融处理的样品包封率提高了12%。冻融法提高包封率的机理可能是由于冰冻使磷脂周围药物浓度增高,在反复冻融过程中粒径小的脂质体互相融合成稍大脂质体,粒径趋于均匀化,使脂质体包封率明显提高[6];也有学者认为冻融法提高包封率的机理可能是形成了某种暂时的孔洞使药物在平衡前由外相进入了内水相中[7]。在冻融过程中,本课题组以包封率为指标对冻融次数进行了考察。结果发现,随冻融次数的增加,CA 包封率逐渐增加,但同时脂质体粒径分布也随之明显增大,增加了药物制剂贮存的不稳定性,所以在保证包封率较高的前提下,本课题组选择了冻融2 次为最佳工艺,脂质体平均粒径控制在223 nm左右。
最后本课题组采用冷冻干燥法将CA 脂质体制成干粉以降低磷脂及药物的氧化和水解速度,同时,冻干保护剂也保持了脂质体膜结构的完整性,克服脂质体聚集、融合及药物渗漏等不稳定因素[8-9],解决了CA 脂质体长期贮存稳定性问题。
[1] Hong Wang,Xiao-lin Meng,Jin-ping Xu,et al.Production,purification,and characterization of the cecropinfrom Plutella xylostella,pxCECA1,using an intein-induced self-cleavable system in Escherichia coli[J]. Appl Microbiol Biotechnol,2012,94(4):1031-1039.
[2] Casteels P,Ampe C,Jacobs F,et al.Apidaecins:antibacterial peptides from honeybees[J].The EMBO Journal,1989,8(8):2387-2391.
[3] 朱雨晴,石森林.中药脂质体稳定性的研究进展[J]. 药学学报,2009,44(11):1211-1215.
[4] 刘晓谦,王锦玉,仝燕,等. 脂质体制备技术及其研究进展[J]. 中国药学杂志,2011,46(14):1084-1088.
[5] 董泽民.赖氨匹林脂质体鼻腔给药的研究[J].中国医药工业杂志,1995,26(5):199-202.
[6] 张奇,邓英杰.冻融法制备5-氟尿嘧啶脂质体及其稳定性考察[J]. 沈阳药科大学学报,2000,17(2):87-89.
[7] 米宏杰,王瑞华,徐冰. 简述亲水性药物脂质体的制备[J]. 中华临床医学研究杂志,2006,12(16):2219-2220.
[8] 王健,李明轩. 冷冻干燥对提高脂质体稳定性的研究概况[J]. 中国医药工业杂志,2005,36(9):576-580.
[9] 邓礼荷,韦敏燕,汤晨懿,等.冻干工艺及保护剂对羟基喜树碱脂质体质量的影响[J]. 中国医药工业杂志,2012,43(1):30-34.
