人膜蛋白CD81的原核表达与纯化*
2012-03-19朱海珍雷少华刘春艳于晓妍高益敏
朱海珍,雷少华,刘春艳,焦 宇,于晓妍,高益敏
(1.湖南大学生物学院,湖南长沙 410082; 2.内蒙古科技大学包头医学院,内蒙古包头 014000)
pCold TF原核表达载体是一种插入蛋白可溶性标签的融合型冷休克表达载体,空载体融合表达的顺序为六聚组氨酸(His-Tag)、Trigger Factor(TF)、蛋白酶切位点和多克隆位点序列.蛋白酶切位点依次为HRV 3Cprotease,Thrombin和Factor Xa,用于去除融合蛋白的可溶性标签.TF是一种原核的核糖体结合伴侣蛋白,相对分子质量约4.8×104,它能够促进新生肽链的共翻译折叠,与目的蛋白融合表达,提高目的蛋白的可溶性.载体上带有冷休克表达系统,严格控制载体在低温条件下才能表达目的蛋白,进一步促进了目的蛋白的可溶性表达.
人CD81是一种四跨膜的非糖基化膜蛋白,由胞内的N端和C端、4个跨膜结构域、胞外小环和胞外大环4部分组成,相对分子质量约2.6×104,在B细胞、T细胞、肝细胞等多种细胞中均有表达.CD81参与细胞的粘附和信号转导,具有影响细胞增殖和分化等生物学功能[1],是细胞表面的免疫调节分子[2],并参与丙型肝炎病毒(hepatitis C virus,HCV)感染宿主细胞,作为HCV的一个受体介导病毒颗粒进入宿主细胞[3],HCV包膜蛋白E2与CD81胞外大环相互结合实现HCV的感染[4-5].针对CD81的靶向药物及特异性抗体具有抑制HCV感染的潜在功能[6-7],人膜蛋白CD81的原核表达与纯化,为今后靶向药物筛选、抗体制备及深入研究CD81与HCV之间的关系奠定了基础.
pET28b是一种常规的原核表达载体,含有T7启动子、乳糖操纵子和多克隆位点序列等基本功能元件,在蛋白原核表达与纯化实验体系中应用广泛.在预实验中,将人cd81基因克隆到pET28b载体中尝试原核表达,发现没有可溶性目的蛋白的表达.pCold TF不仅有pET28b中的基本功能元件,还包含了冷休克表达系统和TF助溶蛋白,通过严格控制目的蛋白低温表达,以及TF的可溶性标记功能和分子伴侣作用,可以使一些表达困难的基因获得更高概率的可溶性表达.本课题改造pCold TF载体,在保留冷休克及融合表达系统的前提下,去除原载体上的His-Tag序列,一方面提高了人CD81蛋白融合表达的效率和可溶性,另一方面有利于融合蛋白中的TF助溶蛋白的去除,获得不含助溶蛋白标签的全长人CD81蛋白.
1 材料与方法
1.1 材 料
大肠杆菌菌株DH5α,BL21(DE3),pET28b质粒,人脾脏cDNA为本室保存;pCold TF质粒,DNA marker和T4连接酶购自宝生物公司(TaKa-Ra);PCR试剂盒购自Roche公司;质粒纯化,DNA回收试剂盒,Factor Xa蛋白酶购自QIAGEN公司;限制性内切酶购自Promega公司;Ni-NTA镍离子亲和层析柱购自GE公司;PVDF膜和蛋白marker购自Bio-rad公司;anti-his鼠源单克隆抗体购自天根公司;羊抗鼠二抗购自Invitrogen公司;ECL发光试剂盒购自Thermo公司.
1.2 pCold TF载体的改造
1.2.1 pCold TF载体的改造方案
方案设计的基本原则是使用PCR分别扩增His-Tag前后的部分DNA片段,PCR产物两端分别带有限制性酶切位点,在His-Tag部分引入一个载体不包含的限制性酶切位点,分别酶切pCold TF质粒和两个PCR产物,再将这3个片段连接成新载体质粒,实现以限制性酶切位点替换His-Tag的目的.在NCBI上获取pCold TF载体序列,经搜索发现271~288位为His-Tag序列,109~114位和699~704位分别为限制性酶切位点NheⅠ和BubⅠ,且NheⅠ和BubⅠ在载体中是单一的酶切位点,因此可用于本载体的改造.PCR扩增109~270位的DNA片段P1和289~704位的DNA片段P2,并在P1 3′端和P2 5′端的引物中添加限制性酶切位点SpeⅠ.NheⅠ和BubⅠ双酶切pCold TF载体,NheⅠ和SpeⅠ双酶切P1,SpeⅠ和BubⅠ双酶切P2,再将酶切后的载体、P1和P2进行连接,获得重组质粒(图1).
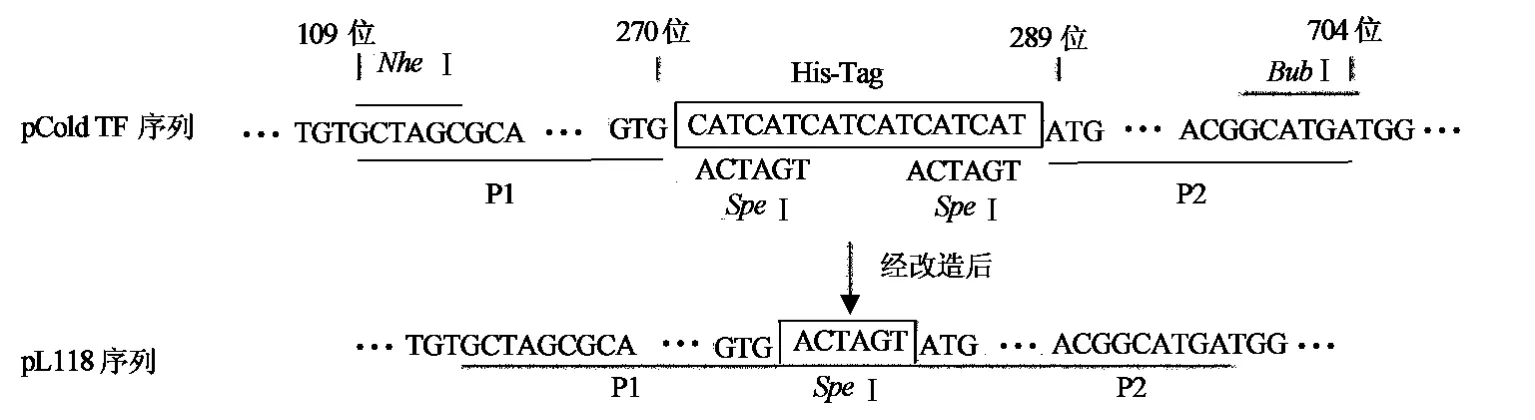
图1 pCold TF载体改造方案图Fig.1 Schematic diagram of vetor modification of pCold TF
1.2.2 pCold TF载体的改造方法
P1 5′端(NheⅠ)引物:5′-cgcgcgctagcgctagcgcatatccagtgta-3′;P1 3′端(SpeⅠ)引物:5′-ctgcagactagtcactttgtgattcatggtg-3′;P2 5′端(SpeⅠ)引物:5′-cgcgcactagtatgcaagtttcagttgaaaccactc-3′;P2 3′端(BubⅠ)引物:5′-ctgcaggcatgccgtcaacgtca-3′;引物合成与纯化由上海生工公司完成.应用PCR试剂盒扩增目的片段的反应体积为50μL.循环参数为:95℃预变性2min;然后95℃30s,60℃30s,72℃40s,35个循环;72℃延伸5min.按照限制性内切酶的使用说明,分别双酶切pCold TF载体、P1和P2,使用T4连接酶将酶切后的片段相连接,将连接产物转化大肠杆菌DH5α,挑取生长在平板上的单克隆菌落,培养后提取质粒进行酶切鉴定.
1.2.3 pL118载体的酶切鉴定及测序
按照限制性内切酶的使用说明,用SpeⅠ单酶切pCold TF和pL118载体,用NheⅠ,SpeⅠ和BbuⅠ三酶切pCold TF和pL118载体,1%琼脂糖凝胶电泳鉴定.使用P1 5′端引物和P2 3′端引物对pL118进行正反测序,由上海生工公司完成.
1.3 蛋白的表达与纯化
1.3.1 空载体和重组质粒蛋白的表达
以人脾脏cDNA为模板,PCR扩增cd81基因的编码序列,将其装入pET28b或pL118载体中.5′端(NdeⅠ)引物:5′-cccatatgggagtggagggctgcaccaa-3′,将其克隆到pET28b载体中的3′端(BamHⅠ)引物:5′-cgggatcctcagtacacggagctgtt-3′,将其克隆到pL118载体中的3′端(PstⅠ和His-Tag)引物:5′-ctgcagctgcagtcagtgatggtgatggtgatggtacacggagctgttc cggat-3′.将需要表达蛋白的质粒转入大肠杆菌菌株BL21(DE3)中,37℃摇菌过夜,次日以1∶50扩大培养至OD值0.6~0.8,25℃诱导pET28b和pET28b-hCD81菌表达12h,16℃诱导pCold TF,pL118和pL118-hCD81表达24h,收集细菌沉淀,用于蛋白纯化或-80℃冻存备用.
1.3.2 人CD81蛋白的纯化
使用美国GE公司的Ni-NTA镍离子亲和层析柱纯化蛋白,由于pL118-hCD81质粒表达的融合蛋白是可溶性的,因此在非变性条件下(Binding Buffer:20mmol/L磷酸钠,500mmol/L NaCl,5mmol/L咪唑,PH7.4)裂解细菌和纯化目的蛋白.采用溶菌酶超声破碎法裂解细菌,将裂解液上清通过Ni-NTA层析柱后,用Washing Buffer(20mmol/L磷酸钠,500mmol/L NaCl,50mmol/L咪唑,PH7.4)洗涤,最后用Elution Buffer(20mmol/L磷酸钠,500mmol/L NaCl,500mmol/L咪唑,PH7.4)洗脱目的蛋白.收集的Elution Buffer即为目的蛋白,具体操作参照Ni-NTA层析柱使用说明.
1.4 Factor Xa蛋白酶切
40μL酶切反应体系:10μg融合蛋白,1UFactor Xa蛋白酶,Reaction Buffer至40μL.酶切反应混合液20℃孵育9h,然后混合液在Binding Buffer中透析过夜,再利用Ni-NTA层析柱获取不含TF助溶蛋白的全长人CD81蛋白,过程方法同上述人CD81蛋白的纯化.
1.5 Western blot分析
细菌裂解液上清或纯化的蛋白进行SDSPAGE,随即将电泳后的蛋白转移到PVDF膜上,用5%的脱脂牛奶室温封闭PVDF膜1h,TBST震荡洗涤PVDF膜3次,每次5min.加入1∶1 000稀释的anti-his鼠源单克隆抗体,室温孵育1h,TBST洗涤3次,每次5min.再用HRP标记的羊抗鼠二抗室温孵育1h,TBST洗涤3次,每次5min.最后用ECL发光试剂显色.
2 结 果
2.1 pL118载体的构建与鉴定
以融合型冷休克原核表达载体pCold TF为模板,PCR扩增载体109~270位的DNA片段P1和289~704位的DNA片段P2,载体中271~288位为His-Tag序列,并在P1 3′端和P2 5′端的引物中添加限制性酶切位点SpeⅠ(图1),PCR产物经2%琼脂糖凝胶电泳后分别出现约200bp和450bp的特异性条带,与预期P1和P2的大小一致(图2).P1和P2分别双酶切处理后,与经过NheⅠ和BbuⅠ酶切的pCold TF载体片段连接,获得重组质粒.酶切鉴定结果显示,重组质粒能被SpeⅠ单酶切,pCold TF质粒则不能被酶切.NheⅠ,SpeⅠ和BbuⅠ三酶切重组质粒,出现与P1和P2大小相同的2个DNA片段,而pCold TF质粒只出现大小约650bp的DNA片段(图3).DNA测序证实,重组质粒100~710位序列中His-Tag序列被限制性酶切位点SpeⅠ序列ACTAGT替代,其他序列保持不变,获得与设计序列完全一致的质粒,将原质粒和重组质粒分别转化大肠杆菌BL21(DE3),原核表达显示改造前后质粒的表达水平不受影响,均有54ku左右的空载蛋白表达(图4中泳道3和泳道4).将此新质粒命名为pL118.
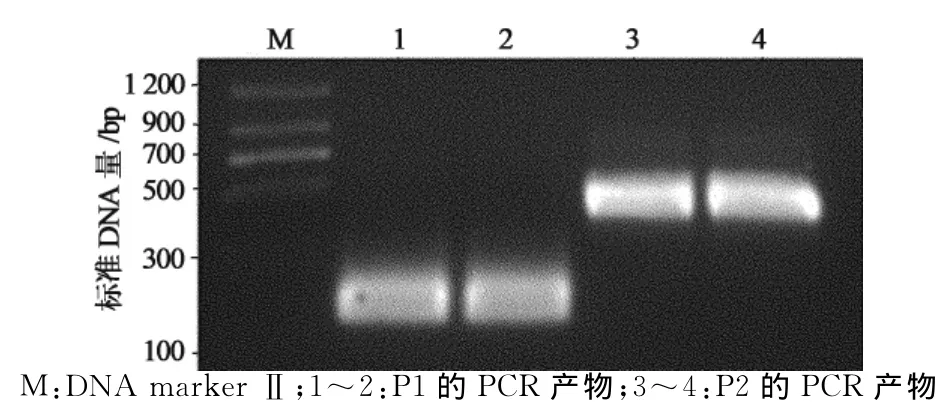
图2 pCold TF载体中DNA片段P1和P2的PCR产物Fig.2 PCR product of DNA fragment P1and P2in pCold TF

图3 pCold TF和pL118质粒酶切鉴定电泳图Fig.3 Gel electrophoresis of plasmids of pCold TF and pL118digested by restriction enzymes
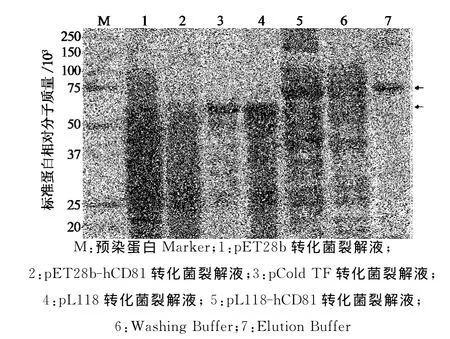
图4 目的蛋白原核表达与纯化SDS-PAGE图Fig.4 SDS-PAGE gel of target proteins in prokaryotic expression and purification
2.2 人cd81在pL118中融合表达与纯化
pL118载体不含His-Tag序列,将cd81基因克隆到该载体时,需要通过PCR引物在基因的3′端添加His-Tag序列,以利于融合蛋白的纯化.将质粒pET28b-hCD81和pL118-hCD81分别转化大肠杆菌BL21(DE3),IPTG诱导表达,考马斯亮蓝染色SDS-PAGE胶上可见pL118-hCD81菌中CD81融合蛋白的可溶性表达,其大小约7.5×104,与理论预期值一致,而pET28b-hCD81菌则没有表达(图4中泳道2和泳道5).应用Ni-NTA层析柱对CD81融合蛋白进行非变性蛋白纯化,在7.5×104处得到特异的蛋白条带(图4中泳道7).
2.3 蛋白酶切去除TF助溶蛋白
应用pL118载体原核表达获得的人CD81融合蛋白包含4部分,即TF助溶蛋白、蛋白酶切位点、CD81蛋白和His-Tag.为了去除TF助溶蛋白,使用Factor Xa蛋白酶对CD81融合蛋白进行酶切,即可将CD81融合蛋白分成TF助溶蛋白和CD81蛋白2个部分,再将酶切后的蛋白混合液通过Ni-NTA层析柱,利用Ni-NTA层析柱对CD81蛋白3′末端His-Tag的亲和性,实现TF助溶蛋白和CD81蛋白的分离,获得3′端含有His-Tag的全长人CD81蛋白(图5).

图5 Western blot鉴定CD81融合蛋白的蛋白酶切及CD81蛋白的回收纯化Fig.5 Western blot analysis of protease cleavage of CD81 fusion protein and purification of CD81protein
3 讨 论
pCold TF载体拥有冷休克表达系统和TF助溶蛋白,一些表达困难的基因在pCold TF中有更高概率的可溶性表达.但是目的基因在pCold TF中表达得到的融合蛋白含有4.8×104的TF助溶蛋白标签,标签的分子质量偏大,对目的蛋白结构及功能有较大的影响,而去除TF却不方便,因为融合蛋白表达的顺序为His-Tag、TF助溶蛋白、蛋白酶切位点、目的蛋白,利用蛋白酶对融合蛋白进行酶切后,目的蛋白将和His-Tag、TF助溶蛋白分开成为两个蛋白片段,目的蛋白不含His-Tag,不利于目的蛋白的再回收.本文对pCold TF载体进行改造,使之不含His-Tag序列,将目的基因克隆到该载体时,通过在目的基因3′端引物添加His-Tag序列,其融合蛋白表达的顺序为TF助溶蛋白、蛋白酶切位点、目的蛋白、His-Tag,其中His-Tag不仅可用于融合蛋白的纯化,也可用于融合蛋白酶切后目的蛋白的纯化,因为His-Tag仍然保留在目的蛋白上,也可作为标签用于Western blot中目的蛋白的检测,以及结合在Ni-NTA等载体上,用于进一步目的蛋白功能研究和特异性药物筛选等.
通过对pCold TF载体序列中限制性酶切位点的分析,发现位于His-Tag序列前端的NheⅠ和后端的BubⅠ是载体中单一的酶切位点,且载体不含酶切位点SpeⅠ.通过设计特定的PCR引物,并运用PCR、限制性酶切、连接等分子生物学方法,成功去除pCold TF载体中的His-Tag序列,并且不影响原载体的蛋白表达能力,将此新质粒命名为pL118.pL118继承了原载体高效蛋白可溶性表达的优点,并使之有利于去除融合蛋白中的TF助溶蛋白,将His-Tag保留在目的蛋白上.在应用pL118表达融合蛋白时要特别注意的是:在目的基因3′端引物引入His-Tag序列时,将Hig-Tag序列放置在目的基因的编码序列和终止密码子之间,如果His-Tag序列放置在终止密码子之后,融合蛋白的表达将提前终止而不含His-Tag.
膜蛋白具有多种多样的细胞功能,是基础研究及药物开发的理想靶标,然而研究膜蛋白有一个难题,它们的过表达对宿主有毒性而限制蛋白产量,或产生包涵体增加纯化难度.人CD81是一种四跨膜蛋白,将其克隆到pET28b载体中尝试原核表达,发现没有可溶性目的蛋白的表达,关于CD81原核表达的文献报道也集中于CD81胞外大环可溶片段的表达.CD81参与细胞的粘附和信号转导,具有影响细胞增殖和分化等生物学功能,是细胞表面的免疫调节分子,并作为受体介导HCV感染宿主细胞.近期有报道称,CD81不仅是HCV感染中的一个受体,还可影响HCV RNA的复制[8],或通过激活细胞的Raf/MEK/ERK信号通路而影响HCV在宿主细胞中的生活周期[9],在慢性丙型肝炎病人的血清中,可溶性的CD81蛋白水平升高,并参与病人肝纤维化的形成[10],因此对CD81的进一步研究具有重要的理论与实践意义.
4 结 语
本文将CD81克隆到pL118载体中,实现了CD81融合蛋白高效可溶性表达,使用Ni-NTA亲和层析柱对融合蛋白纯化,再利用Factor Xa蛋白酶去除TF助溶蛋白,成功获得含有His-Tag的全长CD81蛋白.人膜蛋白CD81的表达纯化证实了pL118载体使表达困难的基因获得更高概率的可溶性表达,为CD81靶向药物筛选、抗体制备及深入研究CD81与HCV之间的关系奠定了基础.pL118载体的构建以及CD81蛋白的表达纯化方法具有一定的创新性,为表达困难的基因实现原核表达提供了一种新的思路和方法.
[1] LEVY S,TODD S C,MAECKER H T.CD81(TAPA-1):a molecule involved in signal transduction and cell adhesion in the immune system[J].Annu Rev Immunol,1988,16:89-109.
[2] LEVY S,SHOHAM T.The tetraspanin web modulates immune-signalling complexes[J].Nat Rev Immunol,2005,5(2):136-148.
[3] PILERI P,UEMATSU Y,CAMPAGNOLI S,et al.Binding of hepatitis C virus to CD81[J].Science,1988,282(5390):938-941.
[4] FLINT M,MAIDENS C,LOOMIS-PRICE L D,et al.Characterization of hepatitis C virus E2glycoprotein interaction with aputative cellular receptor,CD81[J].J Virol,1999,73(8):6235-6244.
[5] PETRACCA R,FALUGI F,GALLI G,et al.Structure-function analysis of hepatitis C virus envelope-CD81binding[J].J Virol,2000,74(10):4824-4830.
[6] STAMATAKI Z,GROVE J,BALFE P,et al.Hepatitis C virus entry and neutralization[J].Clin Liver Dis,2008,12(3):693-712.
[7] ASHFAQ U A,QASIM M,YOUSAF M Z,et al.Inhibition of HCV 3agenotype entry through Host CD81and HCV E2 antibodies[J].J Transl Med,2011,9:194.
[8] ZHANGY Y Y,ZHANG B H,LSHII K,et al.Novel function of CD81in controlling hepatitis C virus replication[J].J Virol,2010,84(7):3396-3407.
[9] BRAZZOLI M,BIANCHI A,FILIPPINI S,et al.CD81is a central regulator of cellular events required for hepatitis C virus infection of human hepatocytes[J].J Virol,2008,82(17):8316-8329.
[10]WELKER M W,REICHERT D,SUSSER S,et al.Soluble serum CD81is elevated in patients with chronic hepatitis C and correlates with alanine aminotransferase serum activity[J].PLoS One,2012,7(2):e30796.
