Kisspeptin-GPR54-GnRH神经元轴在雌性大鼠中枢性性早熟中的作用
2012-03-10王海莲
王海莲,葛 伟,薛 江
(1山东大学第二医院,济南250033;2山东大学齐鲁医院)
性早熟是一种以青春期发育提前出现为特征的生长发育异常性疾病,是常见小儿内分泌疾病之一。性早熟分为中枢性、外周性两类,中枢性性早熟(CPP)又称为真性性早熟,多因下丘脑视前内侧核及弓状核分泌促性腺激素释放激素(GnRH)过多所致。近年研究发现,KISS-1基因产物Kisspeptin及其受体G蛋白偶联受体54(GPR54)对GnRH释放和青春期启动起重要作用,Kisspeptin/GPR54信号在青春期发生、发展中的作用受到广泛关注。目前,关于Kisspeptin/GPR54信号与CPP关系的研究较少。2010~2011年,本实验以N-甲基-DL-天冬氨酸(NMA)建立雌性大鼠CPP模型,检测其不同发育期下丘脑中KISS-1 mRNA、GPR54 mRN、GnRH mRNA的表达,以探讨Kisspeptin-GPR54-GnRH神经元轴在雌性大鼠CPP中的作用。
1 材料与方法
1.1 材料 NMA(购自Sigma公司),RevertAidTMFirst Strand cDNA Synthesis试剂盒(购自 MBI公司),SYBR Green Real-Time PCR Master Mix试剂盒(购自TOYOBO公司)。26日龄雌性SD大鼠50只,体质量55~70 g,由上海斯莱克实验动物有限责任公司提供。饲养条件为室温20~26℃,每日固定光照14 h。
1.2 方法
1.2.1 动物模型建立及分组 将50只大鼠随机分为对照1组(正常青春前期)、对照2组(正常青春早期)、对照3组(正常青春中期)、实验1组(性早熟青春早期)、实验2组(性早熟青春中期)各10只。自大鼠26日龄起至阴道口开放(VO)之日,实验组皮下注射NMA 40 mg/kg、每日2次,使其青春期提前;对照组皮下注射生理盐水0.2 ml/d。用药后,观察对照2、3组和实验组的VO情况。对VO大鼠每日行阴道细胞涂片,观察其性周期(顺序为发情期、发情后1期、发情后2期、发情间期、发情前期)变化和第1个发情间期(D1)出现时间。实验1组出现第1个发情前期时称体质量后断头处死,按1∶1比例同时处死对照1组;对照2组出现第1个发情前期、对照3组及实验2组出现第2个发情前期时均称体质量后断头处死。
1.2.2 黄体生成素(LH)检测 各组处死前,先用毛细管经其内眦静脉丛采血1 mL,分离血清后置于-20℃冻存,采用过夜温育放免法检测血清LH。
1.2.3 下丘脑组织超微结构观察 各组处死取下丘脑后,参照大鼠脑定位图谱,在其弓状核平面取1 mm×1 mm×1 mm组织,用4%戊二醛液固定48 h后,在电子显微镜下观察其超微结构。
1.2.4 性腺和性器官检测 各组处死后取其子宫及双侧卵巢,称量湿重后用10%甲醛液固定。对卵巢标本行常规石蜡切片(取最大截面),HE染色,在光镜下观察卵巢黄体出现个数。对子宫标本行常规石蜡切片(取垂直横断面),HE染色后,在光镜下用病理切片计算机图像自动分析系统测量子宫壁厚度。根据器官指数=器官湿重/体质量的公式,计算卵巢指数与子宫指数。
1.2.5 KISS-1 mRNA、GPR54 mRNA、GnRH mRNA检测 采用Real-Time RT-PCR法检测各组下丘脑中的KISS-1 mRNA、GPR54 mRNA、GnRH mRNA表达。用Trizol试剂、一步法从下丘脑组织中提取总RNA,紫外线分光光度计测定其RNA浓度和纯度; OD260/OD280为1.8~2.0。以总RNA为模板,根据RevertAidTM First Strand cDNA Synthesis试剂盒说明合成cDNA,逆转录条件为25℃10 min,37℃60 min,95℃ 5 min。采用 Primer5软件设计引物(略),引物由 Invitrogen公司合成。根据 SYBR Green Real-Time PCR Master Mix试剂盒说明,检测KISS-1、GPR54基因表达。反应体系包括2×Mix、Taq聚合酶、正向引物、反向引物各0.5 μL,cDNA 1 μL,加入ddH2O至20 μL。反应条件为95℃ 15 s变性,55℃5 s退火,72℃15 s延伸,共40个循环。扩增结束后分析熔解曲线,采用双标曲线法计算各基因的相对表达量,以对照1组各基因表达量作为对比标准。
1.2.6 统计学方法 采用SPSS13.0统计软件,计量资料以s表示,组间比较用t检验和单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 各组VO时间、D1、卵巢指数、子宫指数、子宫壁厚度、血清LH比较 见表1。
2.2 各组卵巢黄体出现个数 对照1组卵巢黄体出现1~2个/卵巢,实验1、2组和对照2、3组卵巢黄体出现3~5个/卵巢。
2.3 下丘脑组织超微结构 电镜下可见,青春前期组下丘脑弓状核GnRH神经元核较大,呈圆形或椭圆形,通常1个核仁,游离核糖体、高尔基体和线粒体较少;胞质中致密芯分泌颗粒和清亮小泡很少。实验组青春期GnRH神经元核较饱满,高尔基体和线粒体增多;胞质中致密芯分泌颗粒和清亮小泡增多,细胞器形态无明显异常。
表1 各组VO时间、D1、卵巢指数、子宫指数、子宫壁厚度、LH比较(n=10,s)
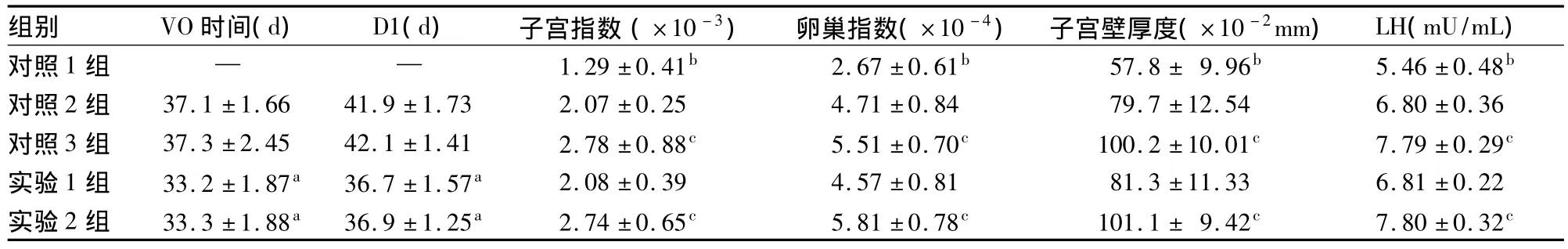
表1 各组VO时间、D1、卵巢指数、子宫指数、子宫壁厚度、LH比较(n=10,s)
注:与对照2、3组比较,aP<0.05;与其他组比较,bP<0.05;与对照2组、实验1组比较,cP<0.05
组别 VO时间(d) D1(d) 子宫指数(×10-3) 卵巢指数(×10-4) 子宫壁厚度(×10-2mm) LH(mU/mL)对照1组 — — 1.29±0.41b 2.67±0.61b 57.8±9.96b 5.46±0.48b对照2组 37.1±1.66 41.9±1.73 2.07±0.25 4.71±0.84 79.7±12.54 6.80±0.36对照3组 37.3±2.45 42.1±1.41 2.78±0.88c 5.51±0.70c 100.2±10.01c 7.79±0.29c实验1组 33.2±1.87a 36.7±1.57a 2.08±0.39 4.57±0.81 81.3±11.33 6.81±0.22实验2组 33.3±1.88a 36.9±1.25a 2.74±0.65c 5.81±0.78c 101.1±9.42c 7.80±0.32c
2.4 各组下丘脑中KISS-1 mRNA、GPR54 mRNA、GnRH mRNA表达比较 见表2。
表2 各组下丘脑中KISS-1 mRNA、GPR54 mRNA、GnRH mRNA表达比较(s)
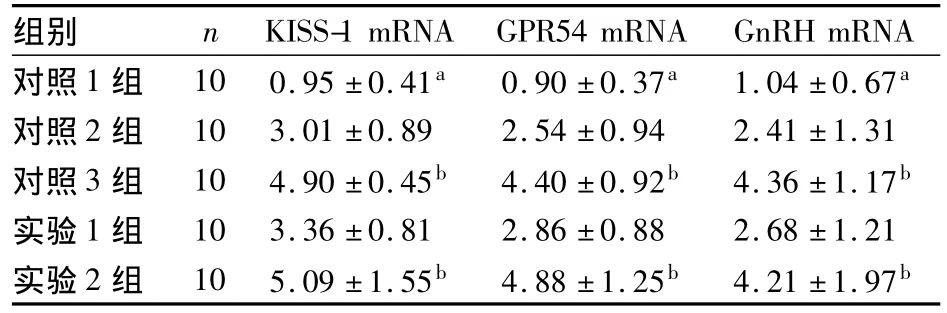
表2 各组下丘脑中KISS-1 mRNA、GPR54 mRNA、GnRH mRNA表达比较(s)
注:与其他组比较,aP<0.05;与对照2组、实验1组比较,bP<0.05
组别 n KISS-1 mRNA GPR54 mRNA GnRH mRNA对照1组 10 0.95±0.41a 0.90±0.37a 1.04±0.67a对照2组 10 3.01±0.89 2.54±0.94 2.41±1.31对照3组 10 4.90±0.45b 4.40±0.92b 4.36±1.17b实验1组 10 3.36±0.81 2.86±0.88 2.68±1.21实验2组 10 5.09±1.55b 4.88±1.25b 4.21±1.97b
3 讨论
CPP表现为正常青春期发育提前,在青春期发育过程中,下丘脑GnRH神经元兴奋起重要作用,GnRH分泌旺盛是青春期发育的基础[1]。神经元兴奋性冲动传递,需要兴奋性神经递质和受体的协同作用。中枢神经系统的兴奋性氨基酸递质主要包括谷氨酸和天冬氨酸,NMA受体是主要的谷氨酸受体亚型,NMA是其重要的激动剂[2]。本研究采用皮下注射NMA方法建立CPP模型,与文献报道[3]相同。本研究显示,实验组VO、D1较对照组提前,表明大鼠青春期提前启动;各组卵巢指数、子宫指数、子宫壁厚度、卵巢黄体出现个数、LH及下丘脑GnRH mRNA表达均高于对照1组(与文献[4]报道相同),且上述指标对照3组高于对照2组、实验2组高于实验1组,对照3组和实验2组、对照2组和实验1组无统计学差异;说明实验组大鼠的下丘脑—垂体—性腺轴逐步完全激活,较正常大鼠性发育提前,其进入青春期后的发育与正常青春期大鼠类似。GnRH主要由位于下丘脑弓状核的GnRH神经元分泌,本研究发现,实验组青春期弓状核GnRH神经元代谢逐渐活跃,分泌旺盛,与正常青春期大鼠类似。因此,皮下注射NMA可提前激活雌性大鼠的下丘脑—垂体—性腺轴,良好地模拟CPP的病理生理过程,建立理想的实验动物模型。
GPR54是一种新的孤儿G蛋白偶联受体[5],在胰腺和胎盘中表达最丰富,在下丘脑、垂体、边缘系统、基底节中表达较丰富[5~7]。KISS-1基因是1996年在黑色素瘤细胞中发现的一种新型的肿瘤转移抑制基因[8],Kisspeptin是KISS-1基因编码产生的多肽家族,其经蛋白水解产生一种含有54个氨基酸的生物活性肽Metastin,作为GPR54的天然配体[6]。Kisspeptin与GPR54结合可激活磷脂酶C,致细胞内磷脂酰肌醇、Ca2+增多,进一步激活细胞外调节蛋白激酶和P38细胞分裂素活化蛋白激酶途径,进行信号传导[7]。有研究表明,鼠类和人类的 KISS-1、GPR54基因突变均可影响正常青春期性发育和LH的脉冲式分泌,导致性腺功能低下或生育能力丧失[9]。Rhie等[10]对 CPP女童研究发现,其血清Kisspeptin明显升高,且与LH峰值、LH峰值/基值、LH/FSH呈正相关,认为Kisspeptin可作为诊断CPP的临床标志物。Shahab等[11]研究发现,在无生殖腺的雄性幼猴侧脑室注射Kisspeptin能刺激LH分泌,出现性早熟表现,表明Kisspeptin能打破青春前期哺乳动物GnRH分泌的中枢性抑制状态;并发现正常雌猴下丘脑KISS-1 mRNA、GPR54 mRNA表达随青春期发育逐渐增加。本研究结果与其报道相似,表明Kisspeptin-GPR54-GnRH神经元轴活化能全面激活青春期哺乳动物的神经内分泌生殖轴。本研究表明,Kisspeptin与GPR54结合可致GnRH神经元活化,代谢活跃,GnRH产生增多,并可能伴随青春发育的全过程。
综上所述,NMA可提前激活下丘脑—垂体—性腺轴,导致雌性大鼠CPP。随着青春期发育,正常发育大鼠、CPP大鼠的下丘脑KISS-1 mRNA、GPR54 mRNA及GnRH mRNA表达逐渐升高,提示Kisspeptin-GPR54-GnRH神经元轴在CPP的发生、发展中起重要作用,可能成为CPP治疗的新靶点。
[1]Terasawa E,Fernandez DL.Neurobiological mechanisms of the onset of puberty in primates[J].Endocr Rev,2001,22(1):111-151.
[2]Moguilevsky JA,Wuttke W.Changes in the control of gonadotrophin secretion by neuro-transmitters during sexual development in rats[J].Exp Clin Endocrinol Diabetes,2001,109(4):188-195.
[3]李海浪,潘键,郑意楠.兴奋性氨基酸受体激动剂诱导雌性大鼠青春期发生的实验研究[J].实用儿科临床杂志,2003,18(12): 952-954.
[4]潘键,李海浪,郑意楠.雌性大鼠真性性早熟发生模型的实验研究[J].中华内分泌代谢杂志,2004,20(1):84-85.
[5]Lee DK,Nguyen T,O'Neill GP,et al.Discovery of a receptor related to the galanin receptors[J].FEBS Letters,1999,446(1): 103-107.
[6]Muir AI,Chamberlain L,Elshourbagy NA,et al.AXOR12,a novel human G protein-coupled receptor,activated by the peptide KiSS-1[J].J Biol Chem,2001,276(31):28969-28975.
[7]Kotani M,Detheux M,Vandenbogaerde A,et al.The metastasis suppressor gene KiSS-1 encodes kisspeptins,the natural ligands of the orphan G protein-coupled receptor GPR54[J].J Biol Chem, 2001,276(37):34631-34636.
[8]Lee J H,Miele ME,Hicks DJ,et al.KiSS-1,a novel human malignant melanoma metastasis-suppressor gene[J].J Natl Cancer Inst,1996,88(23):1731-1737.
[9]Colledge WH,d'Anglemont de Tassigny X.The role of kisspeptin signalling in the regulation of the GnRH-gonadotrophin ovarian axis in mice[J].Ann Endocrinol,2010,71(3):198-200.
[10]Rhie YJ,Lee KH,Eun SH,et al.Serum kisspeptin levels in korean girls with central precocious puberty[J].J Korean Med Sci,2011,26(7):927-931.
[11]Shahab M,Mastronardi C,Seminara SB,et al.Increased hypothalamic GPR54 signaling:a potential mechanism for initiation of puberty in primates[J].Proc Natl Acad Sci USA,2005,102(6): 2129-2134.
