人乳头状瘤病毒16型E6E7基因与MCA、TPA协同诱导细胞恶性转化的实验研究
2012-03-10李劲涛钟儒刚
武 双,李劲涛,钟儒刚,曾 毅
(北京工业大学生命科学与生物工程学院,北京100124)
人乳头状瘤病毒(HPV)是一种DNA肿瘤病毒,能引起皮肤和黏膜鳞状上皮增殖。高危型HPV感染,特别是HPV16型感染与宫颈癌、口腔癌等多种恶性肿瘤的发生和发展密切相关[1]。HPV16 E6和E7蛋白是导致HPV16相关宫颈癌产生的主要因素之一[2],它们通过破坏细胞正常的增殖、分化及凋亡,诱导细胞永生化及恶性转化。流行病学、分子生物学及临床医学的许多研究均证实,单纯HPV感染不足以导致宫颈癌,一些环境因子,如电离辐射、香烟、饮食、药物以及其他病原微生物等,在肿瘤的形成过程中发挥重要的作用[3]。因此,高危型HPV16与化学物质间的协同致癌作用对肿瘤病因学研究与肿瘤防治具有重要作用。2011年4月~2012年1月,本研究构建了含HPV16 E6、E7基因的重组质粒载体pcDNA E6E7,将其转染Balb/c 3T3细胞,应用细胞转化实验、软琼脂克隆形成实验及SCID小鼠致瘤实验,对HPV16 E6E7基因与化学致癌物MCA和TPA间的协同致癌作用进行了探讨。现报告如下。
1 材料与方法
1.1 材料 Balb/c 3T3细胞、含HPV16全基因组序列的质粒均由中国疾病预防控制中心病毒病预防控制所肿瘤室提供;pcDNA3.1(+)质粒、限制性内切酶等购自TaKaRa公司;质粒提取试剂盒与凝胶回收试剂盒购自Qiagen公司;TRIzol Reagent购自Invitrogen公司;FuGENE HD转染试剂购自 Roche公司;DMEM、DMEM/F12(1∶1)、胎牛血清(FBS)购自Hyclone公司;MCA、TPA、DMSO购自Sigma公司;SCID小鼠购自中国协和医科大学实验动物所。
1.2 方法
1.2.1 含HPV16 E6、E7基因的pcDNA E6E7重组质粒构建 根据HPV16全基因组序列,用Oligo 7引物分析软件辅助设计,分别在E6上游与E7下游增加酶切位点,引物由北京擎科新业生物技术有限公司合成,引物序列:F:5'-CGGGATCCGCCACCATGCACCAAAAGAGAACTG-3',R:5'-CCGGAATTCTTATGGTTTCTGAGAACAGATG-3'。使用引物F(包含BamHⅠ酶切位点和Kozak序列)和R(包含EcoRⅠ酶切位点)扩增HPV16 E6E7基因。扩增产物纯化后与pMD19-T载体连接,经测序鉴定后进行双酶切,回收酶切产物;再与质粒载体pcDNA 3.1(+)相连构建重组质粒pcDNA E6E7,进行测序鉴定。
1.2.2 细胞培养及重组质粒转染 Balb/c 3T3细胞培养于含10%FBS的DMEM培养基中,在37℃、5% CO2饱和湿度培养箱中培养。使用FuGENE HD转染试剂,分别将pcDNA3.1(+)与重组质粒pcDNA E6E7转染Balb/c 3T3细胞,待细胞达亚汇合状态时,进行HPV16 E6E7基因检测和细胞转化实验。
1.2.3 采用RT-PCR技术检测HPV16 E6E7基因表达 收集细胞,提取RNA,经逆转录后,以cDNA为模板扩增HPV16 E6E7片段。收集细胞,提取细胞蛋白,采用Western blot技术检测HPV16 E6E7蛋白表达。
1.2.4 细胞转化实验 取对数生长期的正常细胞和转染细胞,以1×104个/瓶接种后培养24 h,加入0.2 μg/mL MCA,于第 4天换成含 2%FBS的DMEM/F12(1∶1)培养基培养,每周换液2次,于第7、10、14天加入0.1 μg/mL TPA,共培养4周左右,细胞经甲醇固定、Giemsa染色,计数转化灶。实验分为对照组、MCA组、TPA组和MCA+TPA组,每组设立6个平行实验。
1.2.5 软琼脂克隆实验 取1.2%琼脂糖溶液与等体积双倍DMEM培养液制备底层胶,室温凝固。将Hela细胞、正常细胞与转化细胞制成单细胞悬液,分别取1×103个加入0.7%的琼脂糖溶液与等体积双倍DMEM培养液,混匀,铺在底层胶上,置于37℃、5%CO2孵箱中培养2周左右,在显微镜下观察细胞集落形成情况。
1.2.6 SCID小鼠致瘤实验 分别将正常细胞、转染HPV16 E6E7基因的转化细胞和未转染组的转化细胞制成单细胞悬液,接种1×107个细胞于SCID雄性5周龄小鼠前肢皮下,每组3只,定期观察小鼠肿瘤生长情况。
1.2.7 统计学方法 采用SPSS13.0统计软件,数据以s表示,组间比较采用配对t检验。P≤0.01为差异有统计学意义。
2 结果
2.1 重组质粒pcDNA E6E7的构建及酶切鉴定结果 pcDNA E6E7重组质粒经BamHⅠ与EcoRⅠ双酶切后,可得到770 bp左右的目的条带,与预期结果相同。经序列比对后发现E6E7基因完整、读框正确,说明重组质粒pcDNA E6E7构建成功。
2.2 HPV16 E6E7基因、蛋白表达 RT-PCR检测显示,转染组可得到大小为770 bp左右的扩增产物,见图1。说明HPV16 E6E7基因在Balb/c 3T3细胞中表达。Western blot检测显示,转染组可见11、19 kD的目的条带,见图2。说明HPV16 E6和E7蛋白可在Balb/c 3T3细胞中表达。
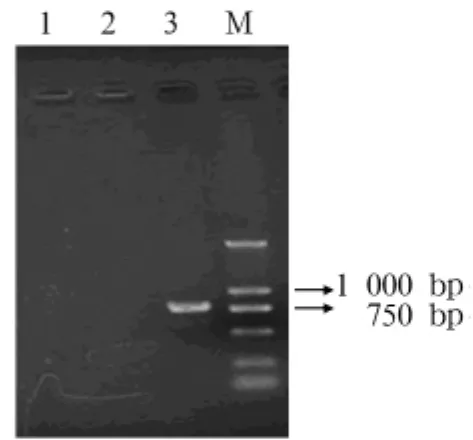
图1 HPV16 E6E7基因表达

图2 HPV16 E6E7蛋白表达
2.3 细胞转化实验结果 转染组细胞在3周内形成清晰的转化灶,可明显缩短实验时间。转化细胞表现为嗜碱深染、致密多层、丧失接触抑制、排列紊乱、转化灶边缘细胞自由定向生长、向周围单层细胞侵袭生长等恶性特征。各组细胞在MCA和TPA诱导下形成的转化灶数见表1。
表1 各组细胞在MCA和TPA诱导下形成的转化灶数(s)
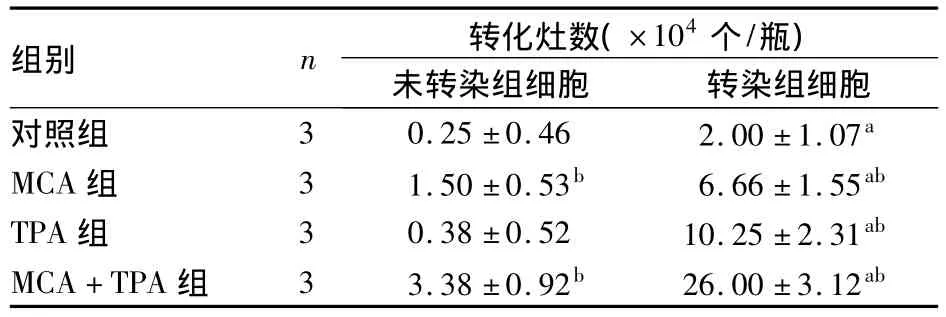
表1 各组细胞在MCA和TPA诱导下形成的转化灶数(s)
注:与未转染组细胞比较,aP<0.01;与对照组比较,bP<0.01
组别 n 转化灶数(×104个/瓶)未转染组细胞 转染组细胞对照组 3 0.25±0.46 2.00±1.07a MCA组 3 1.50±0.53b 6.66±1.55ab TPA组 3 0.38±0.52 10.25±2.31ab MCA+TPA组 3 3.38±0.92b 26.00±3.12ab
2.4 软琼脂克隆实验结果 正常Balb/c 3T3细胞不能形成克隆,阳性对照Hela细胞、转染组的转化细胞与未转染组的转化细胞均能形成克隆。以形成克隆个数多少、生长快慢和直径大小排序,其顺序为Hela细胞、转染组的转化细胞、未转染组的转化细胞,其克隆形成率分别为58.2%、22.8%和7.3%。
2.5 SCID小鼠致瘤实验结果 正常Balb/c 3T3细胞未能在小鼠体内形成肿瘤;接种两种转化细胞的小鼠最终均形成肿瘤,成瘤率为100%。4周时,转染组与未转染组接种转化细胞的小鼠肿瘤直径分别为(1.8±0.4)、(1.3±0.3)cm。
3 讨论
癌症的发生是一个多阶段、多步骤的过程,是多种因素长期共同作用的结果。人类癌症产生的主要原因有物理、化学和生物因素。WHO曾指出80%以上的人类癌症与化学因素有关。化学致癌物可与细胞内的大分子和DNA形成加合物或对其进行修饰,引发DNA结构改变(如DNA链交联、链断裂)和染色体畸变(染色体重排、缺失和数目变化)等,这是肿瘤发生的前提条件和首要因素。Balb/c 3T3细胞转化实验具有较高的一致性、敏感性和特异性,被国际癌症研究所认定为一种有效评价化学物致癌性及促癌性的方法[4]。MCA、TPA均为化学致癌物,本研究显示,在MCA与TPA的诱导下,转染HPV16 E6E7基因的Balb/c 3T3细胞与未转染的Balb/c 3T3细胞均可发生形态转变,形成清晰的转化灶。转染组细胞形成转化灶的个数可增加4~25倍,且实验时间明显缩短,其转化细胞在软琼脂上形成集落的能力及对SCID小鼠的致瘤能力更强。上述结果表明,肿瘤的形成是一个多因素、多阶段、多步骤的过程,HPV16 E6E7基因对诱导细胞恶性转化非常重要,尤其是经化学致癌物的进一步诱导,可加速细胞的癌变进程,最终导致肿瘤形成。
总之,本研究显示,HPV16 E6和E7蛋白可能是导致细胞恶性转化及相关肿瘤发生的主要原因之一。HPV16 E6E7基因与化学致癌物MCA和TPA之间具有协同致癌作用。E6蛋白通过结合和降解p53蛋白,破坏正常的细胞周期调控;E7蛋白则通过与过磷酸化的 pRb结合使 pRb丧失抑癌活性[2,5]。本研究为HPV、环境化学因素与肿瘤病因学的关系提供了证据,对环境化学物、病毒等危险因子评估和肿瘤预防具有一定意义。
[1]Maucort-Boulch D,Franceschi S,Plummer M.International correlation between human papillomavirus prevalence and cervical cancer incidence[J].Cancer Epidemiol Biomarkers Prev,2008,17(3): 717-720.
[2]zur Hausen H.Papillomaviruses in the causation of human cancers-a brief historical account[J].Virology,2009,384(2):260-265.
[3]Madkan VK,Cook-Norris RH,Steadman MC,et al.Theoncogenic potential of human papillomaviruses:a review onthe role of host genetics and environmental cofactors[J].Br J Dermatol,2007,157 (2):228-241.
[4]IARC/NCI/EPA Working Group.Cellular and molecular mechanisms of cell transformation and standardization of transformation assays of established cell lines for the prediction of carcinogenic chemicals:overview and recommended protocol[J].Cancer Res,1985,45(5):2395-2399.
[5]Hebner CM,Laimins LA.Human papillomaviruses:basic mechanisms of pathogenesis and oncogenicity[J].Rev Med Virol,2006,16(2):83-97.
