鱼腥藻PCC7120基因all3211和asl3212的克隆及其功能鉴定
2012-02-19陈思礼尤隽丹
梅 菊, 陈思礼, 刘 欣, 尤隽丹
(中南民族大学生命科学学院, 湖北 武汉 430074)
0 引 言
细菌的毒素-抗毒素系统(TA,toxin-antitoxin system)由位于同一操纵子中的数个碱基重叠的两个基因组成,前者编码毒素蛋白,后者编码抗毒素蛋白[1],通过两种蛋白的相互作用介导应激状态下细胞的生长抑制或死亡[2].E.coli染色体上的mazEF是研究的较为清楚的TA系统之一,它由两个重叠的基因mazE和mazF组成,位于relA基因的下游,mazF编码稳定的毒素蛋白MazF,mazE编码不稳定的抗毒素蛋白MazE[3].MazE与MazF共表达,两者的作用机理已经研究得较为清楚[4,5].当环境胁迫抑制MazE和MazF表达时, 不稳定的抗毒素蛋白MazE被ClpPA降解,稳定的毒性蛋白MazF游离出来,从而启动细胞程序性死亡过程[6].对于细菌染色体上的毒素-抗毒素系统的生理功能,当前存在不同的观点,因此研究蓝细菌染色体上的TA系统对于完善不同种属的细菌染色体上TA系统的研究具有重要意义.
目前有关蓝细菌中TA系统的研究报道还不多,本文通过实验初步证明了PCC7120染色体上all3211基因表达产物为毒素蛋白,asl3212表达产物为抗毒素蛋白,为蓝细菌染色体上其他TA系统的研究奠定了基础,从这方面为除藻提供了新的思路.
1 实验部分
1.1 材料和试剂
鱼腥藻Anabaena(Nostoc)sp.PCC7120购自中国科学院水生物研究所,E.coilDH5α和E.coilBL21(DE3)为本实验室保存,pMD18-T Vector为Takara公司产品,表达载体pET30a、pBAD/HisA为本实验室保存.DNA聚合酶、蛋白Mark为Fermentas公司产品,限制性内切酶、T4 DNA连接酶等为Takara公司产品,琼脂糖凝胶回收试剂盒及质粒DNA提取试剂盒均为Axygene产品.PCR引物由南京金斯瑞生物科技有限公司合成,克隆片段的测序由南京金斯瑞生物科技有限公司完成.
1.2 实验方法
1.2.1all3211和asl3212基因的克隆
PCC7120基因组DNA提取参照徐旭东等描述的方法[7],分子生物学操作按照标准方法进行[8].以PCC7120基因组DNA为模板,以all3211-F和all3211-R为引物(表1),PCR扩增all3211基因片段;以asl3212-F 和asl3212-R为引物(表1),PCR扩增asl3212基因序列片段. PCR反应程序:94 ℃ 4 min;94 ℃ 1 min,48 ℃(0.5 ℃↓) 1 min,72 ℃ 40 s,10个循环;94 ℃ 1 min,44 ℃ 1 min,72 ℃ 40 s,25个循环;72 ℃ 7 min.引物中添加相应的酶切位点,PCR扩增产物纯化后与pMD18-T Vector载体连接,转化E.coilDH5α,蓝白斑筛选取阳性克隆酶切鉴定后送测序.
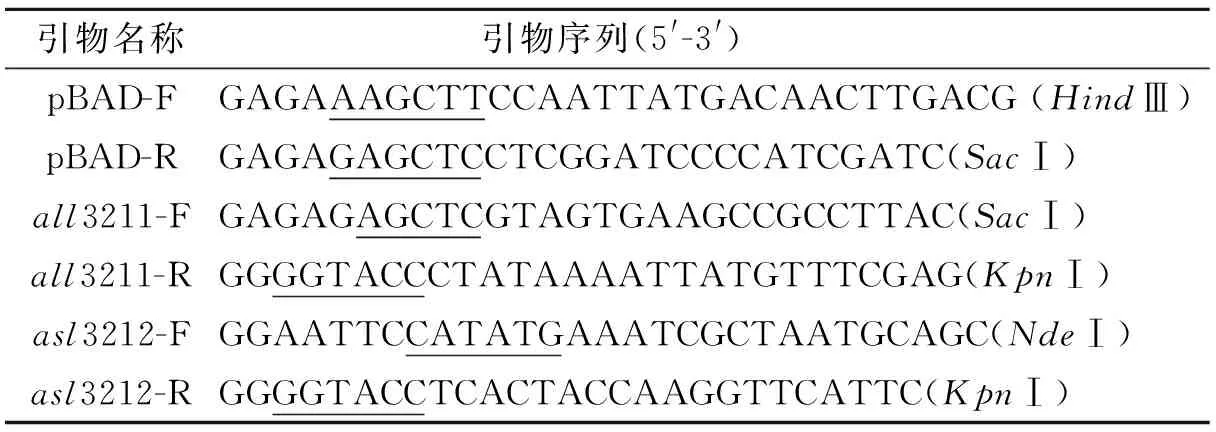
表1 PCR引物及序列
1.2.2 双启动子表达载体的构建
以质粒pBAD/HisA为模板,以pBAD-F和pBAD-R为引物(表1),PCR扩增含阿拉伯糖操纵子中araC和启动子PBAD片段(约1 300 bp),扩增产物纯化后与pMD18-T Vector载体连接,转化E.coilDH5α,蓝白斑筛选取阳性克隆酶切鉴定后送测序.测序正确的重组质粒以HindⅢ/SacⅠ双酶切后连接进pET30aHindⅢ/SacⅠ多克隆位点,构建的重组质粒经酶切鉴定,送往测序正确后命名pMJ410.
1.2.3 含毒素基因all3211和抗毒素基因asl3212的重组质粒的构建
以SacⅠ和KpnⅠ分别双酶切all3211扩增产物(441 bp)和质粒pMJ410,电泳回收片段,连接转化E.coilBL21(DE3),以含50 μg/mL硫酸卡拉霉素的LB平板筛选转化子,重组质粒经SacⅠ/KpnⅠ双酶切鉴定,测序正确后命名为pMJ411.
asl3212扩增产物以NdeⅠ/KpnⅠ双酶切,酶切产物插入到质粒pMJ411对应的NdeⅠ/KpnⅠ多克隆位点,转化E.coilBL21(DE3),以含50 μg/mL硫酸卡拉霉素的LB平板筛选转化子,转化子中的重组质粒酶切鉴定测序正确后命名为pMJ412.该重组质粒中all3211位于PBAD控制之下,受L-(+)-阿拉伯糖诱导表达,asl3212位于Plac控制下,由IPTG诱导表达.
1.2.4 基因all3211和asl3212在大肠杆菌中的诱导表达
分别将含有重组质粒pMJ411 和pMJ412的重组菌接种于含50 μg/mL硫酸卡拉霉素的M9(GAC)(0.4%甘油,0.05%酪蛋白水解物)液体培养基中,37 ℃摇床培养至OD600=0.4~0.6,将含不同重组质粒的培养菌液均调整OD600≈0.1,分别取5 μL在含0.2 % L-(+)-阿拉伯糖或0.1 mmol/L IPTG+0.2% L-(+)-阿拉伯糖的M9(GAC)固体平板划线,37 ℃培养18-20 h后观察菌体生长情况.同时在M9(GAC)液体培养基中定量分析重组菌的生长,取在M9(GAC)液体培养基中培养过夜的菌液,调整菌液浓度,使得接种物起始浓度基本相同,接种于含0.1 mmol/L IPTG或0.1 mmol/L IPTG+0.2% L-(+)-阿拉伯糖的30 mL M9(GAC)液体培养基中,于37 ℃、200 r/min摇床培养,每间隔2 h取样测定OD600,做目的基因诱导表达后转化菌体的生长曲线.
诱导表达6 h的菌液离心取沉淀,加入2×SDS Loading Buffer,沸水浴3~5 min,用5%的浓缩胶和15%的分离胶进行聚丙烯酰胺凝胶电泳(SDS-PAGE),以检测目的蛋白的表达情况.
2 结果与结论
2.1 all3211和 asl3212基因序列分析
通过已经鉴定的细菌染色体上TA系统基因序列在NCBI上Blast结果显示,PCC7120染色体上一个441 bp的基因all3211与大肠杆菌染色体上的毒素基因mazF有较高的同源性,其上游243 bp的基因为asl3212,两基因之间有1个碱基,说明两个基因共同构成一个操纵子,与TA系统具有相同的遗传结构.预测all3211基因编码产物为146个AA,其相对分子质量为16 460.14,等电点为7.79;asl3212基因编码产物为80个AA,其相对分子质量为8 887.96,等电点5.00.推测在细胞生理条件下all3211和asl3212编码产物之间可通过静电引力形成复合物.通过以上分析,推测all3211和asl3212基因构成TA系统,其中all3211为毒素基因,asl3212为抗毒素基因.
2.2 构建双启动子表达载体的酶切鉴定
构建的双启动子表达载体结构如图1所示,该重组质粒中启动子Plac可以被IPTG诱导表达, 启动子PBAD受L-(+)-阿拉伯糖诱导调控.在两个启动子之间有多个克隆位点,可以插入目的基因.将PCR扩增的含阿拉伯糖操纵子中araC和启动子PBAD片段(约1 300 bp)连接到pET30a中(图2),得到双启动子表达载体pMJ410.
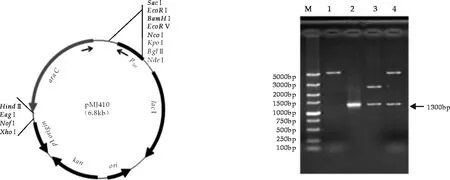
图1 pMJ410质粒结构示意图 图2 pMJ410质粒载体电泳检测图 M: DL5000标准Mark; 1:pET30a/HindⅢ/SacⅠ; 2:以pBAD/HisA为模板PCR扩增PBAD;3:pMD18-T-PBAD/Hind Ⅲ/Sac Ⅰ;4:pMJ410/Hind Ⅲ/Sac Ⅰ
2.3 重组质粒pMJ411和pMJ412的酶切鉴定
将all3211由SacⅠ/KpnⅠ双酶切后连接进pMJ410对应的酶切位点,挑取的阳性克隆双酶切结果如图3所示,出现441的目的条带,与已公布的all3211序列大小相符,测序结果与NCBI公布序列有一个碱基不同.同样含asl3212基因的重组质粒pMJ412双酶切结果(图4)出现243 bp的条带,与预期大小相同,测序结果与NCBI公布序列完全相同.
2.4 all3211和asl3212基因诱导表达蛋白的检测结果
由图5可以看出,诱导all3211基因表达时,检测结果显示在16 kD处有目的带出现,与预测大小相近。但检测到的表达量比较少,认为all3211为毒素基因,其表达产物对细胞有一定毒性作用,故诱导表达后能检测到的该蛋白的量比较小。
由图5看出asl3212基因诱导表达产物在13 kD处有很明显的表达条带,预测蛋白大小8.8 kD,由于T7启动子下游有6个组氨酸的密码子和相应的酶切位点,故产生融合蛋白的相对分子质量也相应增加约5 kD,因此表达产生的目的蛋白相对分子质量约为13.8 kD.
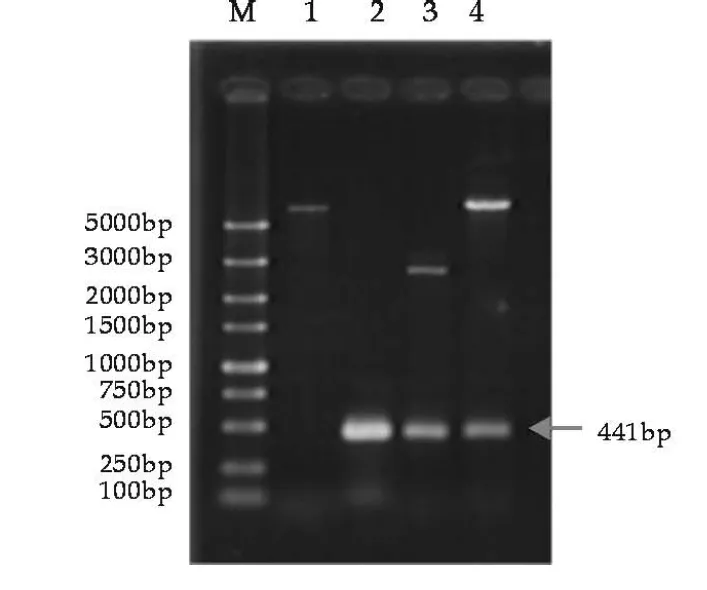
图3 重组质粒pMJ411双酶切检测图
M: DL5000标准Mark; 1:pMJ410/SacⅠ/KpnⅠ;2:以PCC7120基因组为模板PCR扩增all3211; 3:pMD 18-all3211/SacⅠ/KpnⅠ;4:pMJ411/SacⅠ/KpnⅠ
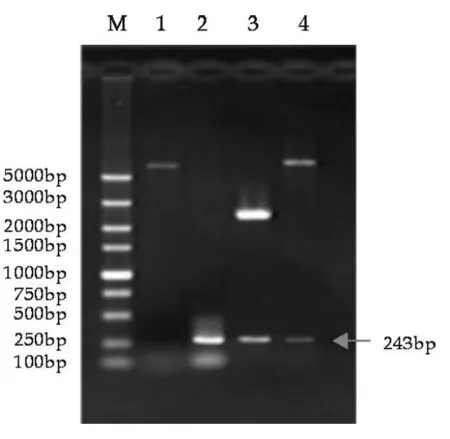
图4 重组质粒pMJ412双酶切检测图
M: DL5000标准Mark; 1:pMJ410/SacⅠ/KpnⅠ;2:以PCC7120基因组为模板PCR扩增asl3212;3:pMD 18-asl3212/SacⅠ/KpnⅠ; 4:pMJ412/SacⅠ/KpnⅠ
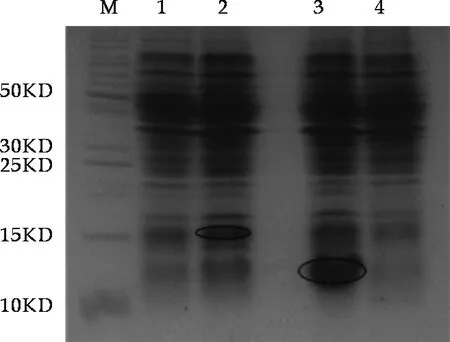
图5 蛋白表达检测图 M:蛋白质相对分子质量标准; 1:未经诱导的pMJ411转化菌; 2:阿拉伯糖诱导表达的pMJ411;3:IPTG诱导表达的pMJ412;4:未经诱导的pMJ412转化菌
2.5 毒素基因all3211诱导表达产物对大肠杆菌细胞毒性作用
用添加氮源和碳源的M9培养基培养细菌,为了排除葡萄糖存在对于Plac和PBAD诱导表达的抑制作用,以0.4%的甘油为碳源.含pMJ410、pMJ411、pMJ412重组质粒的E.coilBL21(DE3)在不含诱导剂的M9(GAC)+ 50 μg/mL硫酸卡拉霉素固体培养基中培养都能生长;在M9(GAC)+ 50 μg/mL硫酸卡拉霉素+0.2% L-(+)-阿拉伯糖的固体培养基中含质粒pMJ410的E.coilBL21(DE3)能够正常生长(图6a),而含重组质粒pMJ411 和pMJ412的E.coilBL21(DE3)生长则受到抑制(图6b).以上实验结果表明all3211基因表达产物对大肠杆菌细胞具有毒性作用,可抑制细胞生长.
在含50 μg/mL硫酸卡拉霉素+0.2% L-(+)-阿拉伯糖的M9液体培养基中,含不同重组质粒的E.coilBL21(DE3)细胞生长趋势与各自在M9固体培养基上的生长情况相似(图7).

图6 诱导表达all3211和asl3212基因对E.coil BL21生长的影响1: E.coil BL21(pMJ410); 2: E.coil BL21(pMJ411); 3: E.coil BL21(pMJ412)
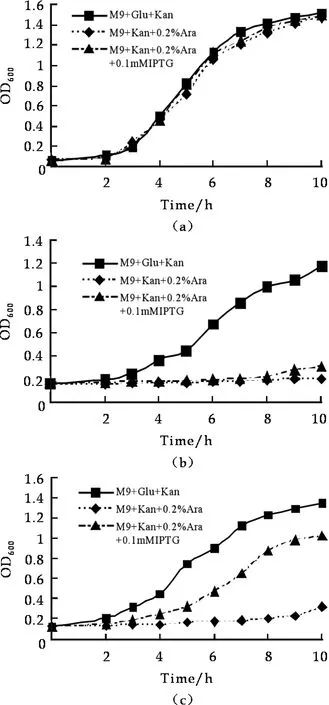
图7 含重组质粒的E.coil BL21生长曲线 a:E.coil BL21(pMJ410); b:E.coil BL21 (pMJ411); c:E.coil BL21(pMJ412)
2.6 诱导抗毒素基因asl3212表达产物对毒素基因all3211表达产物的毒性抑制作用
为了研究asl3212表达产物能否与all3211表达产物相互作用,抑制all3211表达产物对细胞的毒性作用,分别将pMJ410、pMJ411、pMJ412重组质粒的E.coilBL21(DE3)在 M9(GAC)+50 μg/mL硫酸卡拉霉素+0.2% L-(+)-阿拉伯糖+0.1 mmol/L IPTG的固体培养基中培养,除含pMJ411质粒的E.coilBL21(DE3)不能正常生长外,其他两个均能正常生长(图6c).在50 μg/mL硫酸卡拉霉素+0.2% L-(+)-阿拉伯糖+0.1mmol/L IPTG的M9液体培养基中,生长情况分析也显示相同结果(图7).
上述实验结果表明同时诱导all3211和asl3212基因表达时,E.coilBL21(DE3)基本上正常生长,说明asl3212表达产物能抑制all3211表达产物对细胞的毒性作用,asl3212为抗毒素基因,all3211和asl3212共同构成PCC7120染色体上的一对毒素-抗毒素系统.
3 结 论
不同种属的细菌内TA系统的基因序列可能同源性较低或相差很大,但其遗传结构和功能却非常相似[5].本实验首先通过序列分析发现PCC7120染色体基因all3211与大肠杆菌染色体上毒素基因mazF有较高的同源性,并且与其上游基因asl3212存在碱基重叠,与TA系统具有相同的遗传结构.通过实验初步证明all3211和asl3212共同构成了PCC7120染色体上的一对毒素-抗毒素系统,其中all3211为毒素基因,asl3212为抗毒素基因.
近年来研究证明TA系统作为原核细胞应对营养缺乏时的调控机制,是对细菌代谢调控的重要补充,对于设计新的药物来解决细菌耐药性问题具有现实意义[9].但目前对于细菌染色体上的TA系统研究认识还比较有限,有关蓝细菌中TA系统的研究还不多,因此尽管初步证明all3211编码产物与MazF同源,但其生理功能及作用机制还有待进一步研究.
参考文献
[1] Gerdes K,Christensen SK,Lobner-Olesen A.Prokaryotic toxin-antitoxin stress response loci[J]. Nature Reviews Microbiology,2005,3(5):371-382.
[2] Lieven Buts,Jurij Lah,Minh-Hoa,etal.Toxin-antitoxin modules as bacterial metabolic stress managers[J].Trends in Biochemical Sciences,2005,30(12):672-679.
[3] Aizenman E,Engelberg-Kulka H,Glaser G.AnEscherichiacolichromosomal “addiction module” regulated by guanosine-3′5′-bispyrophosphate:a model for programmed bacterial cell death[J].Proc Natl Acad Sci USA,1996,93:6 059-6 063.
[4] Marianovsky I,Aizenman E,Engelberg-Kulka H,etal.The regulation of theEscherichiacolimazEFpromoter involves an unusual alternating palindrome[J].The Journal Biological Chemistry,2001,276(8):5 975-5 984.
[5] Zhang JJ,Zhang YL,Inouye M.Characterization of the interactions within the mazEF addiction module ofEscherichiacoil[J]. Biol Chem,2003,278(34):32 300-32 306.
[6] Pandey DP,Gerdes K.Toxin-antitoxin loci are highly abundant in free-living but lost from host-associated prokaryotes[J]. Nucleic Acids Research,2005,33(3):966-976.
[7] 徐旭东,王业勤,黎尚豪.鱼腥藻-大肠杆菌CAT启动子探测质粒的构建[J].中国科学院研究生院报,1993,10:203-209.
[8] J.萨姆布鲁克,D.W.拉塞尔.分子克隆实验指南[M].第三版. 北京:科学出版社,2007.
[9] 季建军,邱景富.细菌的细胞程序性死亡中毒素-抗毒素系统的研究进展[J].军事医学科学院院刊,2006,30(2):184-187.
