鲎血中超氧化物歧化酶对D-半乳糖致衰老小鼠抗氧化作用的研究
2012-02-10卢海庆刘成军韦世秀张学荣李牡艳
卢海庆,李 俊,刘成军,韦世秀,张学荣,李牡艳
(1.广西医科大学药学院,2.广西壮族自治区江滨医院,3.广西医科大学医学科学实验中心,广西南宁 530021)
鲎(horsefoot)是一种的海洋动物,鲎血细胞目前主要用于制备鲎试剂。研究显示[1],制备鲎试剂后的鲎血浆中含有较多的SOD。SOD是公认的最重要的抗氧化剂,生物体内重要的抗氧化酶。它能催化超氧阴离子自由基发生歧化反应,平衡机体内的氧自由基,在防御氧的毒性,抗辐射损伤及预防衰老等方面起着重要作用,是生物体内清除自由基的首要物质。抗氧化是直接作用在自由基,或是间接消耗掉容易生成自由基的物质,防止发生进一步反应。目前,国内外大量报道了从动物肝脏、鸡红等[2-3]原料中提取的 SOD在炎症、自身免疫性疾病、辐射、衰老以及缺血后再灌注损伤等多种疾病中的治疗作用[4],但对从鲎血中提取的SOD的作用研究尚未有报道。本研究通过建立D-半乳糖致衰老小鼠模型[5],检测模型小鼠血清、肝脏和脑SOD、谷胱甘肽过氧化物酶(GSH-Px)活力及丙二醛(MDA)含量,探讨鲎血中SOD的抗氧化作用。
1 材料与方法
1.1 材料
1.1.1 药物与试剂 鲎血SOD冻干粉,本实验室自提取。D-半乳糖,批号:20100926,美国Amresco公司。测总SOD试剂盒,批号:20101127;MDA含量测定试剂盒,批号:20101124;GSH-Px活力测试试剂盒,批号:20101125;考马斯亮蓝法蛋白质定量试剂盒,批号:20101125;双缩脲法蛋白质定量试剂盒,批号:20101124,均为南京建成生物工程研究所生产。维生素E粉末,批号:20100820,浙江新和成有限公司生产,纯度:99.1%。
1.1.2 动物 SPF级昆明小鼠,96只,♂♀各半,体质量(20±2)g,购自广西医科大学实验动物中心,实验动物生产许可证:SCXK(桂)2009-0002。
1.1.3 主要仪器 双束光紫外分光光度计为美国VARIAN公司产品;高速低温离心机为德国Eppendorf Centrifuge公司产品;高速分散均质机为上海标本模型厂产品;三用恒温水箱为北京长源实验设备厂产品;混匀器为上海沪西分析仪器厂产品。
1.2 方法
1.2.1 动物分组及给药 将小鼠随机分为空白对照组、衰老模型组、维生素E组,鲎血SOD高、中、低剂量组,每组16只。空白对照组颈背部注射生理盐水,其余各组按120 mg·(kg·d)-1[6]颈背部注射D-半乳糖造模,同时维生素E组和鲎血SOD高、中、低剂量组分别灌胃给药100 mg·(kg·d)-1[7]、231.84 mg·(kg·d)-1、115.92 mg·(kg·d)-1、57.96 mg·(kg·d)-1,连续造模给药42 d[8]。
1.2.2 小鼠体征行为学观察 观察和记录小鼠体征和活动情况,如背毛光泽度、对刺激反应的灵敏度、采食状况、嗜睡程度等,以及死亡情况。每周记录体重一次。
1.2.3 小鼠血清、肝脏、脑中的SOD、GSH-Px活力及MDA含量的测定 采用黄嘌呤氧化酶法和DTNB比色法分别测定肝脏、血清、脑中的 SOD和GSH-Px活力;运用硫代巴比妥酸比色法测定MDA含量。
2 结果
2.1 鲎血SOD对小鼠体征行为的影响 给药前各组小鼠情况良好。给药2周后与空白对照组相比,模型组小鼠进食减少,活动缓慢,扎堆嗜睡,毛发粘湿缺乏光泽,且背部毛发有脱落现象。鲎血SOD各剂量组小鼠一般状况介于模型组和空白组之间,但稍差于维生素E组;除空白组外,各组小鼠体重增加量普遍下降,在整个实验过程中,衰老模型组小鼠体重增加量明显小于空白组小鼠体重增加量;鲎血SOD各剂量组小鼠体重增加量与衰老模型组小鼠体重增加量相比没有明显差异;维生素E组小鼠体重增加量和空白组小鼠体重增加量相当。
2.2 鲎血SOD对小鼠血清中SOD、GSH-Px活力及MDA含量的影响 与空白组相比,衰老模型组的SOD、GSH-Px活力明显下降(P<0.05),MDA含量明显升高(P<0.01);与衰老模型组比较,维生素E组和鲎血 SOD高、中、低剂量组均能明显提高SOD、GSH-Px活力(P<0.01,P<0.05),降低MDA含量(P<0.05)。结果见Tab 1。
Tab 1 Effects of horsefootblood SOD on SOD,GSH-Px activities and the MDA content in mice serum(±s)

Tab 1 Effects of horsefootblood SOD on SOD,GSH-Px activities and the MDA content in mice serum(±s)
★P<0.05,★★P<0.01 vs control group;▲P<0.05,▲▲P<0.01 vs model group
Group n SOD/U·ml-1 GSH-Px/U·ml-1 MDA/μmol·L -1 Control 16 148.26±25.91 273.27±56.30 11.43±1.09 Model 13 127.88±20.14★ 227.89±51.38★ 13.82±2.01★★VitE 14 160.06±13.45▲▲ 311.56±21.24▲▲ 11.73±1.79▲SOD-H 11 164.73±20.16▲▲ 280.26±33.97▲ 12.19±0.91▲SOD-M 10 156.96±24.94▲▲ 327.58±27.22▲▲ 12.44±1.07▲SOD-L 12 158.55±18.35▲▲ 293.39±29.33▲▲ 12.35±1.58▲
2.3 鲎血SOD对小鼠肝脏中SOD、GSH-Px活力及MDA含量的影响 与正常对照组比较,模型组小鼠肝脏中SOD、GSH-Px活力降低(P<0.05),MDA含量升高(P<0.05);与衰老模型组比较,维生素E组,鲎血SOD高、中剂量组能明显提高小鼠肝脏中SOD活力(P<0.01),但对GSH-Px活力基本没有影响,维生素E组能明显降低MDA含量(P<0.01),鲎血SOD给药组均未能明显降低MDA含量。结果见Tab 2。
Tab 2 Effects of horsefootblood SOD on SOD,GSH-Px activities and the MDA content in mice liver(±s)
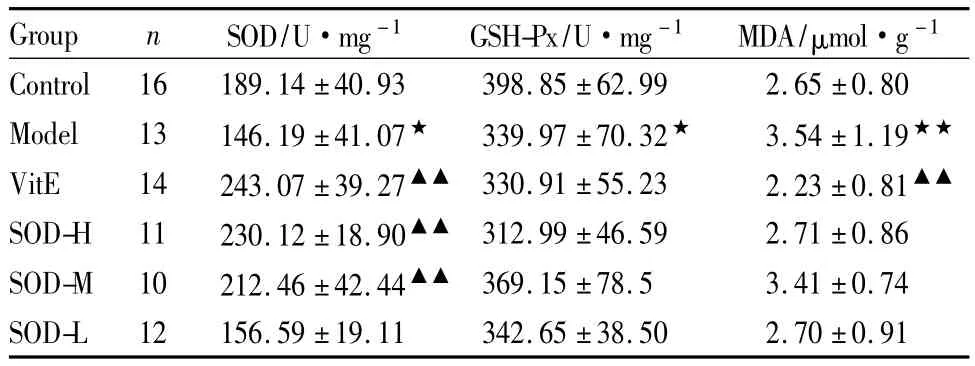
Tab 2 Effects of horsefootblood SOD on SOD,GSH-Px activities and the MDA content in mice liver(±s)
★P<0.05,★★P<0.01 vs control group;▲P<0.05,▲▲P<0.01 vs model group
Group n SOD/U·mg-1 GSH-Px/U·mg-1 MDA/μmol·g -1 Control 16 189.14±40.93 398.85±62.99 2.65±0.80 Model 13 146.19±41.07★ 339.97±70.32★ 3.54±1.19★★VitE 14 243.07±39.27▲▲ 330.91±55.23 2.23±0.81▲▲SOD-H 11 230.12±18.90▲▲ 312.99±46.59 2.71±0.86 SOD-M 10 212.46±42.44▲▲ 369.15±78.5 3.41±0.74 SOD-L 12 156.59±19.11 342.65±38.50 2.70±0.91
2.4 鲎血SOD对小鼠大脑中SOD、GSH-Px活力及MDA含量的影响 与空白对照组比较,模型组小鼠大脑中SOD、GSH-Px活力降低(P<0.01),MDA含量升高(P<0.05);与衰老模型组比较,维生素E组和鲎血SOD高、中、低剂量组均可明显提高大脑中GSH-Px活力(P<0.01),明显降低MDA含量(P<0.01),但对SOD活力的影响没有统计学意义。结果见Tab 3。
Tab 3 Effects of horsefootblood SOD on SOD,GSH-Px activities and the MDA content in mice brain(±s)

Tab 3 Effects of horsefootblood SOD on SOD,GSH-Px activities and the MDA content in mice brain(±s)
★P<0.05,★★P<0.01 vs control group;▲P<0.05,▲▲P<0.01 vs model group
Group n SOD/U·mg-1 GSH-Px/U·mg-1 MDA/μmol·g -1 Control 16 147.26±27.07 30.70±13.88 5.16±1.53 Model 13 85.04±14.07★★ 10.78±2.82★★ 6.91±1.62★VitE 14 87.08±18.07 39.36±11.24▲▲ 4.67±0.89▲▲SOD-H 11 76.16±11.77 28.69±9.00▲▲ 4.71±0.58▲▲SOD-M 10 80.27±16.85 29.92±7.72▲▲ 5.05±0.80▲▲SOD-L 12 75.63±11.23 21.51±6.47▲▲6.62±1.47
3 讨论
SOD是生物活性大分子酶,虽然实验表明其免疫原性很低,但研究表明[9]多次注射仍有抗体的产生,所以口服不仅是一条方便而简单的途径,而且可以避免免疫反应的产生。袁勤生等[10]研究了SOD在口服吸收过程中对胃、肠道内胃酸及蛋白水解酶失活的耐受力,及小鼠SOD口服后血细胞中SOD的活力变化情况,结果肯定了SOD在胃肠道是稳定的,能直接被吸收利用,可作为药物进入血液治疗疾病。目前,国外把SOD作为食品添加剂加在牛奶、可溶性咖啡、啤酒中,我国贵州农学院已开发出刺梨SOD饮料[11]。因此,本实验采用灌胃的方式给小鼠用药是可行的。如果能对鲎血中SOD进行结构修饰或者加入稳定剂,可能会增强其耐热,耐极端pH和抗蛋白酶水解能力。
自由基是机体氧化反应中产生的有害化合物,具有强氧化性,可损害机体的组织和细胞,进而引起慢性疾病及衰老效应。机体同时存在自由基清除系统(包括SOD、GSH-Px、过氧化氢酶等抗氧化酶),自由基的产生和清除是一种动态平衡状态。SOD是体内最重要的酶类抗氧化剂,它可直接清除O2-,其活性间接反映机体清除氧自由基的能力;GSH-Px是机体内广泛存在的一种含硒抗氧化酶,它可以催化H2O2还原成H2O,因此GSH-Px活性的高低可以作为评价组织细胞衰老的又一个重要指标[12];而MDA是自由基损伤不饱和脂肪酸生成的脂类过氧化分解产物,是衡量机体内自由基代谢的敏感指标[13]。本研究通过建立D-半乳糖衰老小鼠模型,检测小鼠血清、肝脏、脑中的SOD、GSH-Px活力及MDA含量的变化来研究鲎血中SOD的抗氧化作用。实验结果显示,衰老模型组小鼠血清、肝脏和脑中SOD、GSH-Px活力明显下降,MDA的含量明显升高,说明造模成功。鲎血中SOD对衰老小鼠血清、肝脏和脑中SOD、GSH-Px活力,MDA含量的影响具有明显的器官差异性。这可能是鲎血SOD对不同器官组织的抗氧化作用有差异,也可能与各组织的细胞代谢状态有关。实验结果高、中、低剂量的数据不是呈递增或递减趋势,可能是由于药物没有呈现出量效相关性,也可能存在一些不可避免的实验误差。有的指标可能是中剂量效果好,有的指标则可能是低剂量效果好,并不是所有的指标药物使用的剂量越高其效果就会越好。
[1] 李 俊,韦世秀.鲎血中超氧化物歧化酶的提取及部分性质的研究[J].时珍国医国药,2011,22(4):842-4.
[1] Li J,Wei S X.Purification and some properties of superoxide dismutase from horsefoot blood[J].Lishizhen Med Mater Med Res,2011,22(4):842-4.
[2] 吴燕燕,李来好,郝志明.罗非鱼肝脏中超氧化物歧化酶的提取、纯化与分析[J].水产学报,2007,31(4):518-24.
[2] Wu Y Y,Li L H,Hao Z M.Extraction,purification and analysis of superoxide dismutase from liver of hybrid tilapia[J].J Fisheries China,2007,31(4):518-24.
[3] 张兰杰,侯冬岩,辛 广.鸡红细胞Cu,Zn-SOD的纯化及部分性质研究[J].食品科学,2008,29(2):266-70.
[3] Zhang L J,Hou D Y,Xin G.Study on purification and properties of Superoxide Dismutase from erythrocytes of chicken[J].Food Sci,2008,29(2):266-70.
[4] Takemura T.A clinical trial of recombinant human superoxide dismutase for myocardial protection[J].Nippon Kyobu Geka Gakkai Zasshi,1993,41(2):247-53.
[5] 陈 莹,才 媛,王 琦.裂褶菌胞外多糖对D-半乳糖致衰老小鼠学习记忆及代谢产物的影响[J].中国药理学通报,2012,28(2):274-7.
[5] Chen Y,Cai Y,Wang Q.Schizophyllum commune extracellular polysaccharide on D galactose induced aging mice with learning and memory[J].Chin Pharmacol Bull,2012,28(2):274-7.
[6] 赵利华,文建军,杨 柯.艾灸对D-半乳糖致小鼠衰老模型抗衰老作用的研究[J].针刺研究,2008,33(4):255-61.
[6] Zhao L H,Wen J J,Yang K.Effects of moxibustion on cerebral cortical nitric oxide level and nitric oxide synthase activity in aging mice[J].Acupunct Res,2008,33(4):255-61.
[7] 康 桦,匡 荣.α-硫辛酸抗D-半乳糖所致小鼠衰老作用研究[J].医药导报,2008,27(8):896-8.
[7] Kang H,Kuang R.Antiaging effect of α-lipoic acid on D-galactose induced aging mice[J].Herald Med,2008,27(8):896-8.
[8] 吴 波,付玉梅.肉苁蓉总苷对亚急性衰老小鼠抗脂质过氧化作用的研究[J].中国药理学通报,2005,21(5):639.
[8] Wu B,Fu Y M.Study on anti-lipid peroxide effect of the glycoside Of cistanche in the subacute agingmice[J].Chin Pharmacol Bull,2005,21(5):639.
[9] Adachi T,Usami Y,Kishi T,et al.An enzyme immunoassay for cuprozinc superoxide dismutase using monoclonal antibodies.Application for pharmacokinetic study[J].J Immun Meth,1988,109: 93.
[10]袁勤生,崔玉敏,张炳然.口服SOD的稳定性及吸收途径研究[J].药物生物技术,1994,1(1):24.
[10]Yuan Q S,Cui Y M,Zhang B R.Studies on the stability and absorption of superoxide dismutase peros in rats[J].Pharm Biotechnol,1944,1(1):24.
[11]黎瑞珍,杨庆建,陈贻锐.超氧化物歧化酶(SOD)活性的测定及其应用研究[J].琼州大学学报,2004,11(5):34-6.
[11]Li R Z,Yang Q J,Chen Y R.Study of determination of superoxide dismutase(SOD)activation and application[J].J Qiongzhou Univ,2004,11(5):34-6.
[12]Reiter R.Biomarkers of free radical damage:applications in experimental animals and in human[J].Jpineal Pea,1995,18:1-11.
[13]Inal M E,Kanbak G,Sunal E.Antioxidant enzyme activities and malondial dehy delevels related to aging[J].Clin Chim Acta,2001:305(12):75-8.
