缝隙连接蛋白43与神经胶质瘤
2012-02-10蒋丽萍
唐 容,蒋丽萍,洪 涛
(南昌大学医学院,江西南昌 330006)
神经胶质瘤是中枢神经系统最常见的原发性肿瘤,约占颅内各类型肿瘤发生率的40%~60%。虽然相对于其他肿瘤类型来说,中枢神经系统的肿瘤类型相对较少,占所有恶性肿瘤的比例低于2%,但一旦确诊,脑胶质瘤是致命性的,患者平均存活期大约1年。目前治疗脑胶质瘤的手段包括手术、放疗及化疗。由于肿块的不均一性、肿块与正常组织结合在一起无界限及胶质瘤细胞高侵袭性,使其预后不良。神经胶质瘤包括星形胶质细胞肿瘤、少突胶质细胞肿瘤、混合性胶质细胞肿瘤及室管膜肿瘤,其中星形胶质细胞肿瘤最为常见。细胞间隙直接通讯(GJIC)与肿瘤有关方面的研究已经有很长的历史[1]。研究表明,许多人类肿瘤(包括脑胶质瘤)缝隙连接通讯及Cxs表达缺失。脑胶质瘤恶性程度越高,GJ形成及Cx43表达越少。Cx43是中枢神经系统最丰富的缝隙连接蛋白,主要在星形胶质细胞表达;而在星形胶质细胞瘤中,Cx43表达减少或缺失。本文就Cx43对神经胶质瘤细胞增殖、迁移的影响及机制进行简单概述。
1 GJ与Cx43
GJ是相邻细胞质间唯一的分子通道。每个缝隙连接通道由两个连接子两两对接而成,每个连接子由6个缝隙连接蛋白亚单位组成,允许小分子(<1ku)如金属离子、第二信使及其它小分子代谢产物在细胞间传递,使细胞间可以不通过细胞外空间达到直接通讯的目的。除分化了的骨骼肌、红细胞及成熟的精子细胞外,Cxs几乎在哺乳动物所有组织和细胞中均有表达[2]。Cxs基因家族,鼠类有20种,人类有21种。Cxs是一个4次跨膜蛋白,由9个主要区域组成,即两个胞外环(extracellular1,EL1和 extracellular 2,EL2;参与对接)、N末端、胞质环和C末端(位于胞质一侧)及4个跨膜区域。Cxs根据分子质量(25~62ku)的不同进行区分,如Cx43、Cx26、Cx56,Cx43结构示意图见Fig 1。Cxs同源性很高,胞外环、4个跨膜区域及N末端相对保守,C末端及胞质环差别较大,是区别不同缝隙连接蛋白的主要区域。Cxs半衰期短,只有几个小时。通过Cxs不断的合成与降解来适应环境的改变[2]。Cxs除了形成GJ通道,还可形成半通道,半通道是一种重要的细胞旁分泌信号途径,通过释放细胞内因子如ATP、NAD(+)及谷氨酸,影响细胞内钙和细胞生存[3]。
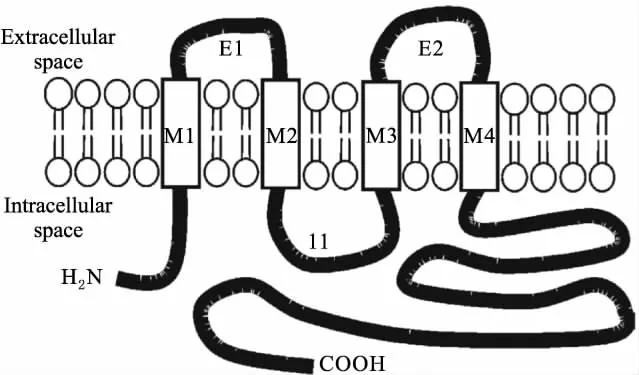
Fig 1 Structure of Connexin43
通常情况下,肿瘤增长越快、恶性程度越高,Cx43表达越少[4]。但是,Caltabiano等[5]对32个人脑胶质瘤标本进行研究表明,在恶性程度高的胶质瘤中,Cx43 mRNA水平高,而Cx43蛋白水平低,这可能跟转录后机制的改变有关,如磷酸化、胞质定位等。尽管有57%原发肿瘤显示Cx43水平降低,但也有数据显示相反的结果,即Cx43水平增加。Cx43表达高度不均匀性,可能取决于局部肿瘤微环境的影响。
2 Cx43与神经胶质瘤细胞生长抑制
迄今,所有的研究都表明,Cx43对脑胶质瘤细胞生长起着抑制作用。Cx43影响细胞周期,比如使细胞从G1期过渡到S期、G2期过渡到 M期均延长[6]。进一步研究发现,Cx43通过降低细胞周期蛋白A、D1、D2、E、CDK5、CDK6、CKP2表达,或者增加 p21和 p27表达,从而延长细胞周期[6-8]。此外,Cx43还可能影响其他生长抑制因子的表达。比如,转染了Cx43的C6鼠脑胶质瘤细胞改变分泌性蛋白表达,即增加骨桥蛋白、CCN3、IGFBP4或者减少MPG-E8、IGF-1、IGFBP3表达[9]。但过表达Cx32对C6细胞生长没有影响[10],表明不同的缝隙连接蛋白对细胞生长抑制具有特异性。而这种特异性归咎于两方面:缝隙连接蛋白形成通道的通透性和它们独特的胞内区。这两部分是相互联系的,因为细胞内区域(特别是C末端)磷酸化使构象改变,从而影响通道的通透性[11]。
2.1 Cx43调节细胞生长:依赖GJIC机制 相对于Cx32,Cx43形成的缝隙连接通道对某些代谢产物如ATP、谷氨酸表现出更高的通透性[12]。研究表明,GJIC与细胞生长存在一定的关系。例如,转染了TGF-β1的C6细胞,GJIC功能下降,Cx43磷酸化水平下降,DNA合成增加[13]。表明TGF-β1改变Cx43磷酸化水平,降低GJIC,从而促进C6细胞的增殖。提示C6细胞DNA合成受GJIC的影响。相应地,甲苯磺丁脲增加GJIC从而抑制C6的生长[8]。
Cx43磷酸化,尤其是C末端的磷酸化,会影响GJIC。因为许多激酶与Cx43相互影响,所以探讨Cx43磷酸化对细胞生长调节的可能作用非常必要。Cx43磷酸化影响自身结构,导致其通道功能改变。Cx43内在化、降解都与磷酸化状态有关。比如,FGF-2刺激心肌细胞,使Cx43在S262氨基酸发生磷酸化,GJIC降低,DNA合成增加[14]。虽然这个实验是在心肌细胞,但是FGF-2高表达于神经胶质瘤,是恶性胶质瘤细胞的一个有丝分裂因子[15],同样使胶质瘤细胞Cx43在S262氨基酸发生磷酸化,从而调节细胞的生长。
2.2 Cx43调节细胞生长:不依赖于GJIC机制 前面已提到过,肿瘤细胞增加Cxs基因表达,提高GJIC,抑制细胞生长;这种效应具有连接蛋白类型特异性,但不总是与GJIC水平有关。有些实验表明,Cx43抑制细胞生长,是不依赖于GJIC发挥作用。因为经常观察到Cx43在胶质瘤细胞质内,那么细胞质内的Cx43是否会以别的方式影响细胞生长呢?
Cx43 C末端占整个分子全长的2/3,且C末端有许多潜在位点可以与其他蛋白相互作用。如Cx43 C末端(从244~382位氨基酸)与CNN3相互作用,抑制CNN3进入细胞核,抑制细胞生长[16]。最近研究表明,Cx43可作为c-Src一种底物,减少Src参与细胞生长激活,抑制细胞生长[7]。在许多类型细胞中,可以观察到Cx43位于细胞核,包括转染了Cx43cDNA的细胞[17]。由于很难想象完整的膜蛋白如Cx43进入细胞核,所以推测Cx43的C末端可能有核靶向功能。更有趣的是,没有形成通道的Cx43 C末端(位于细胞核内)仍然有生长抑制活性[18]。上述研究表明,Cx43可能从两方面影响基因表达:直接作为一个转录因子;间接与转录因子或者复合物相互影响。
3 Cx43与神经胶质瘤细胞迁移
神经胶质瘤最重要的标志是其侵袭性行为,这是治疗胶质瘤面临的最大问题。经过几十年的努力,脑胶质瘤病人的存活率并没有得到明显的提高。肿瘤细胞侵入正常组织是一个复杂的过程,包括细胞与细胞外基质、邻近细胞及活跃细胞运动相关的病理生理过程及其相互影响。上面讨论了Cx43抑制神经胶质瘤细胞增殖及机制,那么Cx43对神经胶质瘤细胞迁移的影响如何呢?过去几十年,有关Cxs与细胞迁移的资料越来越多。体外研究提示,敲除Cx43,降低细胞运动性;过表达Cx43,提高细胞运动性,Cx43与神经胶质瘤细胞迁移呈正相关[19]。
3.1 Cx43与细胞迁移:依赖GJIC机制 Cx43作为一种缝隙连接蛋白,通过形成GJIC调节细胞迁移。但是Cx43是依赖于胶质瘤细胞之间形成的同型细胞GJIC,还是胶质瘤细胞与星形胶质细胞(脑间质主要细胞类型)之间形成的异型细胞GJIC。用甘珀酸抑制GL15人恶性胶质瘤细胞间的同型细胞GJIC,GL15细胞运动性增强,而相应地抑制异型细胞GJIC,GL15细胞运动性减弱[20]。当然,在体内外,胶质瘤细胞与星形胶质细胞间存在直接的GJIC[21]。另外,异型细胞GJIC能够影响细胞形态和星形胶质细胞基因表达[21]。研究表明,胶质瘤细胞与上皮细胞间形成的GJIC可能对胶质瘤侵袭起着重要作用[22]。综上所述,同型细胞GJIC低而异型细胞GJIC高有利于胶质瘤细胞迁移。研究发现,恶性胶质瘤中心低表达Cx43,而边缘及星形胶质细胞高表达Cx43[23],可能促进胶质瘤细胞侵袭。
3.2 Cx43与细胞迁移:不依赖GJIC机制 越来越多的资料显示,Cxs影响胶质瘤细胞迁移可能不依赖GJIC。如Cx43的胞外环增加细胞黏附,可能有助于细胞迁移[24]。进一步研究发现,完整的Cx43能够增加C6细胞运动性,而截掉C末端的Cx43对C6细胞运动性没有影响,表明Cx43的C末端对胶质瘤细胞迁移起着重要作用[25]。研究表明[19],对于LN18人脑胶质瘤细胞,Cx43 C末端足够调节细胞迁移。提示Cx43 C末端对细胞迁移是必须的,可能是因为C末端含有许多蛋白相互作用结合位点。此外,Cx43 C末端还可以与细胞骨架蛋白如F-actin、β-tubulin、N-cadherin,激动蛋白,结合蛋白如可的松、drebrin相互作用[19]。但Cx43对神经胶质瘤迁移的作用还需要进一步的研究。
4 展望与前景
Cx43表达与肿瘤的发生发展过程有着密切的联系。最初的研究发现,胶质瘤恶性程度越高,Cx43表达越少或缺失。将Cx43cDNA转入恶性胶质瘤细胞后,发现细胞增殖明显受到抑制,并在许多类型的肿瘤中均发现,Cx43能够抑制细胞增殖,并把它视为一种抑癌基因。但之后的研究发现,Cx43在胶质瘤(尤其是恶性胶质瘤)中不均匀表达,一些肿瘤细胞趋向于迁移(表达Cx43的细胞),另外一些趋向于增殖(不表达Cx43的细胞),这为Cx43治疗脑胶质瘤带来了困难。MMPs的表达及活化促进胶质瘤侵袭和迁移,研究发现,C6细胞过表达Cx43后,细胞侵袭能力增强,细胞培养液中MMP-2及MMP-9呈数量级的增加[24],说明Cx43促进胶质瘤细胞侵袭可能与细胞培养液中MMP-2、MMP-9增加有关。Cx43治疗脑胶质瘤的潜在性不可否认,如基因治疗和MMPs抑制剂联合应用,但亟待研究一种完美的动物模型,模拟脑内复杂的微环境,进一步明确Cx43调节细胞增殖与迁移的分子机制,为Cx43治疗脑胶质瘤提供新的思路和策略。
[1] 孙 华,刘耕陶.细胞间隙连接通讯与肿瘤[J].中国药理学通报,2004,20(11):1205-8.
[1] Sun H,Liu G T.Gap junctional intercellular communication and tumor[J].Chin Pharmacol Bull,2004,20(11):1205-8.
[2] Rakauskas M,Neverauskas V,Skeberdis V A.Diversity and properties of connexin gap junction channels[J].Medicina,2010,46 (1):321-4.
[3] Rodriguez-Sinovas A,Cabestrero A,Lopez D,et al.The modulatory effects of connexin 43 on cell death/survival beyond cell coupling[J].Prog Biophys Mol Biol,2007,94(1-2):219-32.
[4] 程 蕾.细胞间隙连接通讯与肿瘤[J].现代生物医学杂志,2007,7(4):626-8.
[4] Cheng L.Gap junctional intercellular communication and tumor[J].Progr Mod Biomed,2007,7(4):626-8.
[5] Caltabiano R,Torrisi A,Condorelli D,et al.High levels of connexin 43 mRNA in high grade astrocytomas.Study of 32 cases with in situ hybridization[J].Acta Histochem,2010,112(6):529-35.
[6] Zhang Y W,Nakayama K,Morita I.A novel route for connexin 43 to inhibit cell proliferation:negative regulation of S-phase kinaseassociated protein(Skp 2)[J].Cancer Res,2003,63(7):1623-30.
[7] Herrero-Gonzalez S,Gangoso E,Giaume C,et al.Connexin43 inhibits the oncogenic activity of c-Src in C6 glioma cells[J].Oncogene,2010,29(42):5712-23.
[8] Sanchez-Alvarez R,Paino T,Herrero-Gonzalez S,et al.Tolbutamide reduces glioma cell proliferation by increasing connexin43,which promotes the up-regulation of p21 and p27 and subsequent changes in retinoblastoma phosphorylation[J].Glia,2006,54 (2):125-34.
[9] Bradshaw S L,Naus C C,Zhu D,et al.Insulin-like growth factor binding protein-4 gene expression is induced by transfection of gap junction connexin43 gene in a C6 glioma cell line[J].Growth Regul,1993,3(1):26-9.
[10]Bond S L,Bechberger J F,Khoo N K,et al.Transfection of C6 glioma cells with connexin32:the effects of expression of a nonendogenous gap junction protein[J].Cell Growth Differ,1994,5 (2):179-86.
[11]Laird D W.Connexin phosphorylation as a regulatory event linked to gap junction internalization and degradation[J].Biochim Biophys Acta,2005,1711(2):172-82.
[12]Goldberg G S,Moreno A P,Lampe P D.Gap junctions between cells expressing connexin 43 or 32 show inverse permselectivity to adenosine and ATP[J].J Biol Chem,2002,277(39):36725-30.
[13]Robe P A,Rogister B,Merville M P,et al.Growth regulation of astrocytes and C6 cells by TGFbeta1:correlation with gap junctions[J].Neuroreport,2000,11(13):2837-41.
[14]Doble B W,Ping P,Kardami E.The epsilon subtype of protein kinase C is required for cardiomyocyte connexin-43 phosphorylation[J].Circ Res,2000,86(3):293-301.
[15]Joy A,Moffett J,Neary K,et al.Nuclear accumulation of FGF-2 is associated with proliferation of human astrocytes and glioma cells[J].Oncogene,1997,14(2):171-83.
[16]Sin W C,Bechberger J F,Rushlow W J,et al.Dose-dependent differential upregulation of CCN1/Cyr61 and CCN3/NOV by the gap junction protein Connexin43 in glioma cells[J].J Cell Biochem,2008,103(6):1772-82.
[17]Mennecier G,Derangeon M,Coronas V,et al.Aberrant expression and localization of connexin43 and connexin30 in a rat glioma cell line[J].Mol Carcinog,2008,47(5):391-401.
[18]Dang X,Doble B W,Kardami E.The carboxy-tail of connexin-43 localizes to the nucleus and inhibits cell growth[J].Mol Cell Biochem,2003,242(1-2):35-8.
[19]Crespin S,Bechberger J,Mesnil M,et al.The carboxy-terminal tail of connexin43 gap junction protein is sufficient to mediate cytoskeleton changes in human glioma cells[J].J Cell Biochem,2010,110(3):589-97.
[20]Oliveira R,Christov C,Guillamo J S,et al.Contribution of gap junctional communication between tumor cells and astroglia to the invasion of the brain parenchyma by human glioblastomas[J].BMC Cell Biol,2005,6(1):117-22.
[21]Gagliano N,Costa F,Cossetti C,et al.Glioma-astrocyte interaction modifies the astrocyte phenotype in a co-culture experimental model[J].Oncol Rep,2009,22(6):1349-56.
[22]Zhang W,DeMattia J A,Song H,et al.Communication between malignant glioma cells and vascular endothelial cells through gap junctions[J].J Neurosurg,2003,98(4):846-53.
[23]Baklaushev V P,Yusubalieva G M,Tsitrin E B,et al.Visualization of connexin 43-positive cells of glioma and the periglioma zone by means of intravenously injected monoclonal antibodies[J].Drug Deliv,2011,18(5):331-7.
[24]Zhang W,Nwagwu C,Le D M,et al.Increased invasive capacity of connexin43-overexpressing malignant glioma cells[J].J Neurosurg,2003,99(6):1039-46.
[25]Bates D C,Sin W C,Aftab Q,et al.Connexin43 enhances glioma invasion by a mechanism involving the carboxy terminus[J].Glia,2007,55(15):1554-64.
