双氢青蒿素对人骨肉瘤细胞株143B增殖和凋亡的作用
2012-02-10刘跃亮罗进勇何通川曾照芳
刘跃亮,罗进勇,张 彦,何通川,曾照芳
(1.重庆医科大学检验医学院,临床检验诊断学教育部重点实验室,重庆,400016; 2.美国芝加哥大学医学中心分子肿瘤学研究室,芝加哥 60637)
骨肉瘤是儿童和青少年最常见的原发恶性骨肿瘤之一,具有高恶性、早转移、预后差、生存率低等特点。虽然,近年来辅助化疗和新辅助化疗的广泛开展与应用,大为改善患者生存率,但是,现有化疗药物毒副作用大,而且,长时间住院治疗给患者带来的经济负担,往往不能使患者坚持化疗而导致肿瘤发生早转移、复发,甚至被迫截肢,治疗效率得不到提高,这越来越引起临床医生的关注和肿瘤研究者的重视。因此,研究新型的、高效低毒的抗人骨肉瘤药,成为骨肉瘤治疗研究的重点。
青篙素是我国学者从中药青篙中提取的含有过氧基团的倍半萜内酯(药用植物的生物活性组分)药物。而双氢青蒿素为青蒿素的衍生物之一,由青蒿素经四氢硼钠还原而成,分子式为C15H24O5,分子质量为284.35 ku,是青蒿素类药物在体内的主要的活性形式之一。很多文献研究表明,双氢青蒿素及其他衍生物除具有抗疟作用外,还可有效减轻狼疮肾炎动物模型的病理损害[1],此外,DHA也具有良好的抑制肺癌、前列腺癌、结直肠癌细胞、卵巢癌等的增殖和促进其凋亡的作用[2~6],具有明显的肿瘤杀伤作用。新药的多方面应用成为新药研究的新思路。但是,DHA在抗骨肉瘤方面的研究甚少。本研究就双氢青蒿素对人骨肉细胞的作用以及可能的作用机制进行探讨,为双氢青蒿素应用于人骨肉瘤治疗提供理论依据。
1 材料与方法
1.1 设备 化学发光成像分析系统(BIO-RAD,ChemiDoc XRS+,bio-rad laboratories,Inc),凝胶成像分析系统(BIO-RAD,bio-rad laboratories,Inc)。
1.2 细胞培养及试剂 人骨肉瘤细胞购自ATCC (American type culture collection)。细胞培养用DMEM培养基含10%的胎牛血清和1%青、链霉素(P/S),培养条件为5%CO2和37℃。噻唑盐MTT、二甲基亚砜(DMSO)和胰蛋白酶/EDTA溶液均购自美国Sigma公司。双氢青蒿素购自四川三奇制药有限责任公司,用DMSO溶解并配制为70 mmol·L-1药液,备用。DMEM培养基、胎牛血清(FCS)、青霉素/链霉素(P/S)购自美国Thermo scientific公司。Hoechst 33258(C1011)购自Beyotime。β-Catenin荧光素酶报告质粒,由美国芝加哥大学医学中心分子肿瘤学实验室,何通川教授惠赠。Lipofectamine2000 (Cat.No.11668-02)购自Inveitrogen。荧光素酶检测试剂购自Promega公司。BCA试剂盒,购自Thermo Scientific。以下抗体均购自Santa Cruze Biotechnology公司:mouse monoclonal antibody Bad(C-7):sc-8044;mouse monoclonal antibody Bcl-2(c-2):sc-7382;mouse monoclonal antibody Caspase-3(46):sc-136219;rabbit polyclonal antibody PCNA(FL-261): sc-7907。
1.3 方法
1.3.1 实验分组 根据前期实验,实验分为Control(空白对照)、DMSO(溶剂对照)、15、25、35 μmol ·L-1DHA 5组。
1.3.2 MTT试验 取对数生长期的单层贴壁细胞,用0.25%胰蛋白酶消化并吹打成单个细胞,制备成约为5×106个·L-1的细胞悬液,在96孔板中,每孔加入100 μl细胞悬液,待细胞贴壁后,按照预定的实验分组进行实验处理(每组进行8个复孔),处理结束前4 h,每孔加入 MTT(5 g·L-1) 0.02 ml,4 h后,在492 nm处进行吸光度(OD值)测定,并绘制细胞存活图。此实验重复3次。
1.3.3 克隆形成试验 取对数生长期的单层贴壁细胞,用0.25%胰蛋白酶消化并吹打成单个细胞,制备成细胞密度约为150个/ml的细胞悬液,6孔板,每孔加入1 ml细胞悬液,待细胞贴壁后,按照预定的实验分组进行实验处理,置37℃,5%CO2及饱和湿度环境下,静置培养,在d 10终止培养,弃去上清液,用PBS小心漂洗2次。固定(固定液为1∶3醋酸/甲醇)15 min,然后进行结晶紫活细胞染色30 min,用细流水缓慢漂洗去除染色液,自然风干。观察细胞克隆形成,在显微镜(低倍镜)计数大于10个细胞的克隆数,进行克隆形成计数并计算克隆形成率。此实验重复3次。克隆形成率/%=克隆数/接种细胞数×100%。
1.3.4 Hoechst 33258染色 取对数生长期的单层贴壁培养细胞,用0.25%胰蛋白酶消化并吹打成单个细胞,制备成细胞密度约为5×107个·L-1的细胞悬液,24孔板,每孔加入0.5 ml细胞悬液,待细胞贴壁后,按照预定的实验分组进行实验处理。待处理时间结束,加入Hoechst 33258溶液(1 g·L-1),37℃水溶7 min,冰上冷却,离心弃染液,PBS重悬,在紫外450 nm处观察蓝色荧光。正常对照细胞和坏死细胞呈弱蓝色,凋亡细胞呈高亮蓝色且观察到核固缩。此实验重复3次。
1.3.5 萤光素酶报告质粒试验 将指数生长状态的细胞铺于24孔板中,待细胞贴壁后,利用Lipofectamine 2000转染0.3 μg报告质粒,5 h后终止转染并更换为正常培养基,按实验分组处理,24 h后裂解细胞,按照试剂盒说明进行萤光素酶活性测定。BCA法测定裂解液总蛋白浓度,校正萤光素酶活性。每组实验重复3次,结果取平均值。
1.3.6 Western blot 人骨肉瘤143B细胞在DHA处理24 h后,使用碧云天WESTERN BLOT细胞裂解液(按说明书操作),收集蛋白样品(Protein sample preparation),在收集的蛋白样品中加入适量浓缩的SDS-PAGE蛋白上样缓冲液。沸水浴10 min,使蛋白质充分变性,然后进行SDS-PAGE电泳。此实验重复3次。
1.4 统计学分析 利用IBM SPSS Statistics 19软件对数据进行处理,实验数据以±s表示,不同组间比较采用方差分析。
2 结果
2.1 DHA抑制骨肉瘤细胞143B增殖
2.1.1 DHA明显地抑制143B细胞增殖活性和存活率(MTT比色法和结晶紫染色法) 不同浓度的DHA作用于人骨肉瘤143B细胞,24 h后,MTT比色法结果如Fig 1A所示,试验组较对照组,细胞增殖活性明显降低,且表现出浓度和时间依赖的的抑制效果。结晶紫染色结果如Fig 1B所示,处理组较对照组,细胞数明显减少,DHA浓度达到35 μmol· L-1时,效果最为明显。

Fig 1 Inhibitory effect of DHA on 143B osteasarcoma cell lines(±s,n=3)
2.1.2 DHA有效地减弱143B细胞克隆形成能力
DHA在明显抑制143B细胞增殖活性的同时,也抑制其克隆形成能力,如Fig 2克隆形成实验结果所示,各实验分组克隆形成率分别为0.607、0.580、0.453、0.313、0.253。

Fig 2 Effect of clone formation after DHA played role in 143B osteosarcoma cells
2.1.3 DHA抑制了细胞增殖蛋白PCNA表达 为了进一步说明DHA具有抑制人骨肉瘤细胞143B增殖的能力,研究中检测了增殖细胞核抗原(proliferating cell nuclear antigen,PCNA),DHA作用人骨肉瘤细胞143B,24 h后,Western blot检测结果(如Fig 4)显示PCNA蛋白表达减少,不能正常的发挥DNA聚合酶δ的辅助蛋白[7]的作用,使143B细胞DNA合成受限制,从而抑制其增殖。
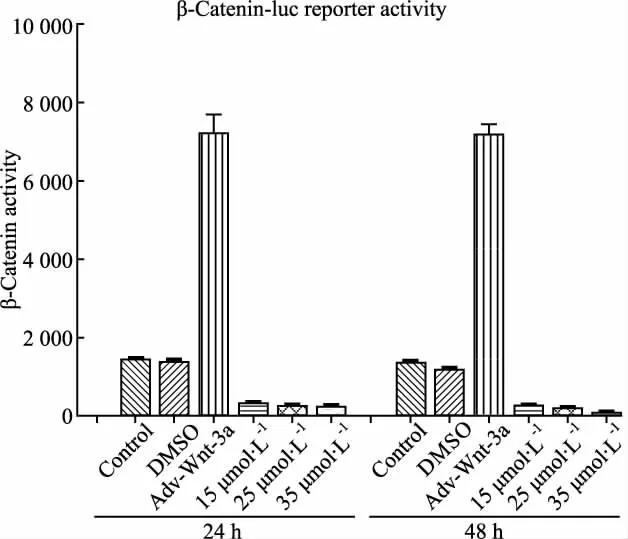
Fig 3 Activity of β-Catenin inhibited by DHA after its role in 143B cell lines
2.1.4 DHA抑制了Wnt-β-catenin信号转导通路中关键蛋白因子β-Catenin活性 因为Wnt-β-catenin信号转导通路异常与人类疾病密切相关,尤其是肿瘤方面。因此,研究中构建了β-Catenin荧光素酶质粒(p-Top),腺病毒介导的Wnt-3a过表达(阳性对照),结果显示,如Fig 3,Adv-Wnt-3a可有效刺激β-Catenin活性,而实验组只有很微弱的β-Catenin活性,表明DHA抑制了Wnt-β-catenin信号转导通路中关键蛋白因子β-Catenin的活性。

Fig 4 Decreased expression of PCNA protein induced by DHA in 143B cell lines
2.2 DHA诱导人骨肉瘤细胞143B凋亡
2.2.1 DHA促进143B细胞凋亡(Hoechst 33258细胞凋亡染色法) Hoechst33258细胞凋亡染色结果,如Fig 5所示,DHA作用于143B细胞24 h后,对照组,细胞形态完整、核大小一致、荧光分布均匀且呈弥散状,显示微弱蓝色,实验组较对照组,细胞核表现为明显的核缩小、染色质浓集,荧光着色不均匀,呈现细胞凋亡核形态,表明DHA具有诱导人骨内瘤细胞143B凋亡的作用。

Fig 5 Apoptosis of 143B osteosarcoma cell lines induced by DHA in Hoechst 33258 dye,and concentration-dependently
2.2.2 DHA使凋亡相关蛋白发生明显改变 通过检测与细胞凋亡密切相关的Bcl-2家族成员[8],Bcl-2和Bad,以及执行细胞凋亡的蛋白因子Caspase-3[9],在蛋白质水平上,进一步研究DHA诱导细胞凋亡的可能机制。Western blot结果,如Fig 6所示,Bcl-2蛋白表达下调,而Bad蛋白表达上调,增加了Bad与Bcl-2结合[10],从而抑制Bcl-2的抗凋亡活性,同时Caspase-3表达增高,表明其促凋亡功能被增强。所以,Western bolt结果提示DHA可有效地促进 143B细胞凋亡,可能是通过上调 Bad和Caspase-3蛋白,增加其促凋亡功能,并减弱Bcl-2蛋白的抗凋亡活性来发挥作用。
3 讨论
双氢青蒿素及其他衍生物,是一类药效明显、治愈率高、毒副作用和耐药性发生极低的抗疟药物,尤其对耐氯喹或对多种药物耐药的脑型疟和恶性疟有效[11],因此,被广泛应用于临床,还被WHO批准为抗疟一线药物。双氢青蒿素与青蒿素相比,水溶性较强,更易吸收,排泄和代谢迅速、高效、低毒等优点。随着研究的深入,人们发现双氢青蒿素除了特异地抗疟作用外,还具有抗炎、调节免疫、抑制瘢痕增生及抗肿瘤作用,尤其在抗肿瘤方面,抗肿瘤活性强,而对正常组织细胞的毒性很低,因此被广泛关注。本研究中,采用不同浓度的双氢青蒿素(DHA)体外作用于人骨肉瘤细胞株143B,通过MTT比色法检测发现(见Fig 1),不同浓度的DHA可以抑制骨肉瘤细胞143B的增殖,而且抑制率与DHA的浓度和时间存在依赖关系,当DHA浓度达到35 μmol ·L-1,作用48 h后,与对照组相比,抑制增殖效果最为明显,差异有显著性(P<0.01),而且143B细胞的克隆形成能力也明显受到抑制(见Fig 2)。
肿瘤的发生和发展,是多步骤、多阶段、多因素共同参与的结果。其中增殖和凋亡失控是其生理功能上最大的改变,表现为过度增殖和凋亡抑制。因此,对增殖和凋亡的干预,成为肿瘤治疗研究中的切入点。
细胞凋亡是有机体为保持自身组织稳定、调控自身细胞的增殖和死亡之间的平衡、由基因控制的细胞主动性死亡过程[12]。正常的细胞凋亡,受凋亡调节基因的严格调控,其中Bad和Bcl-2蛋白是重要的凋亡调节蛋白家族的重要成员,在组织中广泛表达。Bcl-2通过C末端疏水性氨基酸锚定于线粒体外膜,而Bad则散布于基质中,激活后移位至线粒体表面与Bcl-2作用,通过调控线粒体膜电位及通透性转换通道,释放线粒体膜间隙的促凋亡蛋白,如细胞色素C、Smac/DIABLO、AIF和endonuclease G(endoG)等,后者激活半胱氨酸蛋白酶(caspase)家族引发caspase级联反应并最终引起膜泡形成,核碎裂和细胞凋亡[10]。细胞中Bcl-2与Bad之间的比例决定了细胞是否接受诱导凋亡的信号。在研究中发现,DHA可有效地抑制了Bcl-2的表达,同时上调了Bad蛋白Caspase-3蛋白表达,如Fig 6,即,Bcl-2与Bad之间的比例已经被破坏,高表达的Bad蛋白与Bcl-2结合增多,从而抑制了其抗凋亡作用,同时,通过高表达的Caspase-3,增强其凋亡执行能力,而使143B细胞凋亡增加(见Fig 5)。

Fig 6 Change of protein expression after DHA's role in 143B osteosarcoma cell lines detected by Western blot
研究表明,Wnt-β-Ceatenin信号转导通路,无论在低等生物果蝇还是高等哺乳动物,都表现出其在生物进化中的保守性,使其成员都具有高度的同源性[13]。该信号通路异常与人类疾病密切相关,尤其在肿瘤的发生发展中。因此。对Wnt-β-Catenin信号转导通路的研究,不仅有助于理解人类疾病(尤其是肿瘤)可能的发生机制,而且可以为疾病的治疗提供一系列新的靶点。研究结果表明,DHA可以有效地降低β-Catenin的生物活性(Fig 3),因此,在后期实验中,将重点对Wnt-β-Catenin信号通路进行研究,包括β-Catenin降解复合物中糖原合成激酶3β(Gycogen synthesis kinase-3β,GSK-3β)及其磷酸化产物(GSK-3β通过磷酸化Ser33、Ser37和Thr41标记蛋白)蛋白表达,磷酸化位点确认,以及β-ceatenin的靶蛋白,如Cyclin D1、c-Myc等蛋白的表达,进一步对可能的作用机制进行探讨和研究,为双氢青蒿素应用于临床,提供更有价值的实验依据。
[1] 董妍君,李卫东,屠呦呦,等.双氢青蒿素对BXSB小鼠狼疮肾炎的作用及机制研究[J].中国药理学通报,2003,19(10): 1025-8.
[1] Dong Y J,Li W D,Tu Y Y,et al.The effect of DQHS on the pathologic changes in BXSB mice lupus nephritis and the effect mechanism[J].Chin Pharmacol Bull,2003,19(10):1125-8.
[2] Jemal A,Siegel R,Ward E,et al.Cancer statistics[J].CACancer J Clin,2008,58(2):71-96.
[3] 高小玲,罗子国,王丕龙,李庆春.双氢青蒿素诱导前列腺癌PC-3细胞凋亡及其机制研究[J].中草药,2010,41(1):81-5.
[3] Gao X L,Luo Z G,Wang P L,Li Q C.Induction of dihydroartemicinin on proctate cancer PC-3 apoptosis and its mechanism[J].Chin Tradit Herb Drugs,2010,41(1):81-5.
[4] 战晓农,黄 燕,王 雷,等.双氢青蒿素对人结直肠癌裸鼠移植瘤的抑制作用及机制研究[J].中药新药与临床药理,2011,22(5):491-4.
[4] Zhan X N,Huang Y,Wang L,et al.Antitumor Effect and mechanism of dihydroartemisinin on colorectal cancer in nude mice with transplanted tumor of human colorectal cancer[J].Tradit Chin Drug Res Clin Pharmacol,2011,22(5):491-4.
[5] Chen T,Li M,Zhang R,Wang H.Dihydroartemisinin induces apoptosis and sensitizes human ovarian cancer cells to carboplatin therapy[J].J Cell Mol Med,2009,13(7):1358-70.
[6] 邵义如,朱尤庆,刘 敏.二氢青蒿素对结肠癌细胞系SW480増殖凋亡的影响[J].武汉大学学报,2008,29(3):319-24.
[6] Shao Y R,Zhu Y Q,Liu M.Effects of Dihydroartemisinin on the proliferation and apoptosis of colon carcinoma cell line SW480[J].Med J Wuhan Univ,2008,29(3):319-24.
[7] Essers J,Theil A F,Baldeyron C,et al.Nuclear dynamics of PCNA in DNA replication and repair[J].Mol Cell Biol.2005,25(21): 9350-59.
[8] Lin B,Kolluri S K,Lin F,et al.Conversion of Bcl-2 from protector to killer by interaction with nuclear orphan receptor Nur77-TR3[J].Cell,2004,116(4):527-40.
[9] 牟钰钦,周龙洋,杨秋珺,等.全反式维甲酸对骨肉瘤细胞143B生长的影响[J].中国药理学通报,2011,27(8):1091-5.
[9] Mou Y Q,Zhou L Y,Yang Q J,et al.Effect of ATRA on the growth of 143B osteasarcoma cells[J].Chin Pharmacol Bull,2011,27 (8):1091-5.
[10]Norberg E,Gogvadza V,Ott M,et al.An increaseinintra-cellular Ca2+is reguired for the activation of mitochondrial calpain torelease AIF during cell death[J].Cell Death Differ,2008,15(12): 1857-64.
[11]蔡贤铮.抗疟药联用治疗我国抗药性恶性疟概述[J].海南医学,2000,12(2):1-4.
[11]Cai X Z.The overview of drug-resistant falciparum malaria treatment by antimalarial combination in China[J].Hainan Med J,2000,12(2):1-4.
[12]Dlugosz P J,Billen L P,Annis M G,et al.Bcl-2 changes conformation to inhibit Bax oligomerization[J].EMBO J,2006,25(11): 2287-96.
[13] Clevers H.Wnt/beta-ceatenin signaling in development and disease[J].Cell,2006,127(3):469-80.
