瑶药落懂紧(金樱子)根药材质量标准研究
2012-01-26周小雷王硕樊溪源龚小妹袁经权
周小雷,王硕,2,樊溪源,龚小妹,3,袁经权,4*
(1.广西药用植物研究所,广西南宁530023;2.广西医科大学,广西南宁530021;3.广西中医学院,广西南宁530001;4.暨南大学中药及天然药物研究所,广东广州510632)
瑶药落懂紧[1]为蔷薇科植物金樱子Rosa laevigataMichx的干燥根,性平、味酸涩,有固精涩肠作用。主治遗精、遗尿、痢疾泄泻、崩漏带下、子宫脱垂、痔疮[2],可用于治疗烧烫伤[3],止滑痢,煎醋服化骨哽[4],现在已广泛地被用于临床。研究表明金樱根含三萜皂苷[5]、黄酮[6]、鞣质[7]等成分。现代药理研究表明金樱根有抗炎、止痛、止血、促进肠蠕动作用[8-11],有耐缺氧作用[12]。是两广和湖南地区习用的大宗药材,为四大著名传统中药三金片、金鸡胶囊、妇科千金片、王老吉的主要成分,长期以来一直强力支撑着我国重点中药产业的发展。参考文献[13]对其药材质量标准进行研究,以便更有效控制该药材。
1 仪器与试药
1.1 仪器LEICA生物显微镜(德国LaiLa),电子分析天平(CP2250D,Sartorius),SX2—4JOA箱式电阻炉(上海比尔得仪器实业有限公司),210型高效色谱仪(UV325检测器,410自动进样器,美国瓦里安公司),超纯水仪(美国Millipore Milli-Q Academic)。
1.2 对照品金樱根皂苷D、E对照品为自行制备。金樱根皂苷D为白色晶体(三氯甲烷),LCMS:m/z651[M+H+],1H-NMR(600 MHz)δ:1.29,1.51(2H,m,H-1),4.14(1H,m,H-2),3.12(1H,dd,J=9.6,4.0 Hz,H-3),1.12(1H,H-5),1.84(2H,H-6),1.80(2H,H-7),1.70(1H,H-9),2.01(2H,H-11),5.17(1H,br.s,H-12),1.78(2H,H-15),1.22(2H,H-16),2.51(1H,s,H-18),1.31(1H,H-20),1.24(2H,H-21),1.75(2H,H-22),1.09(3H,s,H-23),0.65(3H,s,H-24),0.85(3H,s,H-25),0.72(3H,s,H-26),0.86(3H,s,H-27),1.22(3H,s,H-29),0.81(3H,d,J=6.5 Hz,H-30),5.27(1H,d,J=7.0,Hz,H-1'),3.28~3.32(1H,m,H-2'),3.30~3.33(1H,m,H-3'),3.32-3.37(1H,m,H-4'),3.37~3.43(1H,m,H-5'),3.47(1H,dd,J=12,4.3 Hz,H-6'),4.15(1H,dd,J=12,2.0 Hz,H-6')。13C-NMR(CD3OD,600 MHz)δ:42.8(C-1),66.0(C-2),79.0(C-3),38.6(C-4),48.4(C-5),18.5(C-6),33.4(C-7),40.7(C-8),47.6(C-9),38.6(C-10),24.1(C-11),128.2(C-12),139.1(C-13),42.0(C-14),29.3(C-15),26.0(C-16),48.4(C-17),54.3(C-18),72.5(C-19),42.0(C-20),26.9(C-21),37.6(C-22),29.0(C-23),22.2(C-24),16.7(C-25),17.4(C-26),24.5(C-27),176.8(C-28),26.7(C-29),16.7(C-30),95.6(C-1'),73.8(C-2'),78.7(C-3'),71.1(C-4'),79.0(C-5'),62.3(C-6')。以上数据与文献[14]报道的2α,3α,19α-2,3,19-tridroxyurs-12-en-28-oic acid β-D-glucopyranosyl ester一致。
金樱根皂苷E为白色晶体(三氯甲烷),LCMS:m/z651[M+H+],1H-NMR(600MHz)δ:1.49,1.60(2H,m,H-1),4.10(1H,m,H-2),2.52(1H,dd,J=11.4,4.3 Hz,H-3),1.09(1H,H-5),1.81(2H,H-6),1.79(2H,H-7),1.70(1H,H-9),2.01(2H,H-11),5.30(1H,br.s,H-12),1.78(2H,H-15),1.21(2H,H-16),2.43(1H,s,H-18),1.33(1H,H-20),1.25(2H,H-21),1.75(2H,H-22),1.10(3H,s,H-23),0.68(3H,s,H-24),0.88(3H,s,H-25),0.66(3H,s,H-26),0.89(3H,s,H-27),1.21(3H,s,H-29),0.82(3H,d,J=6.5Hz,H-30),5.31(1H,d,J=8.0 Hz,H-1'),3.28~3.32(1H,m,H-2'),3.30~3.33(1H,m,H-3'),3.32~3.37(1H,m,H-4'),3.37~3.43(1H,m,H-5'),3.65(1H,dd,J=12,4.3Hz,H-6'),3.80(1H,dd,J=12,2.0 Hz,H-6')。13C-NMR(CD3OD,600 MHz)δ:47.1(C-1),68.2(C-2),83.3(C-3),40.0(C-4),56.5(C-5),20.3(C-6),33.2(C-7),40.0(C-8),46.7(C-9),38.4(C-10),23.7(C-11),128.4(C-12),138.5(C-13),41.6(C-14),25.3(C-15),26.0(C-16),48.4(C-17),53.8(C-18),72.4(C-19),41.7(C-20),28.4(C-21),37.0(C-22),23.3(C-23),16.3(C-24),14.4(C-25),15.4(C-26),25.9(C-27),177.3(C-28),23.9(C-29),15.4(C-30),94.6(C-1'),72.7(C-2'),77.3(C-3'),69.9(C-4'),77.1(C-5'),61.2(C-6')。以上数据与文献[15]报道的一致,为2α,3β,19α-2,3,19-tridroxyurs-12-en-28-oic acid β-D-glucopy ranosyl ester。经HPLC面积-归一化测定,化合物纯度均为99%。
1.3 药材与试剂11批金樱根药材采自广西不同产地,经马小军研究员鉴定为蔷薇科植物金樱子Rosa laevigataMichx的根。甲醇(色谱纯,美国Fisher公司)、乙腈(色谱纯,美国Fisher公司),其它试剂均为分析纯。
2 方法与结果
2.1 薄层鉴别取不同产地金樱根药材粉末2 g,分别加入80%的乙醇各50 mL,提取2次,每次超声提取30 min,过滤,弃去滤渣,滤液减压蒸干,用甲醇转溶至10 mL量瓶中并定容,作为供试品溶液。另取金樱根皂苷D、E对照品,加甲醇制成每1 mL含1 mg的溶液,作为对照品溶液。照薄层色谱法(中国药典2010年版一部附录V B)试验,吸取不同产地供试品溶液各10 μL、对照品溶液5 μL,分别点在同硅胶G薄层板上,以三氯甲烷-甲醇-甲酸(5∶1∶1)为展开剂,以香草醛-硫酸液为显色剂,供试品色谱中,在与对照品色谱相应的位置上,主斑点显相同深蓝色的斑点。结果见图1。

图1 瑶药落懂紧(金樱子)根药材的TLC图Fig.1 TLC chromatogram of Rosa laevigata Radix
2.2 浸出物采用冷浸法测定醇溶性浸出物,乙醇为95%,结果见表1。11个不同产地的样品的水浸出物结果在8.73%~19.93%,平均13.68%,醇浸出物结果6.83%~18.99%,平均10.86%,暂定水浸出物不得少于8%,醇浸出物不得少于6%。
2.3 水分、灰分检查以烘干法测定药材的水分,灰分测定方法参照《中国药典》2010年版一部附录ⅨK灰分测定法,结果见表1。

表1 各产地金樱根水分、灰分及浸出物测定结果Tab.1 Results of moisture,ash and extract in Rosae laevigatae Radix
检查结果显示:11个不同产地的样品的总灰分平均值为3.51%,酸不溶性灰分平均值为0.23%。水分平均为7.59%,暂定为总灰分不得过6%,酸不溶性灰分不得过2%,水分不得大于10%。
2.4 样品测定
2.4.1 色谱条件Diamonsil C18色谱柱(4.6 mm×250 mm,5 μm),流动相A为甲醇-乙腈(4∶1),流动相B为0.1%磷酸水,梯度洗脱(0~40 min,30%~80%A);检测波长为210 nm,柱温为30℃,体积流量为0.6 mL/min。见图2。

图2 混合对照品(A)与金樱根药材供试品(B)的HPLC图谱Fig.2 HPLC chromatogram s of reference substances(A)and Rosae laevigatae Radix
2.4.2 供试品溶液的制备取金樱根药材粉末0.8g,精密称定,按照2.1项下方法制备供试品,用色谱甲醇转溶至10 mL量瓶中并定容,摇匀,以0.45 μm的微孔滤膜过滤即得。照2.4.1项条件进行样品分析,样品中金樱根皂苷D、E与其它组分能够达到基线分离,与相邻的色谱峰分离度大于1.5,结果见图2。
2.4.3 线性关系的考察精密称定金樱根皂苷D对照品0.011 89 g、金樱根皂苷E 0.011 61 g,用色谱甲醇溶解定容至刻度摇匀,配得混合对照品液体(其中金樱根皂苷D质量浓度为0.594 5 mg/mL、金樱根皂苷E为0.580 5 mg/mL),摇匀后以0.45 μm的滤液微孔滤膜过滤,自动进样2、4、8、12、16、20 μL,按2.4.1项测定,以峰面积(Y)对进样量(X)进行回归,得金樱根皂苷D标准曲线方程为Y=10.101X-3.451(r=0.999 9),金樱根皂苷E为Y=8.539X-2.111(r=0.999 8)。金樱根皂苷D、E分别在1.189 μg~11.890 μg、1.161 μg~11.610 μg之间时,进样量与峰面积之间有良好的线性关系。
2.4.4 精密度考察取金樱根皂苷D质量浓度为0.594 5 mg/mL、金樱根皂苷E质量浓度为0.580 5 mg/mL的混标溶液,连续进样6次,进样量10 μL,按2.4.1项色谱条件测定峰面积,结果金樱根皂苷D、E的峰面积RSD值分别为0.81%、0.71%。
2.4.5 稳定性考察取金樱根2号供试品液,于0、2、4、6、8、12 h进样10 μL,按2.4.1项色谱条件测定峰面积,结果金樱根皂苷D、E的峰面积RSD值分别为0.38%、0.27%,结果表明,供试品溶液在12 h内稳定。
2.4.6 重复性考察取金樱根2号药材粉末2 g,共6份,精密称定,按2.4.2项下方法制备供试品溶液,进样10 μL,按2.4.1项色谱条件测定峰面积,结果金樱根皂苷D、E的峰面积RSD值分别为0.87%、1.09%。
2.4.7 加样回收率考察取已测定的金樱根2号药材粉末6份,各0.4 g,精密称定,精密加入金樱根皂苷D对照品1.922 mg/mL、金樱根皂苷E对照品2.746 mg/mL各1 mL,按2.4.2项制备供试品溶液,微孔滤膜滤过,自动进样10 μL,按2.4.1项色谱条件测定峰面积,计算加样回收率,结果见表2。
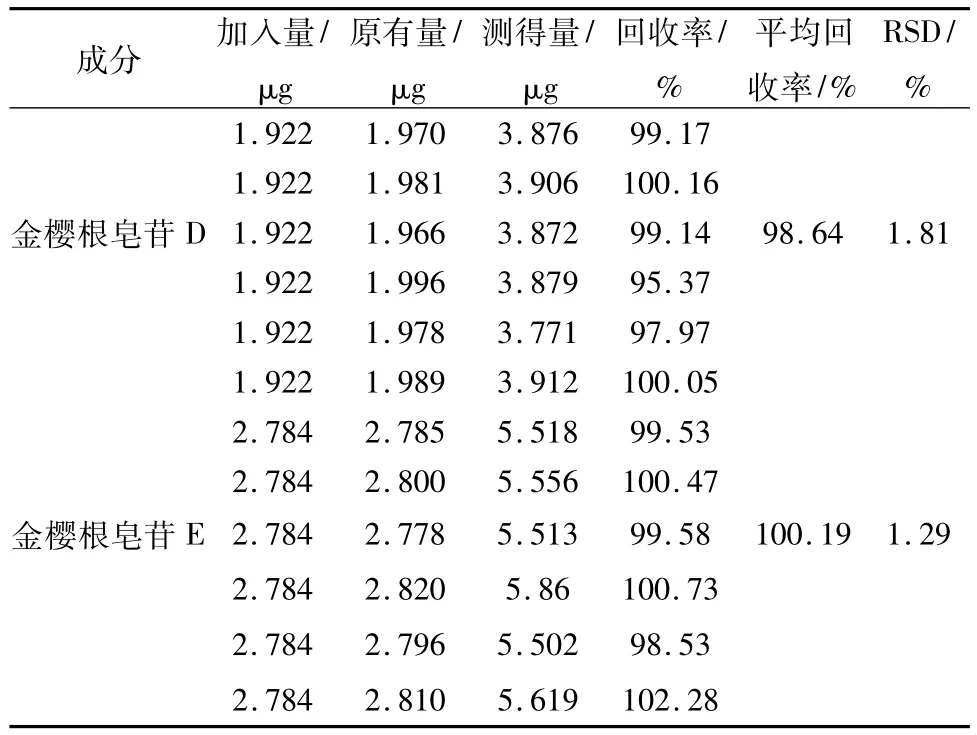
表2 加样回收率试验结果Tab.2 Results of recovery tests
2.4.8 样品测定取供试样品,过0.45 μm的微孔滤膜过滤,自动进样,测定,根据标准曲线计算。结果表明:金樱根皂苷D质量分数为0.042 0%~0.492 5%;金樱根皂苷E质量分数为0.082 6%~0.696 0%,见表3,暂拟定“每克药材金樱根皂苷D不少于0.03%,金樱根皂苷E不少于0.07%”。

表3 金樱根药材测定结果(n=3)Tab.3 Contents of laevigatoside D and laevigatoside E in Rosae laevigatae Radix(n=3)
3 讨论
金樱根药材中有效成分检测指标的缺失严重影响其药材质量,建立金樱根中成分的定性定量的检查方法对于保证金樱根药材的质量具有重要意义。因此本实验制备了金樱根药材的对照品,并建立其薄层色谱检识方法和高效液相色谱定量测定方法。
在前期的金樱根化学成分研究中,发现金樱根主要成分为皂苷和鞣质,尤其皂苷类化合物在金樱根中广泛存在,是一类特征性成分,且具有多种生物活性。其中,金樱根皂苷D(2α,3α,19α-2,3,19-tridroxyurs-12-en-28-oic acid β-D-glucopyranosyl ester)和金樱根皂苷E(2α,3β,19α-2,3,19-tridroxyurs-12-en-28-oic acid β-D-glucopyranosyl ester)为异构体皂苷,是金樱根的主要皂苷类化合物。因此本研究选用了3种不同的提取溶剂乙醇、丙酮和乙酸乙酯对样品进行提取,以金樱根皂苷D和金樱根皂苷E的为考察指标,HPLC测定结果表明,溶剂对提取效果影响较大,乙醇做提取剂对金樱根皂苷D和金樱根皂苷E的提取效果最好。对于供试品的制备过程中,对不同的乙醇体积分数、提取次数、超声时间进行了比较,结果以80%的乙醇,超声提取30 min,提取2次的效果最好,故采用本法制备供试品溶液。
本实验经过多次选择条件,最后采用A相为甲醇-乙腈(4∶1),B相为0.1%磷酸水,梯度洗脱(0~40 min,30%~80%A)。曾经采用甲醇-水为流动相,梯度洗脱,但是所测得的金樱根皂苷D和金樱根皂苷E保留时间长,峰型前沿且与前面的干扰峰达不到基线分离,选择乙腈-0.1%磷酸水作为流动相,梯度洗脱,但所测保留时间过短,干扰峰与金樱根皂苷D、金樱根皂苷E的分离度达不到测定要求。经过甲醇与乙腈比例的调整,有机相和水相梯度的调整,最终达到干扰峰与金樱根皂苷D、金樱根皂苷E达到基线分离,分离度大于1.5,金樱根皂苷D和金樱根皂苷E分离度大于1.5,且峰型对称,理论塔板数高。
对所测样品中金樱根皂苷D、E的质量分数与样品水浸出物和乙醇浸出物数值进行比较,结果表明金樱根皂苷D、E的质量分数与浸出物数值没有相关性,金樱根浸出物的数值高低可能与其中其他成分的高低有关。
[1]庞声航.实用瑶药学[M].南宁:广西科学技术出版社,2008:216-219.
[2]广西壮族自治区卫生厅.广西中药材标准:第二册[S].南宁:广西科技出版社,1996:68-69.
[3]梁志廷.金樱根治疗烧烫伤[J].浙江中医杂志,1989,24(4):188.
[4]明·李时珍.本草纲目:下册[M].北京:人民卫生出版社,1978:2096.
[5]Yuan Jingquan,Yang Xinzhou,Miao Jianhua,et al.New triterpene glucosides from the roots ofRosa laevigata Michx[J].Molecule,2008,13,2229-2237.
[6]易运红,吴功庆,林淑萍,等.金樱子根及茎总黄酮的提取研究[J].广东农业科学.2010(7):121-123.
[7]黄慧,田素英,高达枝.金樱根不同炮制品的总鞣质含量比较[J].亚太传统医药,2011,7(8):33-35.
[8]王艳,杨静,李志响,等.金樱根、茎抗炎作用的对比研究[J].中国现代中药,2010,12(3):34-35.
[9]邹堂斌,解庆林.金樱根的抗炎作用及对巨噬细胞释放NO的影响[J].贵州农业科学,2011,39(2):148-150.
[10]邹堂斌,邱运梅.金樱根抗炎及止泻作用试验[J].中国兽医杂志,2011,47(5):52-53.
[11]黄云,王斯成,戴波.金樱子根与金樱子茎水提物药理作用的研究[J].中国中医药咨讯,2011,3(14):8-9.
[12]黄贤华,谭晓彬,曾靖,等.金樱根醇提取液耐缺氧作用的研究[J].赣南医学院学报,2003,23(5):488-499.
[13]马仁强,邹红,李华.金不换药材质量标准研究[J].中成药,2008,30(11):附7-9
[14]Seto T,Tanaka T,Tanaka O,et al.β-Glucosyl esters of 19α hydroxyursolic acid derivatives in leaves ofRubusSpecies[J].Phytochemistry,1984,23(12);2829-2834.
[15]Kuruuzum-Uz A,Guvenalp Z,Kazaz C,et al.Four new triterpenes fromAnchusa azurea[J].Helve Chim Acta,2010,93(3):457-465.
