非O157产志贺毒素大肠杆菌分离株的多位点序列分型研究*
2012-01-24白向宁赵爱兰夏胜利熊衍文徐建国
白向宁,赵爱兰,夏胜利,熊衍文,徐建国
产志贺毒素大肠杆菌(Shiga toxin-producing Escherichia coli,STEC)是一类重要的食源性病原菌,可引起水样腹泻、出血性肠炎、溶血性尿毒综合征(Hemolytic-uremic syndrome,HUS)等病死率高的疾病[1]。自1982年美国首次报道由O157∶H7引起的暴发以来,世界各国相继报道了不同血清型的STEC散发感染和暴发[2-5],其中以 O157∶H7血清型为主。目前发现有超过200种非O157血清型的STEC能引起人类疾病[6]。在对全球35个国家的肠道感染病例监测中发现,2002-2005年非O157STEC感染率上升了60.5%,而 O157 STEC只有13%的上升[7]。特别是2011年5月,德国出现一起由O104∶H4感染引起的暴发疫情,共造成4 075人发病,其中50人死亡(WHO,2011年7月22日数据),提示未来非O157STEC的流行或暴发可能会成为公共卫生领域的一个重要问题。
早在1998年世界卫生组织就已提出将非O157 STEC的快速检测作为公共健康的首要问题之一(WHO,1998)。美国自2001年起开展了对非O157STEC感染的主动监测,非O157STEC感染的报告病例逐年上升[4]。欧盟于1998年通过了人感染STEC病例报告的相关法案。2005-2009年欧盟国家每年报告的STEC感染病例数在3 000例左右,其中非O157感染病例近二分之一[8]。我国1999年苏皖出现O157∶H7感染大暴发,为此2000年卫生部发布了《全国肠出血性大肠杆菌O157∶H7感染性腹泻监测方案(试行)》,加强了我国重点地区的O157∶H7的监测工作,但目前我国尚未系统开展非O157STEC感染调查和病原菌检测工作。本研究通过对我国分离的部分非O157STEC菌株进行血清型鉴定、主要毒力基因检测及分子分型分析,旨在初步了解我国这类菌株的分子流行病学特征和遗传背景。
1 材料与方法
1.1 材料
1.1.1 菌株来源 28株非O157STEC菌株2002年4-8月分离自河南某波尔山羊场羊粪,1株2009年分离自黑龙江某农村肉牛粪。菌株经中国疾病预防控制中心传染病预防控制所新病原室复核和O157及H7血清型鉴定排除后-80℃保存。
1.1.2 主要试剂与仪器 大肠杆菌O及H抗原全套血清购自丹麦血清学研究所(Statens Serum Institut,Denmark),致病性大肠杆菌O抗原诊断血清购自天津生物芯片技术有限责任公司;La Taq DNA聚合酶、10×PCR Buffer、dNTPs及DL2000 DNA Marker购自大连TaKaRa公司;细菌基因组提取试剂盒(Bacteria Gene DNA kit)购自康为世纪公司。PCR仪(SensoQuest Labcycler)购自德国Senso公司;凝胶成像系统(Gel Doc2000)购自美国Bio-Rad公司;引物由生工生物工程(上海)有限公司合成;PCR产物纯化及测序由北京天一辉远生物科技有限公司完成。
1.2 方法
1.2.1 血清型鉴定 O血清型鉴定使用丹麦血清研究所和天津生物芯片有限公司生产血清套装,鉴定步骤按照说明书进行。H血清型的分型首先采用fliC基因全长引物(见表1),PCR扩增后测序,根据序列比对结果判定型别,最后以H抗原诊断血清复核。
1.2.2 DNA模板的制备 细菌基因组提取按试剂盒说明书进行,制备好的模板置-20℃冻存备用。
1.2.3 毒力基因检测 对29株菌的3个毒力基因stx1、stx2、eaeA进行PCR鉴定。PCR引物序列及产物大小见表1,PCR扩增条件为:预变性95℃15 min,变性94℃30s,退火57℃90s,延伸72℃90s循环30次,最后72℃ 延伸10min[9]。
1.2.4 管家基因扩增 根据E.coli MLST数据库(http://mlst.ucc.ie/mlst/dbs/Ecoli)提供的大肠杆菌MLST分型方案,选择7个管家基因adk、fumC、gyrB、icd、mdh、purA、recA,PCR 引 物 序列、退火温度及产物大小见表1。PCR反应采用50 μL体系,包括10μmol/L的上下游引物各2μL,2 mmol/L dNTPs 2.5μL,含 MgCl2的 10×PCR Buffer 5.0μL,5U/μL的La Taq DNA聚合酶0.5 μL,加双蒸水至49μL,模板DNA 1.0μL。PCR反应条件为:预变性95℃4min;变性94℃30s,退火45s,延伸72℃1min,循环30次;72℃ 延伸7 min。每次扩增均以无DNA模板的体系作为空白对照。取PCR产物3μL以1%琼脂糖凝胶电泳进行检测。PCR产物经纯化后,用相应测序引物(表1)进行双向测序。
1.2.5 序列分析 用SeqMan II(DNAStar)软件并结合菌株等位基因的正反向序列图谱对等位基因序列进行拼接和校正。将校正后的序列在E.coli MLST数据库中进行比对,确定菌株的等位基因型和序列类型。用 MEGA 4.0、eBURST V3软件分析不同ST型克隆群及菌株之间的亲缘关系。
2 结 果
2.1 血清型鉴定结果 29株非O157STEC菌株的血清型鉴定结果见表2,主要血清型为O103∶H8(8/25)和 O21∶H25(6/29),属于 O91∶H14、O12∶H21、O45∶H2、O15∶H21血清型的分别有2株菌,有5株菌分别属于5种不同的血清型,另有2株菌的O血清型未能确定。
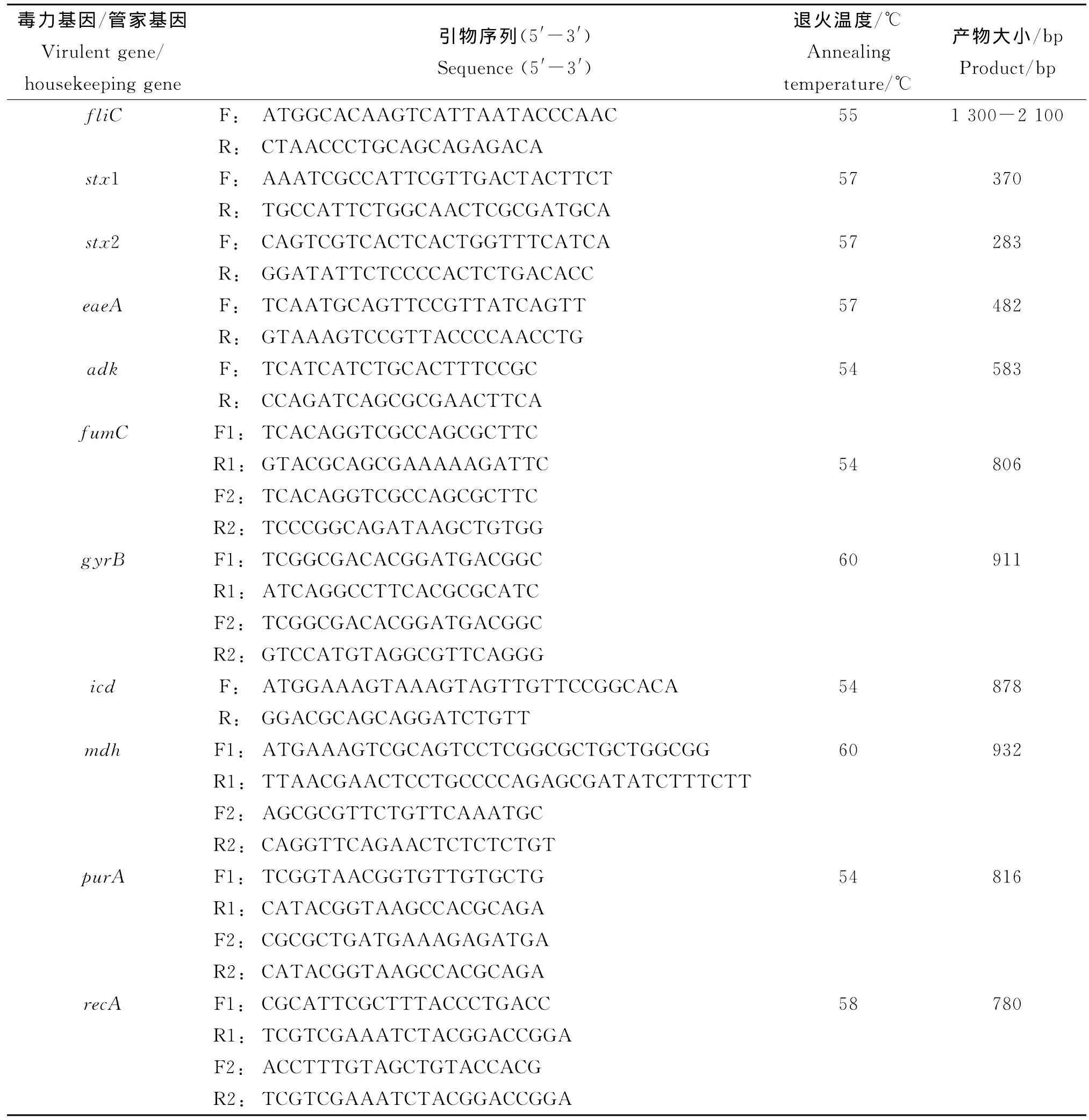
表1 fliC,毒力基因和7个管家基因的PCR引物Tab.1 PCR primers of fliC,virulent genes and seven housekeeping genes
2.2 毒力基因检测结果 29株非O157STEC菌株的eaeA基因均为阴性,仅stx1基因阳性的有19株菌(65.52%),仅stx2基因阳性的有4株菌(13.79%),stx1、stx2 基 因 同 时 阳 性 的 有 6 株 菌(20.69%),菌株的主要毒力基因携带情况见表2。
2.3 MLST分型结果 应用7个管家基因的MLST分型方法,29株非O157STEC可以分成13个ST型,结果见表2。本研究发现2个新的等位基因型fumC376、recA214和3个新的序列类型ST2460、ST2467、ST2468。不同ST型别包含的菌株数有差异,其中ST155包含10株菌(34.48%),为本次研究的优势型别,其次为ST906(17.24%)、ST446(10.34%)、ST33(6.90%),其余9个序列型均只包含1株菌。
2.4 遗传进化分析 利用MEGA 4.0软件从碱基组成的角度对13个ST型别及国外STEC流行的优势 血 清 型 (O157、O26、O103、O111、O145 及O104)菌株的6个ST型别之间做了系统发生分析,将7个管家基因的序列按顺序拼接后采用Neighbor-joining法绘制进化树(图1),Bootstrap值的计算分析根据1 000次随机抽样进行。结果显示,我国非O157STEC菌株除一些ST型别相对特异外,存在与国际上优势血清型亲缘关系较近的ST型菌株。
通过eBURST V3对MLST数据库中所有STEC相关的ST型进行聚类分析,按至少有4个以上等位基因相似的参数原则,将不同的ST归为特定的ST序列群,ST型中单位点差异(SLV)和双位点差异(DLVs)最多的ST型可作为ST序列群的核心序列 型 (group founder ST)[10]。 结 果 显 示 (图2),ST2460与ST155聚为1个ST序列群,其他11个ST型别散在分布。本研究中的3个型别ST25、ST33、ST446与国外其他ST型聚成3个ST序列群,且这3个ST型均为对应序列群的核心序列型。
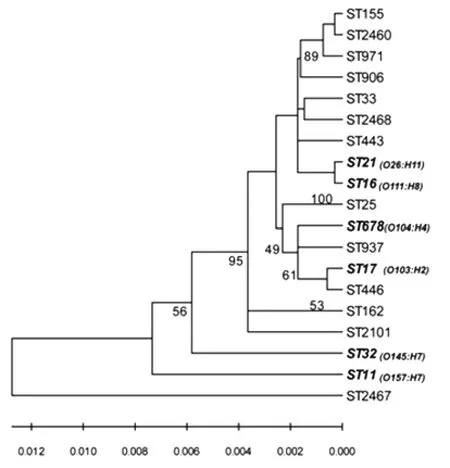
图1 非O157产志贺毒素大肠杆菌不同ST型别的遗传进化分析注:斜体加粗字体表示国际上优势血清型STEC的ST型Fig.1 Phylogenetic tree analysis of different STs from 29 non-O157STEC isolatesNote:STs of dominant serotypes of STEC are indicated in bold-face italic type.
3 讨 论
目前国际上报道的非O157STEC菌株的主要血清型 为 O26,O111,O103,O145,O91,O113,O128,O118等[2]。本研究对我国29株非O157STEC的血清分型结果发现以O103,O21为主,同时检测出 O91,O113,O118,O12,O15等血清型的菌株,由此可见,我国部分STEC菌株在血清型分布上与国际流行株既存在相似性,也存在一些差异。这一方面可能与我们分析的菌株数量有关,另一方面可能是我们国家菌株本身的特点。我国卫生部《感染性腹泻诊断标准》(ws271-2007)中,对肠出血性大肠杆菌的主要血清型除O157∶H7外,只列举了O26和O111。根据本研究结果,提示在今后的STEC监测和检测工作中,我们也应重视其他血清型的菌株。
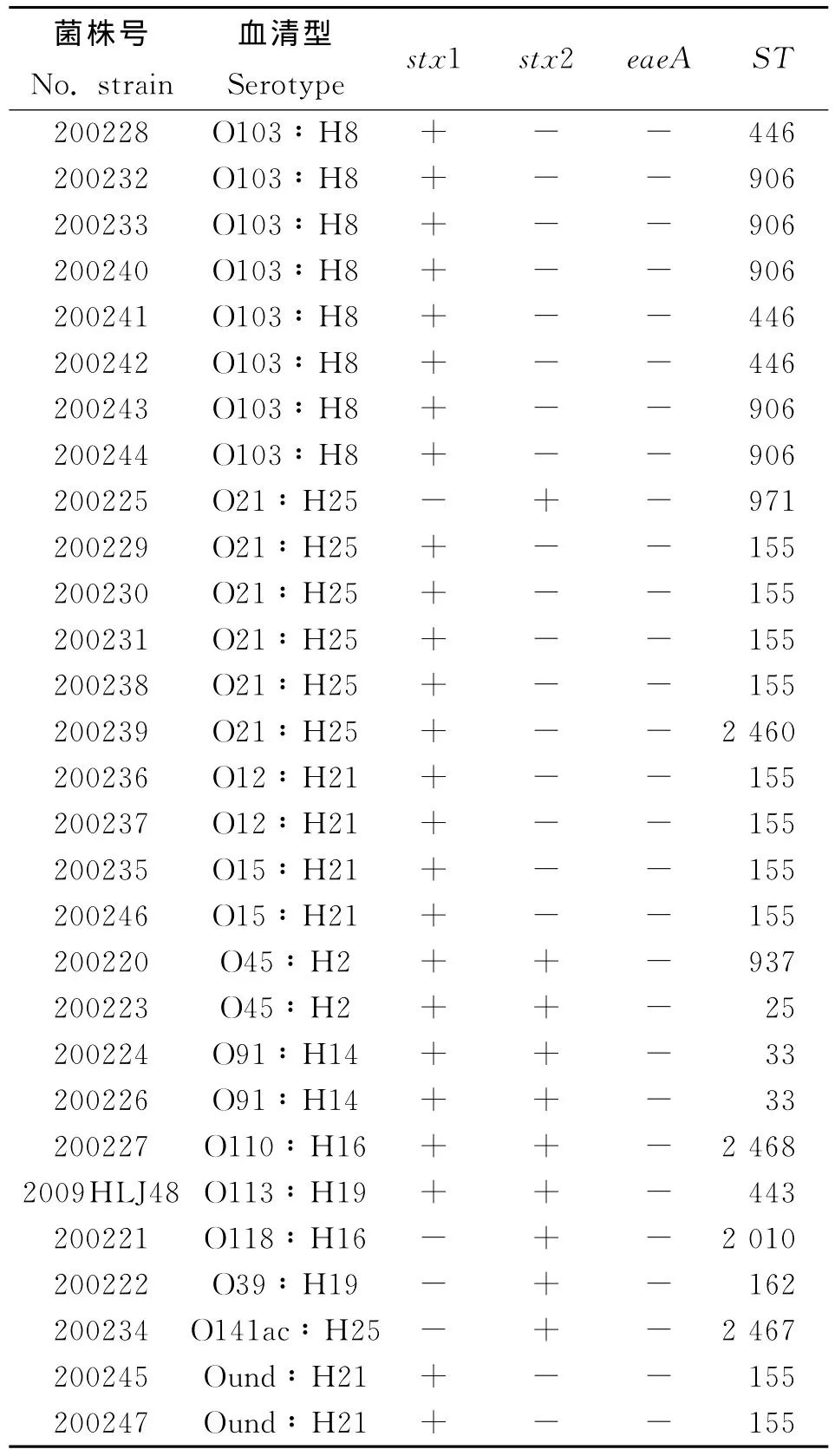
表2 29株非O157STEC的血清型鉴定、毒力因子检测及MLST分型结果Tab.2 Serotypes,virulent gene profiles and sequence types of 29non-O157STEC isolates
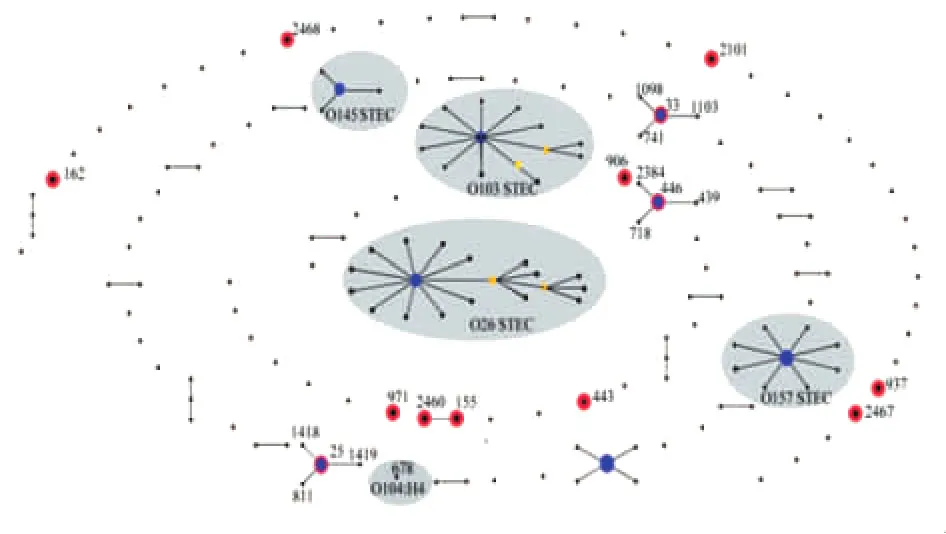
图2 产志贺毒素大肠杆菌相关ST型别的eBURST聚类分析注:每个黑点代表1个序列型别,蓝色节点表示group founder ST,黄色节点为subgroup founder ST。红色圆圈内为本研究菌株的13个ST型别,灰色区域代表国际上几个优势血清型STEC的序列群。Fig.2 Population snapshots of STEC clusters for related STs in the E.coli MLST database by eBURST analysisNote:Black dots represent different STs;blue nodes represent predicted founder STs;yellow nodes represent sub-founders.Thirteen STs identified in this study are circled in red;grey area point to the ST complexes of common serotypes of STEC worldwide.
毒力基因检测结果显示,29株菌的eaeA基因均呈阴性,stx1基因阳性的菌株占了大多数(86.20%),仅stx2基因阳性菌株只有13.79%,这与王涛等[11]报道的我国O157STEC分离株的毒力基因特点明显不同。研究推测,相对于O157∶H7,非O157STEC可能更多地携带stx1基因。Hedican等[12]对O157STEC和非O157STEC的毒力基因特点和致病性做了对比分析,与本研究结果相似。国外相关研究表明[13],eaeA阴性的非O157STEC及仅携带stx1毒力基因的非O157STEC同样会导致严重的疾病,如出血性腹泻、溶血性尿毒综合症等。我国非O157STEC菌株eaeA基因依赖以外的粘附机制,尚有待进一步研究。
对非O157STEC进行分子分型,对了解菌株的遗传进化特征,暴发溯源等具有重要意义。目前用于病原微生物分子分型主要有基于表型和基因型两大类。基于基因型的MLST作为一种准确的分子分型方法,自1998年Maiden[14]等首次运用于脑膜炎奈瑟菌的分型以来,以其分辨率高、数据可靠、重复性好、不同实验数据便于比较、有利于全球范围的分子流行病学数据标准化等特点而广泛应用于其他病原菌的流行病学、遗传进化、致病性等方面的研究。
本研究利用MLST方法对29株非O157 STEC进行分子分型研究,发现了2个新的等位基因型和3个新的序列型。大多数型别(12/13)散在分布,推测这些型别之间具有较远的遗传关系,具有明显的分子多态性。Mellmann等[15]通过采用MLST方法,对从德国HUS患者分离的非O157 STEC进行分型分析,发现 ST16、ST17、ST21、ST25型别的菌株,O抗原检测结果分别为O111、O103、O26、O128,推测这些ST型别及血清型的菌株可能与HUS密切相关。本次研究中发现有ST25型别的菌株,虽然我们分析的菌株O血清型和ST型别与他们的结果存在一定差异,但经系统发生分析发现,我们的菌株与国际流行株具有一定的亲缘关系,提示我国应同时加强对这类STEC菌株的检测和监测,掌握菌株的分布和变异规律,及时发现和甄别暴发,进而对于有效预防和控制这类疾病在我国的暴发和流行将具有重要的意义。
[1]Paton JC,Paton AW.Pathogenesis and diagnosis of Shiga toxinproducing Escherichia coli infections[J].Clin Microbiol Rev,1998,11(3):450-479.
[2]Johnson KE,Thorpe CM,Sears CL.The emerging clinical importance of non-O157Shiga toxin-producing Escherichia coli[J].Clin Infect Dis,2006,43(12):1587-1595.DOI:10.1086/509573
[3]Ethelberg S,Smith B,Torpdahl M,et al.Outbreak of non-O157Shiga toxin-producing Escherichia coli infection from consumption of beef sausage[J].Clin Infect Dis,2009,48(8):e78-81.DOI:10.1086/597502
[4]Mathusa EC,Chen Y,Enache E,et al.Non-O157Shiga toxinproducing Escherichia coli in foods[J].J Food Prot,2010,73(9):1721-1736.
[5]Käppeli U,Hächler H,Giezendanner N,et al.Human infections with non-O157Shiga toxin-producing Escherichia coli,Switzerland,2000-2009[J].Emerg Infect Dis,2011,17(2):180-185.DOI:10.3201/eid1702.100909
[6]Coombes BK,Wickham ME,Mascarenhas M,et al.Molecular analysis as an aid to assess the public health risk of non-O157 Shiga toxin-producing Escherichia coli strains[J].Appl Environ Microbiol,2008,74(7):2153-2160.DOI:10.1128/AEM.02566-07
[7]Fisher IS,Meakins S,Enter-net participants.Surveillance of enteric pathogens in Europe and beyond:Enter-net annual report for 2004[J].Euro Surveill,2006,11(8):E060824.3.
[8]European Centre for Disease Prevention and Control and European Food Safety Authority.Shiga toxin/verotoxin-producing Escherichia coli in humans,food and animals in the EU/EEA,with special reference to the German outbreak strain STEC O104[R].Stockholm:ECDC;2011.
[9]Brandal LT,Lindstedt BA,Aas L,et al.Octaplex PCR and fluorescence-based capillary electrophoresis for identification of human diarrheagenic Escherichia coli and Shigella spp[J].J Microbiol Methods,2007,68(2):331-341.DOI:10.1016/j.mimet.2006.09.013
[10]Feil EJ,Li BC,Aanensen DM,et al.eBURST:inferring patterns of evolutionary descent among clusters of related bacterial genotypes from multilocus sequence typing data[J].J Bacteriol,2004,186(5):1518-1530.DOI:10.1128/JB.186.5.1518-1530.2004
[11]Wang T,Liu LY,Wang P,et al.Virulent genes of Escherichia coli O157∶H7strains isolated from China[J].Chin J Zoonoses,2010,26(6):515-518.(in Chinese)王涛,刘丽云,王娉,等.我国分离的大肠埃希菌O157∶H7的毒力基因检测分析[J].中国人兽共患病学报,2010,26(6):515-518.
[12]Hedican EB,Medus C,Besser JM,et al.Characteristics of O157versus non-O157Shiga toxin-producing Escherichia coli infections in Minnesota,2000-2006[J].Clin Infect Dis,2009,49(3):358-364.DOI:10.1086/600302
[13]Aslani MM,Bouzari S.Characterization of virulence genes of non-O157Shiga toxin-producing Escherichia coli isolates from two provinces of Iran[J].Jpn J Infect Dis,2009,62(1):16-19.
[14]Maiden MC,Bygraves JA,Feil E,et al.Multilocus sequence typing:A portable approach to the identification of clones within populations of pathogenic microorganisms[J].Proc Natl Acad Sci U S A,1998,95(6):3140-3145.DOI:10.1073/pnas.95.6.3140
[15]Mellmann A,Bielaszewska M,Köck R,et al.Analysis of collection of hemolytic uremic syndrome-associated enterohemorrhagic Escherichia coli[J].Emerg Infect Dis,2008,14(8):1287-1290.DOI:10.3201/eid1408.071082
