杨树腐烂病内生拮抗细菌鉴定及防治研究
2012-01-22金海强贾斌李熙英
金海强,贾斌,李熙英
(延边大学教育部长白山生物资源与功能分子重点实验室,吉林延吉 133002)
杨树Populus spp.是我国北方地区速生丰产造林树种之一,具有防风固沙、水土保持,农田保护和维护生态平衡等作用。杨树腐烂病Cytospora chrysosperma等多种枝干病害经常发生,直接危害杨树生长。目前对杨树腐烂病的防治主要依靠物理、化学防治并结合抗病品种的选用等。化学农药见效快,防治效果好,但成本较高,易造成环境污染,病原菌易产生抗药性等[1]。以往杨树腐烂病的生物防治主要是筛选利用拮抗菌,但存在拮抗菌定植率差和防效不高、不稳定等问题[2-6]。近年来的研究结果表明,在健康的植物体中存在大量的内生拮抗细菌,它们是植物病害防治的潜在资源菌[7-8]。植物内生细菌长期生活于植物体内特殊环境并与植物协同进化,建立了和谐联合的关系。一方面植物为内生细菌提供了良好的栖息地,另一方面内生细菌又可通过自身代谢产物或借助于信号传导作用对植物产生影响,对寄主植物有促生、防病等多方面的生物学作用[9]。本研究从健康杨树枝条中分离筛选出对杨树腐烂病具有拮抗作用的内生细菌,为杨树腐烂病生物防治提供依据。
1 材料与方法
1.1 供试菌种 杨树腐烂病病原菌Cytospora chrysosperma来自延边大学农学院植物病理实验室。
1.2 内生细菌分离材料 分别于春季的3月中旬、夏季的7月中旬和秋季的10月中旬从吉林省延边地区的延吉、龙井、安图、和龙等地的杨树林(品种为大青杨)中采集杨树枝条,随机取样。树龄为5~7 a,枝条直径1 cm左右,长20 cm。
1.3 杨树内生细菌的分离及纯化 取不同地点采集到的杨树枝条,用70%的酒精表面清洗后,剪成0.5~1 cm的枝段,浸泡在70%乙醇中1 min,再用3.25%的NaOCl浸泡15 min,用无菌蒸馏水冲洗4次,放置在PDA平板上培养2 d。
从上述培养基平板里挑出没长出微生物菌落的(说明表面消毒彻底)杨树枝条段5g放入已灭菌的研钵中,加入45 mL无菌水,碾碎,搅拌5 min,静止15 min,按稀释法稀释后用10-3,10-4的稀释液涂抹于PDA和NA培养基平板上,放入25℃的恒温箱中培养。每处理重复5个培养皿。培养第5天,根据菌落形态、颜色、质地等调查微生物菌株数和每种微生物的菌落数,并对每种微生物进行纯培养以作为参试菌株。
1.4 室内拮抗菌的筛选 在PDA平板上培养7 d的杨树腐烂病菌菌落上,用打孔器打出直径5 mm的菌碟,放置于新的PDA平板中间,在距培养皿边缘10 mm处点接内生细菌菌株(2个点对称),设只接病原菌的为对照,置于25℃恒温箱中培养。每个处理重复5次。培养第5天测杨树腐烂病菌菌落宽度,并计算抑菌率。

1.5 拮抗菌发酵液的抑菌活性 选择在对峙培养中对杨树腐烂病菌具有较强抑菌活性的14种内生拮抗菌,用KB培养基活化培养3 d后,分别接种于200 mL KB液体培养基中,在28℃、120 r/min恒温双层摇床中振荡培养5 d。在经4 000 r/min离心25 min后,取上清液用直径0.22 μm微孔滤膜过滤后,用旋转蒸发仪浓缩至10 mL,即为拮抗菌发酵液。
抑菌活性测定采用纸片法。具体方法如下:先在PDA平板中间放置直径5 mm的杨树腐烂病菌的菌碟1片,在距离菌碟10 mm处放置滴150 μL拮抗菌发酵液的滤纸片2片(2片对称),以只放置杨树腐烂病菌菌碟的为对照,放入25℃恒温箱培养。每个处理重复5次。培养5 d后测杨树腐烂病菌菌落宽度,并计算抑菌率。
1.6 离体枝条防病试验 在PDA平板上培养7 d的杨树腐烂病菌菌落上,用打孔器打出直径5 mm的菌碟,备用。
将14种内生拮抗菌在KB培养基上活化培养3 d后,分别接入100 mL KB液体培养基中,在28℃、120 r/min恒温双层摇床中振荡培养5 d,备用。
将直径1.5~2.5 cm杨树枝条剪成段,每段长30 cm。用75%酒精表面消毒,在距两头5 cm处用消毒好的解剖刀划开“T”字形口,先滴内生拮抗菌培养液1 mL,然后接杨树腐烂病菌菌碟1片。用蘸无菌水的脱脂棉保湿,用胶布将其固定,枝条两头同样需用蘸水脱脂棉保湿。每一组有30个枝条。其中只接腐烂病病菌的枝条为对照。最后每种处理放在一个塑料袋中,在室温下(21℃左右)培养。40 d后调查发病率、病斑大小、病级及愈伤组织形成情况。杨树腐烂病病级调查标准参见文献[10]。

1.7 拮抗菌菌株的鉴定
1.7.1 拮抗菌形态及生理生化特性 将菌株Y-SY12接种在NA平板上,培养1 d后进行革兰氏染色,观察菌体形态和菌落特征。
1.7.2 16S rDNA基因序列及系统发育分析 以菌株Y-S-Y12 DNA为模板,利用16S rDNA通用引物对 27F-FOR(5′-GAGTTTGATCCTGGCTCAG-3)和1492R-REV(5′-TACGGTTACCTTGTTACGACTT-3′)为探针进行16S rDNA分析。PCR扩增反应条件为:94℃ 变性 5 min;94℃ 变性 40 s,55℃ 复性40 s,72℃延伸1 min,循环数为35。PCR 产物经琼脂糖凝胶电泳回收纯化后,将扩增得到的片段连接到pMD18-T载体上,并转化大肠杆菌Escherichia coli DH5α后测序。所得16S rDNA片段序列在NCBI GenBank上利用BLASTN模块进行BLAST,对16S rDNA序列进行同源性分析;根据BLAST结果,将与Y-S-Y12在16S rDNA序列上的同源性超过96.6%的前20个菌株的16S rDNA序列利用DNASATR软件构建系统发育树。
2 结果与分析
2.1 杨树内生细菌的分离 供试2种培养基上均能分离到内生细菌,其中PDA培养基上分离到的内生细菌菌株数多于NA培养基上;NA培养基上出现的内生细菌菌落数多于PDA培养基上。从不同时间段上分离到的内生细菌菌株数和菌落数量上看,春季分离到的最少,夏季分离到的最多,秋季分离到的比夏季少(见表1)。
采用平板稀释法,从大青杨杨树枝条中共分离纯化得到56株内生细菌菌株。

表1 不同季节杨树枝条中分离到的内生细菌菌株数与菌落数
2.2 对杨树腐烂病菌具有高效抑菌作用的内生拮抗菌筛选 分离到的56株内生细菌菌株与杨树腐烂病菌进行室内对峙培养,结果23株具有拮抗作用,其中14株内生拮抗菌菌株的抑菌率达到了60%以上(见表2)。Y-S-Y2,Y-S-Y12的抑菌率最高,达到了 100%;其次为 Y-S-Y3,抑菌率为92.68%;再次为Y-S-Y1,抑菌率为73.17%;其余的抑菌率均在60%~70%之间。

表2 杨树内生拮抗菌对杨树腐烂病菌的室内抑菌效果
2.3 拮抗菌发酵液对杨树腐烂病菌的抑菌活性供试14种内生拮抗菌菌株发酵液对杨树腐烂病菌均具有一定的抑菌活性,其中Y-S-Y12菌株发酵液的抑菌活性显著高于其它内生拮抗菌代谢产物的粗提取液的抑菌活性,其抑菌率为67.78%;其次Y-SY2,Y-S-Y8,Y-S-Y13,这三者之间没有显著性差异。另外,Y-S-Y7,Y-S-Y9,Y-S-Y10,Y-S-Y18,YS-Y20等5种也具有较高的抑菌活性,其抑菌率均为50%以上。详见表3。

表3 杨树内生拮抗菌发酵液对杨树腐烂病菌的抑菌活性
2.4 离体枝条防病试验 结果见表4。
从发病率上看,除Y-S-Y7处理的发病率与对照之间没有显著性差异外,其它各处理与对照之间均有显著性差异。其中以Y-S-Y12处理的发病率最低,为31.67%;其次为Y-S-Y2;再次为Y-S-Y13和Y-S-Y1。从防效上看,各处理均有一定的防治效果,其中Y-S-Y12处理的防效最高,为84.95%;其次为Y-S-Y2,防效为80.64%;再次为Y-S-Y1和YS-Y13,防效分别为73.11%和71.05%,之间没有显著性差异。这几种防效高的处理枝条愈伤组织形成情况也较好,其中Y-S-Y12和Y-S-Y2处理的愈伤组织形成率分别为66.2%和62.2%;Y-S-Y1和YS-Y13处理的愈伤组织形成率分别为50.3%和52.4%。这说明,防病效果较高的内生拮抗细菌对杨树枝条形成愈伤组织也有促进作用。
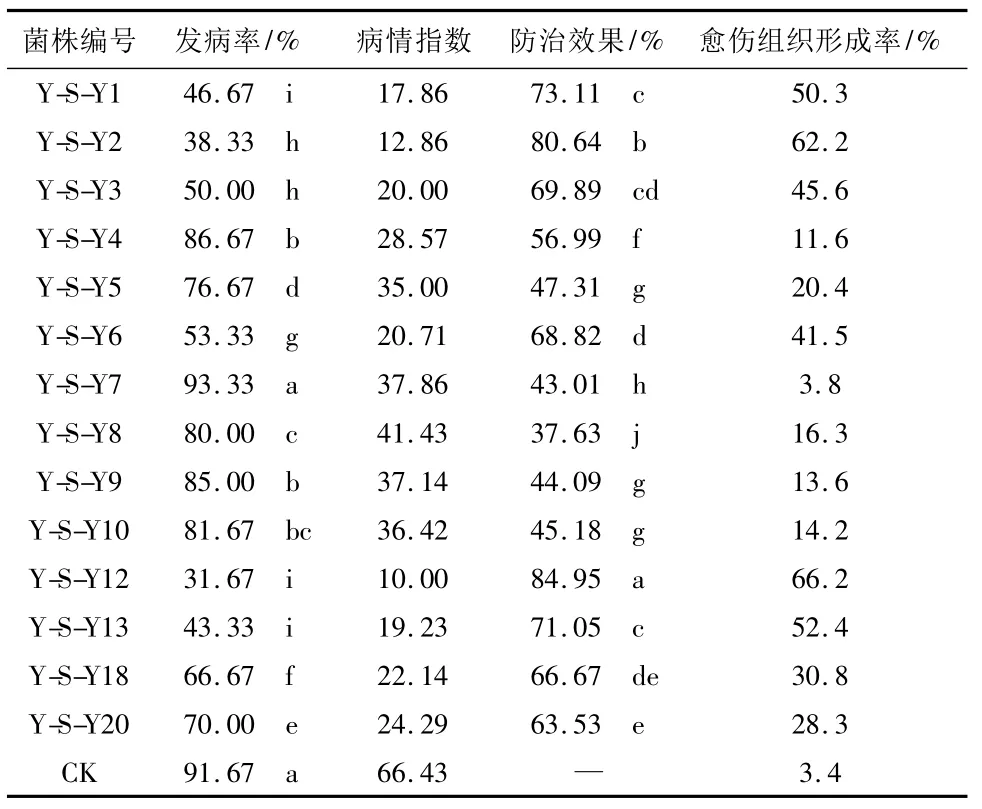
表4 离体枝条上内生拮抗菌对杨树腐烂病的防病效果
2.5 拮抗菌的鉴定
2.5.1 拮抗菌形态及培养特征 在室内抑菌试验和杨树枝条防病试验中表现突出的Y-S-Y12菌株的形态特征和培养特征:在NA平板上菌落表面粗糙不透明,有褶皱,乳白色至淡黄色。光学显微镜下观察细胞呈短杆状,大小为(0.6~0.7)μm×(2.0~2.5)μm,产芽孢,革兰氏染色阳性。
2.5.2 16S rDNA序列及系统发育分析 在NCBI Genbank上进行的16S rDNA序列分析的结果表明,本研究中所分离的Y-S-Y12菌株属于芽孢杆菌属Bacillus;与Y-S-Y12菌株16S rDNA序列(Gen-Bank登录号为JX094152)同源性超过99.5%的菌株有 136个。其中,解淀粉芽孢杆菌 Bacillus amyloli-quefaciens菌株 SWM1的16S rDNA序列(GenBank登录号为JN851189)与Y-S-Y12菌株的同源性最高,达99.8%(见图1、表4),其BLAST得分(Max Score)为2778,E-value为0;这两个菌株的16S rDNA序列的目标序列1 513 bp中仅有3个碱基存在差异。虽然Y-S-Y12与芽孢杆菌属的其他菌株B.subtilis(菌株Aj080718IA-2)及 GJ24在16S rDNA序列上同源性也达到了99.7%,但在菌落特性上存在不同。结合形态学及培养特征,菌株Y-SY12初步鉴定为解淀粉芽孢杆菌Bacillus amyloliquefaciens。

图1 拮抗菌株Y-S-Y12与相关菌株16S rDNA序列的系统发育树

表4 Y-S-Y12与芽孢杆菌属20个菌(株)的16S rDNA序列一致性Percent ldentity
3 结论及讨论
本试验中,在各地采集到的杨树枝条中分离纯化得到56株内生细菌。与杨树腐烂病菌进行室内对峙培养中,结果23株具有拮抗作用,其中14株内生拮抗菌的抑菌率60%以上。
通过室内对峙培养、检测内生拮抗细菌发酵液对杨树腐烂病菌的抑菌作用以及室内离体枝条防病试验,杨树内生拮抗细菌Y-S-Y12菌株对杨树腐烂病的抑菌防病作用最显著,其次为Y-S-Y2菌株。对Y-S-Y12菌株采用16S rDNA的序列分析方法进行鉴定,结果为解淀粉芽孢杆菌。
解淀粉芽孢杆菌能产生脂肽类抗生素、聚酮类抗生素以及抗菌蛋白等多种抗菌物质,这些代谢产物具有广泛抑制植物病原真菌[11-12]和植物病原细菌[13-14]的活性,但还没发现有关抑制杨树腐烂病菌的报道。本试验中分离到的解淀粉芽孢杆菌在室内条件下对杨树腐烂病有明显的防病作用,但在田间的防效如何、对杨树生长有没有促进作用,对其他病害有没有防病作用、如何开发生物农药以及使用方法等有待于进一步研究。
[1] 王光亮,于金友,石玉萍,等.植物病害生物防治研究进展[J].山东农业科学,2004(4):75-77.
[2] 项存悌,高克祥,何秉章,等.杨树烂皮病生物防治的研究[J].东北林业大学学报,1999,19(6):15-25.
[3] 孙冬梅,杨谦,宋金柱.黄绿木霉菌代谢产物对杨树烂皮病菌抑菌能力的研究[J].北京林业大学学报,2006,28(1):76-79.
[4] 原彝辑,曹支敏.杨树腐烂病生防放线菌筛选及其活性产物研究[J].林业科学研究,2006,19(6):139-144.
[5] 任嘉红,王艳芳,叶建仁.杨树腐烂病拮抗细菌的筛选及其定殖研究[J].西部林业科学,2009,38(2):6-11.
[6] 袁秀英,白红霞,白玉明,等.杨树内生真菌的分离与拮抗生防菌的筛选[J]西北农林科技大学学报:自然科学版,2007,35(4):713-717.
[7] 鲍敏,康明浩.植物内生细菌研究发展现状[J].青海草业,2011,20(1):21-25.
[8] 林玲,乔勇升,顾本康,等.植物内生细菌及其生物防治植物病害的研究进展[J].江苏农业学报,2008,24(6):969-974
[9] 史应武,娄恺,李春.植物内生细菌在生物防治中的应用[J].微生物学杂志,2011,29(6):61-66.
[10] 宋瑞清,冀瑞卿.四种毒蘑菇菌株及其毒素对杨树烂皮病菌生长的抑制作用[J].北京林业大学学报,2005,27(2):88-91.
[11] 陈士云,杨宝玉,高梅影.一株抑制油菜核盘菌菌核形成的解淀粉芽孢杆菌[J].应用与环境生物学报,2005,11(3):373-376.
[12] 权春善,王军华,徐洪涛,等.一株抗真菌解淀粉芽孢杆菌的分离鉴定及其发酵条件的初步研究[J].微生物学报,2006,46(6):7-12.
[13] 张荣胜,刘永锋,陈志谊.水稻细菌性条斑病菌拮抗细菌的筛选、评价与应用研究[J].中国生物防治学报,2011,27(4):510-514.
[14] 王小兵,骆永明,刘五星.花生青枯病内生拮抗细菌的鉴定、抗菌活性及其田间防效[J].中国生物防治学报,2011,27(1):88-92.
