二氢杨梅素对顺铂肾损伤的保护作用
2012-01-16田梦洋郭援丽周防震
田梦洋,郭援丽,周防震
1.湖北民族学院生物科学与技术学院 (湖北 恩施 445000)2.湖北民族学院附属民大医院检验科(湖北 恩施 445000)
顺铂(Cisplatin,CIS)是一种具有抗癌活性的金属配合物,是临床常用的化疗药物之一,具有抗癌谱广、作用显著、与多种抗肿瘤药有协同作用且无交叉耐药等特点[1],但同时也有一定的不良反应,如骨髓抑制、肾脏毒性、神经毒性、过敏反应、电解质紊乱等。其中肾脏毒性是最常见且比较严重的毒性反应,也是剂量限制毒性[2],重复用药可加剧肾毒性。二氢杨梅素(Dihydromyricetin,DMY)化学名为3,5,7,3′,4′,5′-六羟基-2,3-双氢黄酮醇,是从蛇葡萄属植物藤茶(Ampelopsis grossedentata)中提取[3]的黄酮类化合物,具有清除自由基[4]、抗氧化[5,6]、保肝护肝[7,8]、抗肿瘤[9]等多种生理药理功效。文献报道,DMY对痤疮丙酸杆菌和脂多糖诱发昆明小鼠(小鼠)肝损伤具有保护作用[10],但未见DMY对肾脏保护作用的报道。在我们前期的研究中发现,DMY在离体条件下对CIS引起的人胚肾293细胞损伤具有一定的保护作用(数据待发表)。本实验研究探讨DMY对CIS诱导小鼠肾损伤的保护作用,以期为DMY的开发和应用奠定基础。
1 材料与方法
1.1试剂和仪器顺铂(齐鲁制药,批准文号:国药准字H37021357,产品批号:102004CE);DMY为华南理工大学工业研究总院张晓元副教授按文献报道方法[11]从藤茶茎叶中提取和纯化制得,并惠赠提供,纯度96.5%(HPLC);丙二醛(MDA)测定试剂盒(南京建成生物工程研究所);二辛可酸(Bicinchoninic acid,BCA)蛋白浓度测定试剂盒(增强型)(碧云天生物技术研究所)、酶标仪(美国BioRad公司)。
1.2实验动物健康小鼠40只,雌雄各半,体重为20~25 g,购买于湖北省实验动物中心。实验前适应性驯养1周,实验期间自由采食饮水。
1.3 方法
1.3.1 药物配制 利用超纯水配制生理盐水;称取1 g羧甲基纤维素钠溶于100 mL生理盐水中,配制成1%羧甲基纤维素钠溶液;配制2 mg/mL的顺铂母液,每次配药取1 mL母液加入9 mL生理盐水,配成0.2 mg/mL顺铂工作液;利用1%羧甲基纤维素钠溶液配制10 mg/mL DMY试剂。
1.3.2 动物分组及处理 将小鼠随机分成4组,每组10只,生理盐水对照组(CK组)、100 mg/kg·d-1DMY组(DMY组)、2 mg/kg·d-1顺铂组(CIS组)、2 mg/kg·d-1顺铂+100 mg/kg·d-1DMY组(联合组)。生理盐水、DMY采用灌胃给药的方式,每天固定时间给药,连续给药23 d。CIS采用腹腔注射,给药2 d,停药1 d为一个周期。
1.4 检测指标
1.4.1 体重及肾脏系数的测定 按文献[12]每天喂食前称量昆明小鼠体重并记录,实验第24 d摘除昆明小鼠眼球采血于干燥无菌离心管中待用。解剖取出昆明小鼠肾脏,用生理盐水漂洗,称重,计算昆明小鼠肾脏指数。
1.4.2 血清BUN与CRE水平测定 将小鼠眼球摘除采集的血液,室温静置2 h,3000 r/min离心10 min,小心收集血清,送至湖北民族学院附属民大医院血液检验科检测血清BUN与CRE水平。
1.4.3 肾脏组织MDA含量测定 解剖小鼠迅速取得肾脏,用生理盐水漂洗,用玻璃匀浆器制成10%组织匀浆。按说明书操作规程,利用BCA蛋白浓度测定试剂盒测定样品总蛋白质浓度;用MDA测定试剂盒测定并计算样品MDA含量。
1.5数据处理统计学分析采用SPSS 11.0软件,计量资料以平均值±标准差表示,进行单因素方差分析,组间比较采取最小显著差法(LSD)方法,以P<0.05作为显著性差异标准。并用Origin8.0软件作图。
2 结果
2.1小鼠体重变化从图1可以看出,CK组小鼠体重总体呈现上升趋势;DMY组小鼠体重前期与CK组无明显差异,后期有明显下降;CIS组与联合组体重呈下降趋势,与CK组和DMY组比较有显著差异;联合组小鼠体重前期与CIS组无明显差异,后期明显增加。

图1 各组小鼠体重的变化
2.2 DMY对肾脏指数(KI)的影响与CK组相比,DMY组KI无明显差异(P=0.16),CIS组与联合组KI明显降低(P<0.05);联合组KI较CIS组有一定增加(见图2)。

图2 各组小鼠肾脏指数
2.3 DMY对血清BUN与CRE的影响从图3、图4可以看出,与CK组相比,DMY组BUN、CRE水平无明显差异(P=0.10、P=0.18);CIS组与联合组均显著高于CK组(P<0.01)。而联合组BUN、CRE水平明显低于CIS组(P<0.05)。
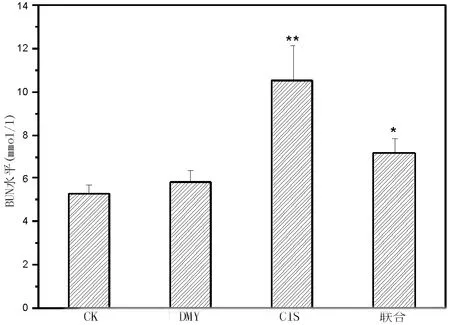
图3 各组小鼠血清BUN水平
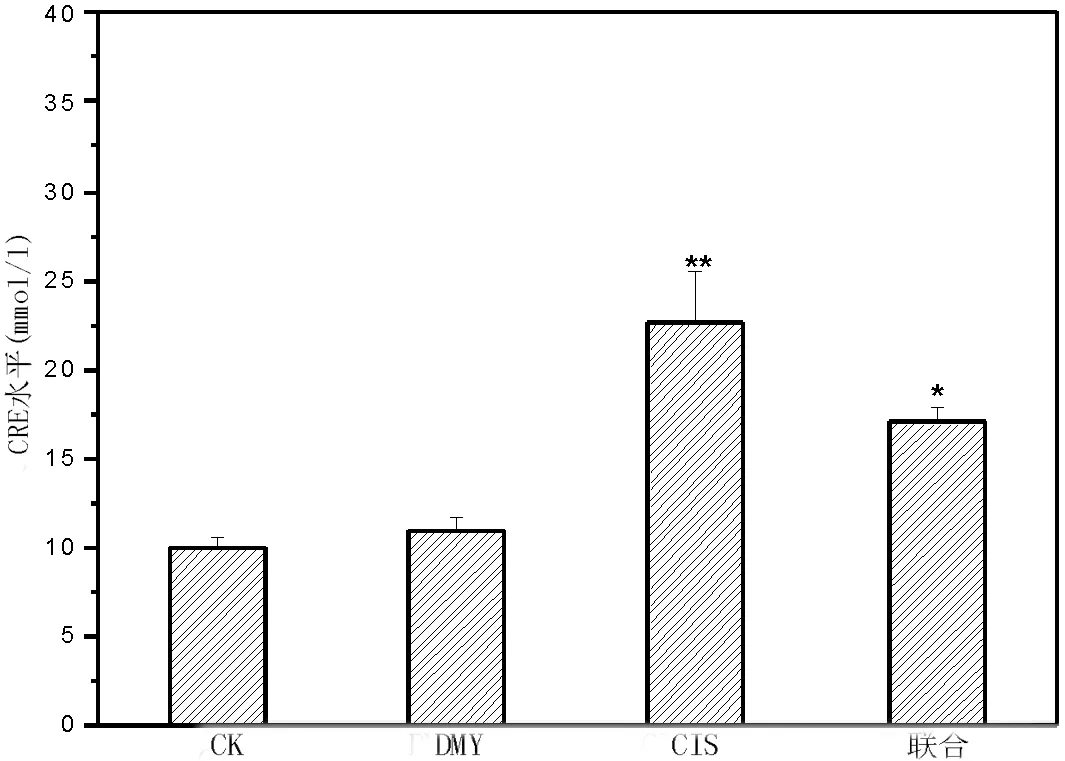
图4 各实组小鼠血清CRE水平
2.4对DMY组肾组织MDA含量的影响与CK组相比,DMY组肾脏组织中MDA含量无明显差异(P=0.06);CIS组和联合组显著大于CK组(P<0.01);联合组肾脏组织中MDA含量明显低于CIS组(P<0.01)。见图5。
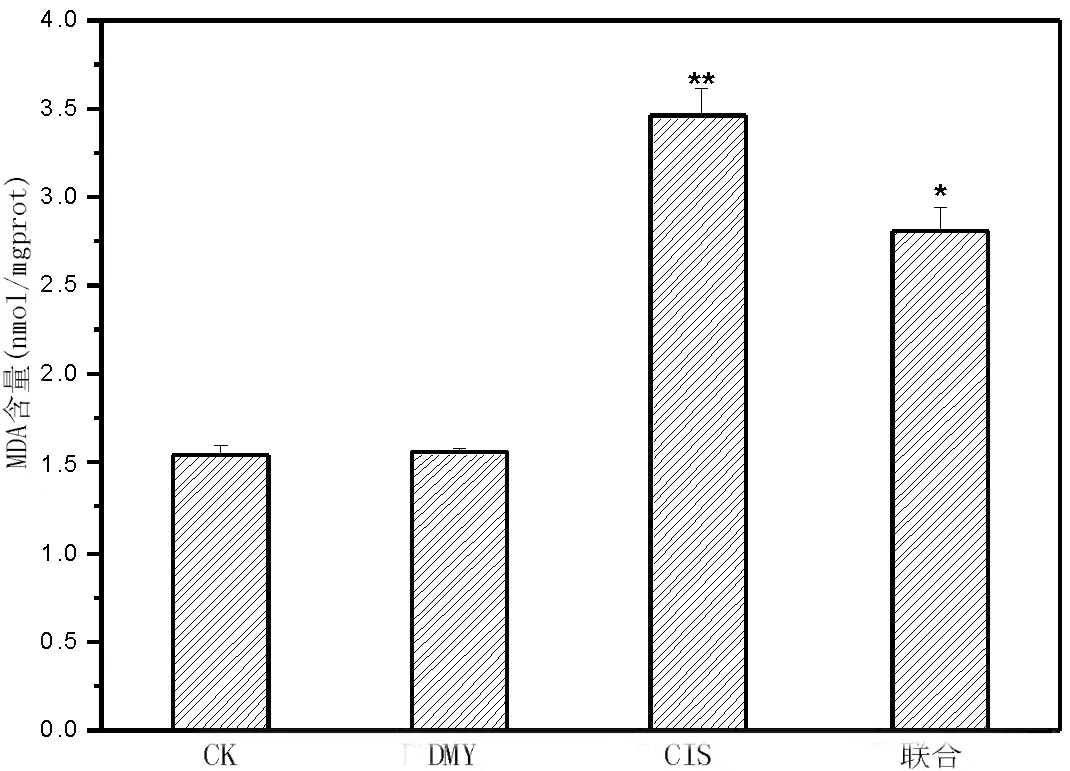
图5 各组小鼠肾脏组织中MDA含量
3 讨论
血清中BUN和CRE水平是反应肾损伤的重要指标[13],实验结果显示DMY与CIS联合给药组小鼠血清中BUN、CRE水平显著低于CIS给药组;联合给药组小鼠体重前期与CIS组无明显差异,后期明显增加;联合给药组KI较CIS组有一定增加。表明DMY能减轻CIS引起的肾毒性,对小鼠的肾损伤具有一定的保护作用。
机体过量产生活性氧被认为是化疗药物毒副作用的根源[14~16],研究表明顺铂使小鼠肾还原型谷胱甘肽(GSH)含量及谷胱甘肽过氧化物酶(GSH-Px)活性升高,表明顺铂引起肾组织的抗氧化系统处于应激性代偿状态[12]。顺铂可导致线粒体损伤,使细胞氧化呼吸链电子传递链发生障碍,自由基生成增多[17];MDA是脂质过氧化物的最终产物,可间接地反映出细胞损伤的程度[18,19]。有文献显示联合化疗药物和具有抗氧化活性的化学预防试剂可以增加化疗试剂的抗肿瘤作用,降低化疗药物诱导的毒副作用[20],在对拘束负荷引起小鼠肝损伤的研究中,维生素C和谷胱甘肽(GSH)作为小鼠机体的内源性抗氧化物质发挥清除自由基、减少自由基介导的细胞损害作用,并且发现拘束负荷小鼠肝组织中的维生素C和GSH因应激反应而减少、氧化自由基吸收能力值(ORAC)也相应下降,表明小鼠体内呈现氧化应激状态。当用藤茶总黄酮处理小鼠后,明显提高了肝组织匀浆中的维生素C、GSH及ORAC水平,缓解了因拘束负荷引起的氧化应激状态,增强了机体的抗应激能力,从而减少应激性肝损伤的发生[21]。DMY是一种含有6-酚羟基的黄酮类化合物,有较强的清除羟自由基和超氧阴离子的能力,表现出与维生素C相类似的抗氧化[22-24]效果。本实验发现DMY与CIS联合给药组小鼠肾脏组织中MDA含量明显低于CIS给药组,结果表明DMY能减轻CIS肾损伤的机制可能与其抗氧化作用有关。DMY对小鼠CIS肾损伤的保护作用,为其临床应用提供了新的理论依据。
[1] 陶站华,姚辉璐,王桂文,等.利用拉曼光谱分析顺铂诱导的胃癌细胞凋亡[J].光谱学与光谱分析,2009,29(9):2442-2445.
[2] 李革新,姚书杰,陆春伟,等.顺铂肾毒性的实验研究[J].中国工业医学杂志,2004,17(3):186-187.
[3] 周天达,周雪仙.藤茶中双氢黄酮醇的分离、结构鉴定及其药理活性[J].中国药学杂志,1996,31(8):458-460.
[4] 徐静娟,姚茂君,许刚.二氢杨梅素抗氧化功能的研究[J].食品科学,2007,28(9):43-45.
[5] 邝满元,罗明英,贾蕾.二氢杨梅素对肝纤维化大鼠脂质过氧化损伤的保护作用[J].中国医药导报,2009,6(18):26-28.
[6] 何桂霞,杨伟丽,裴刚,等.二氢杨梅素抗脂质过氧化作用的研究[J].中国中药杂志,2003,28(12):1188-1190.
[7] 郑作文,曾春晖,林英辉.广西藤茶中双氢杨梅树皮素对小鼠急性肝损伤的保护作用[J].广西中医学院学报,2002,25(3):10-11.
[8] 钟正贤,覃洁萍,周桂芳,等.广西瑶族藤茶中双氢杨梅树皮素的药理研究[J].中国民族医药杂志,1998,4(3):42-43.
[9] 周防震,黄敏,张晓元,等.二氢杨梅素对乳腺癌荷瘤小鼠化疗的增效减毒作用[J].华南理工大学学报(自然科学版),2011,39(9):147-151.
[10] 梁婷,吴春福,吕艳青,等.二氢杨梅素对痤疮丙酸杆菌和脂多糖诱发小鼠肝损伤的保护作用及对中性粒细胞释放白三烯的影响[J].中草药,2008,39(1):83-87.
[11] 张友胜,林淑英,宁正祥.高速逆流色谱纯化二氢杨梅素[J].天然产物研究与开发,2003,15(5):426-428.
[12] 廖英俊,金亚平,汤浩.多种药物联合应用对小鼠顺铂肾毒性的拮抗作用[J].中国药理学与毒理学杂志,2009,23(3):219-224.
[13] 董书清.血清肌酐-尿素氮的检测值及其比值与肾脏损害的探讨[J].中国医药指南,2011,12(9):136-137.
[14] Sarkar F H,Li Y.Using chemopreventive agents to enhance the efficacy of cancer therapy[J]. Cancer Res,2006, 66(7):3347-3350.
[15] Wessner B,Strasser E M,Koitz N,et al.Green tea polyphenol administration partly ameliorates chemotherapy-induced side effects in the small intestine of mice[J].J Nutr,2007,137(3):634-640.
[16] Baek S M,Kwon C H,Kim J H,et al.Differential roles of hydrogen peroxide and hydroxyl radical in cisplatin-induced cell death in renal proximal tubular epithelial cells[J]. J Lab Clin Med,2003,142(3):178-186.
[17] 罗明,劳山.顺铂肾损伤机制的研究及进展[J].蛇志,2008,20(2):135-138.
[18] 邓勇,黄珀,陈同良,等.肾小管细胞氧化性损伤模型的建立[J].现代泌尿外科杂志,2004,9(3):144-146.
[19] 王有根.原发性高血压合并2型糖尿病患者血清MDA和红细胞中SOD测定的意义[J].检验医学,2011,26(4):227-230.
[20] Baliga R,Ueda N,Walker P D,et al.Oxidant mechanisms in toxic acute renal failure[J].Drug Metab Rev,1999, 31(4): 971-977.
[21] 郑洁静,续洁琨,江涛,等.藤茶总黄酮对拘束负荷引起小鼠肝损伤的保护作用[J].中国药理学通报,2006,22(10):1249-1253.
[22] 张志坚,张晓元,李国林,等.二氢杨梅素对细胞等氧化伤害时的保护作用[J].湖南师范大学自然科学学报,2007,30(2):99-102.
[23] 张志坚,张晓元.二氢杨梅素在食品中的抗氧化作用研究与应用[J].湖南城市学院学报(自然科学版),2008,17(1):49-52.
[24] 周防震,张晓元,郭勇.二氢杨梅素联合阿霉素抗乳腺癌的MDA-MB-231细胞增殖的影响[J].湖北民族学院学报(医学版),2010,27(4):46-48.
