臭氧灭活水中铜绿微囊藻影响因素研究
2012-01-13汪小雄姜成春谢炜平深圳职业技术学院建筑与环境工程学院广东深圳518055
汪小雄,姜成春,朱 佳,谢炜平 (深圳职业技术学院建筑与环境工程学院,广东 深圳 518055)
世界上淡水湖泊藻类水华发生的频率与严重程度都呈现增长的趋势,其中蓝藻是引起藻类水华污染的主要藻类[1].水体中藻类的大量繁殖不仅使水体水质状况恶化,而且对饮用水的处理和安全也带来影响,威胁饮用水的安全性:某些藻类释放藻毒素引起人畜患病甚至死亡[2-3],藻细胞及它的胞外分泌物在氯化过程中产生三卤甲烷、卤乙酸、卤乙氰等物质[4-7];具有鞭毛的藻细胞易穿透絮凝体,从而破坏絮凝过程,导致出水存在藻细胞;藻细胞在滤床中的生长又会导致滤床产生堵塞.以上问题的存在,说明饮用水处理中不能忽视藻类的影响.一直以来,国内水处理预氧化一直以预氯化为主,预氯化对藻类等微生物灭活、助凝提高藻类及水体颗粒物去除虽有较好的效果[8-9],但氯氧化或消毒产生的消毒副产物引起国内外饮用水处理界的高度重视.臭氧作为氯预氧化的良好替代品,臭氧氧化和强化混凝被认为是控制消毒副产物的最佳可行性技术[9-12].
以往的各种研究,通常使用藻细胞密度、光密度、叶绿素含量来衡量除藻率,实际工作中这些细胞早已经失去活性,继续臭氧催化氧化一方面降低臭氧的传质效果,造成很大的浪费,另一方面影响了除藻效率.本研究使用臭氧对水中铜绿微囊藻进行灭活,采用中性红染色方法检测细胞活性,探讨藻细胞初始浓度、臭氧投加浓度、灭活时间、浑浊度、温度、pH值等因素的影响、以及臭氧灭活后藻细胞繁殖能力比较,找出臭氧灭活水中铜绿微囊藻合适工艺条件,为使用臭氧灭活藻类提供实验依据.
1 材料与方法
1.1 实验材料
试验中使用的铜绿微囊藻(Microcystis aeruginosa),购自中科院武汉水生生物研究所.藻体为小囊泡状, 是淡水湖泊和河流中常见的藻种.采用BG-11培养基在5L白细口瓶中进行培养.培养温度在(26.5±0.5)℃,光照强度为 2000μE/ (m2×s),光暗比12h:12h.
1.2 方法及设备
1.2.1 试剂 中性红:Amresco 美国.
1.2.2 仪器设备 臭氧发生器为 TOG-C2型(Ozonia Triogen in Glasgow, Scotland);荧光显微镜:奥林巴斯BX51(奥林巴斯);浊度计:HACH浊度测定仪; pH计:德国WTW-inoLab pH 730 型;低温恒温水浴槽:宁波天恒DL-1510.
1.2.3 中性红染色 称取 0.5g中性红粉末溶于50mLRinger溶液中,配成1%中性红溶液.使用时用 Ringer溶液将 1%中性红溶液稀释至0.02%.
取藻样1mL,离心,加入1mL中性红溶液,摇匀,染色 15min时间后,用显微镜(Olympus, BX51TF)进行观测,显微摄影系统拍摄染色情况并计数.细胞被中性红染色后,不仅说明细胞已经死亡,而且也说明细胞的细胞膜或细胞壁已被破坏.每个样品记数 20个视野,死亡细胞会被中性红染成红色,灭活率为染色细胞占总细胞数的百分比.
1.3 细胞计数
藻细胞密度采用 0.1mL浮游植物计数板进行计数,计算公式为:
公式中:N为每升水样中藻细胞的个数;A为计数框面积,mm2;B为一个视野的面积,mm2;C为计数时的视野数,个;D为1L水浓缩后体积,mL;E为计数框的容积,mL;F为每片所测藻类数.
1.4 实验方法
臭氧通入1L的平底烧瓶中,其中含500mL超纯水溶液,向反应器中通入O3/O2混合气体,一定时间后,停止曝气,臭氧浓度用靛蓝比色法测定[13].将培养至对数增长期(细胞密度约为1.0×107个/L)的藻细胞悬液 1.0mL离心,去培养基.向离心管中投加不同浓度的臭氧溶液1.0mL,细胞密度约为1.0×107个/L,温度25℃, pH7.5,使用高岭土配制原液,控制浑浊度为 1.0NTU,达到反应时间立即用0.1mol/L的Na2S2O3溶液终止臭氧化反应,所有实验均重复3次.
藻类活性测试法参照文献[14],用于比较不同浓度臭氧处理藻后其繁殖能力,方法如下:取不同浓度臭氧处理后的藻样,进行常规显微镜计数,得到C1;取1mL处理后水样置于培养液中,摇床培养 7d后并进行显微镜计数,得 C2;比值P=C2/C1表示原来水样中藻类的活性,P值越高,藻类活性/繁殖能力越强.
2 结果与分析
2.1 臭氧投量对铜绿微囊藻活性的影响
取离心管若干,加入 1.0×107个/L藻细胞悬浮液1.0mL,离心去培养基,分别加入初始浓度为0,0.5,1.0,2.0,3.0mg/L的臭氧缓冲溶液,保持温度25℃,pH7.5,浊度为 1.0NTU,不同时间点取样,每个样品记数20个视野,死亡细胞会被中性红染成红色,灭活率为染色细胞占总细胞数的百分比,结果见图1.
从图1中可以看出,臭氧浓度和臭氧的作用时间对灭活铜绿微囊藻效果显著.在低浓度(0.5 mg/L)的臭氧作用条件下,作用时间即使延长(40min),灭活率为78.5%;在高浓度(3.0mg/L)作用条件下,如灭活时间 5min以内,灭活仅为30%~50%,但作用时间延长,达到 10min以上时,灭活率可以从 95.5%~99.8%以上.根据水厂臭氧使用浓度为2.0mg/L以下,本实验表明,其作用时间为 40min,灭活率 99.0%,可以达到藻灭活的效果.从图 2还可以看出,在各种臭氧浓度处理下,灭活率上升最快基本在前十分钟左右,随着时间的进行,灭活率增加幅度不大,其原因可能与臭氧的半衰期较短有关,随着时间的延长,臭氧逐渐得到分解而失去氧化能力[15].另外,对照样的藻细胞活性也在逐步降低,说明藻细胞脱离所生长的培养基后,在超纯水的藻液中,细胞活性受到了一定程度的影响.
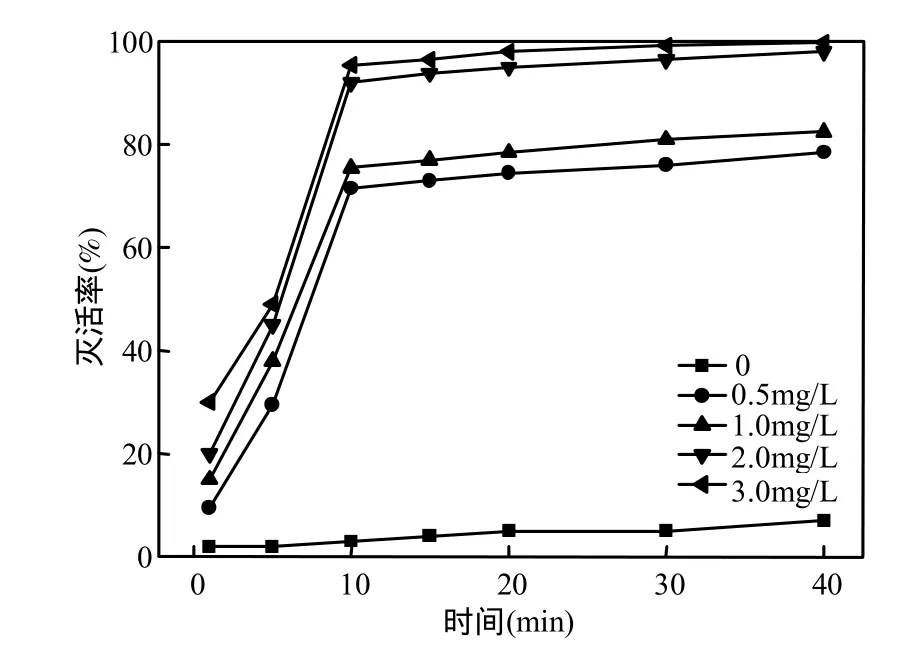
图1 臭氧投量对微囊藻活性的影响Fig.1 Effect of ozone inactivating Microsystis aeruginosa by different concentrations
2.2 初始藻细胞密度对臭氧灭活微囊藻活性的影响
一般认为水体中藻的细胞密度达到107个/L时,暴发时局部区域细胞密度可高达108~109个/L.在电氧化杀藻过程中,藻样初始浓度对电氧化杀藻影响较大,当藻细胞密度接近水华阈值,即为107个/L时,采用天然水作为电解液,只需1min就可以完全灭活藻细胞.为了解初始藻样细胞密度对臭氧灭活藻效果的影响,将1.0×107~5.0×109个/L的7个藻样配置于超纯水中,臭氧浓度为0.5、1.0、2.0mg/L,氧化时间为 40min,反应体系在25℃,pH值为7.5,浊度为1.0NTU,测定灭活率.结果如图2所示.由图2可见,初始藻细胞密度升高后,臭氧氧化杀藻效果急剧下降.当初始细胞密度为1.0×107个/L时,臭氧浓度为0.5~2.0mg/L,灭活率由 77.5%上升到 98.0%,绝大部分藻细胞已被灭活;初始藻细胞密度升高到 5.0×109个/L,臭氧浓度为0.5mg/L时,灭活率由52.5%,即使在臭氧浓度为 2.0mg/L,作用时间为 40min,灭活率也仅为63.0%时,杀藻效果明显降低.实验结果表明,初始藻细胞密度对臭氧氧化杀藻影响较大,当水中藻细胞密度处于 5.0×108个/L以内时,臭氧浓度为2.0mg/L时,藻灭活率为80.0%以上,臭氧杀藻效果明显.

图2 初始藻细胞密度对臭氧灭活微囊藻活性的影响Fig.2 Effect of initial cell density inactivating Microsystis aeruginosa by ozone
2.3 浑浊度对微囊藻灭活率的影响
在25℃, pH7.5,臭氧浓度为0.5,1.0,2.0mg/L,氧化时间为 40min,高岭土配制原液,反应体系浊度为 0.5,1.0,2.0,5.0,10.0,20.0NTU,藻细胞悬浮液密度为 1.0×107个/L,检测铜绿微囊藻灭活率,结果见图3.
由图3可见,当臭氧浓度为0.5mg/L,藻的灭活率随浊度的增加而降低 9.5%~62%,增大臭氧浓度,藻的灭活效果逐渐增强,臭氧浓度为2.0mg/L时,浊度(0.5~20.0NTU)范围内,灭活率为87%~98.5%,在浊度为5NTU以内时,灭活率为 94%以上,可以达到灭活标准,但浊度为 20.0 NTU时,灭活率降为 87%.原因可能是水体中的悬浮物对藻有一定的吸附,从而影响了对微囊藻灭活能力,实际生产中,臭氧浓度为 2.0mg/L可以灭活铜绿微囊藻.研究表明,天然水中的各种悬浮物及胶体物质,导致了水体浊度的改变,因此影响水体中一些微生物的去除[16-18],本研究与以往的结果一致.
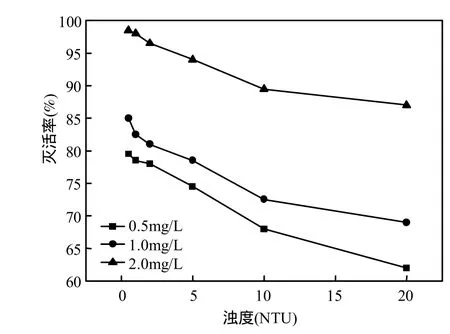
图3 浊度对微囊藻灭活效果的影响Fig.3 Effects of turbidity inactivating Microsystis aeruginosa
2.4 温度对微囊藻灭活率的影响
在藻细胞悬浮液密度为1.0×107个/L,反应体系为pH 7.5,浊度为1.0NTU,臭氧浓度为0.5,1.0, 2.0mg/L,氧化时间为 40min,反应温度为 5,15, 25,30,35℃,检测藻藻细胞灭活率.结果见图 4,当臭氧浓度为2.0mg/L时,可以达到灭活效果,灭活率达到 92.0%以上,最高可以达到 98.0%.适当降低臭氧浓度 0.5mg/L,探究温度对臭氧灭活微囊藻的影响.在温度为5℃时,灭活率仅为59.5%,但当温度升至 25℃,灭活率增强,且达到 78.5%,但温度的上升至 35℃后,臭氧灭活能力减弱,灭活率为71.5%,臭氧在3种浓度情况下规律基本相同.其原因可能是,在低温时候,藻细胞活性低,或处于休眠状态;温度升高时,臭氧的溶解度受到影响,温度越高,臭氧越易分解,削弱了臭氧的灭活能力.
2.5 pH值对微囊藻灭活率的影响
在藻细胞悬浮液密度为1.0×107个/L,浊度为1.0NTU,臭氧浓度为0.5、1.0、2.0mg/L,分别设置反应体系的pH值为6.0、7.0、7.5、8.0和9.0,检测微囊藻灭活率,结果见图5.从图5可知,随着pH值的增加,藻的活性随着降低,灭活率升高(浓度为2.0mg/L,灭活率由90.5%升至99.0% ).饮用水pH值一般在6~9之间,在此范围内,臭氧浓度大于或等于2.0mg/L时,作用时间为40min,灭活率可以达到90.5%以上.
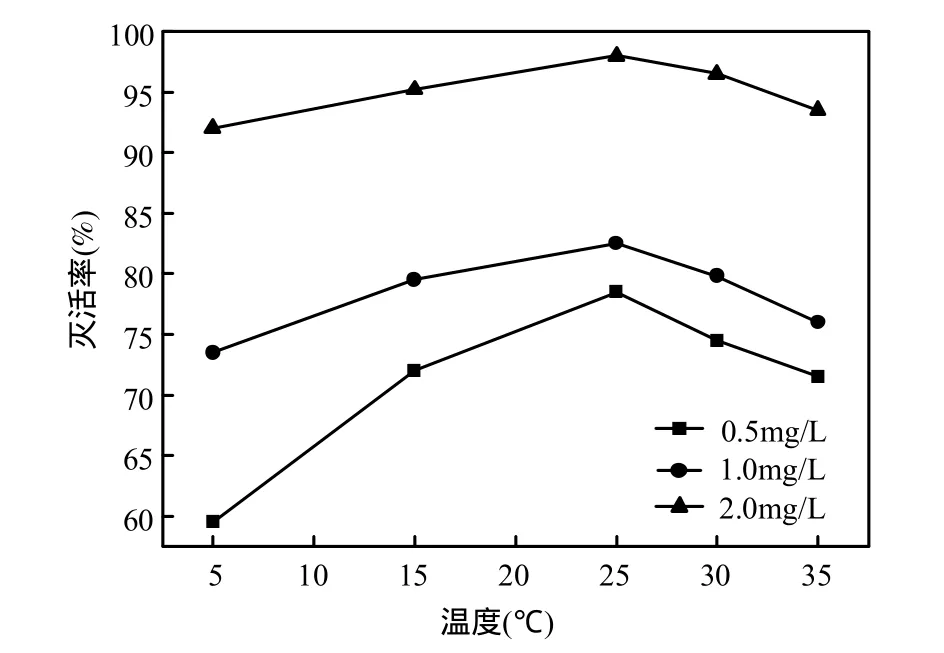
图4 不同温度下微囊藻灭活率的比较Fig.4 Effects of temperature inactivating Microsystis aeruginosa
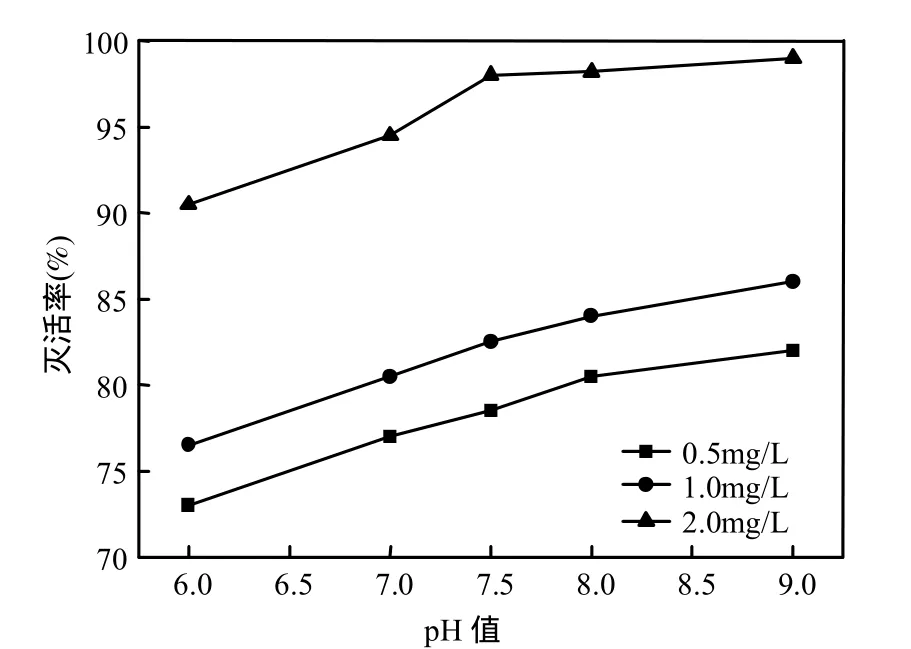
图5 不同pH值下微囊藻灭活率的比较Fig.5 Effects of pH inactivating Microsystis aeruginosa
臭氧在水中发生下列反应:O3→O+O2, O+H2O→2·OH.产生的·OH具有比O3更强的氧化能力,电位高,反应能力强,速度快.pH值对微囊藻的灭活具有一定的作用,酸性条件下灭活能力弱于碱性条件,在pH值为6~9范围,随着pH值增加,OH-是O3分解链反应的引发[19],O2-和HO2-是O3分解链的中间产物,这就是OH-能启动O3分解链反应产生×OH的原因.pH值升高,意味着 OH-浓度增加,有利于 O3分解链反应的发生,生成更的×OH,从而提高了臭氧灭活铜绿微囊藻能力.
2.6 不同臭氧浓度氧化后对藻类繁殖能力的影响
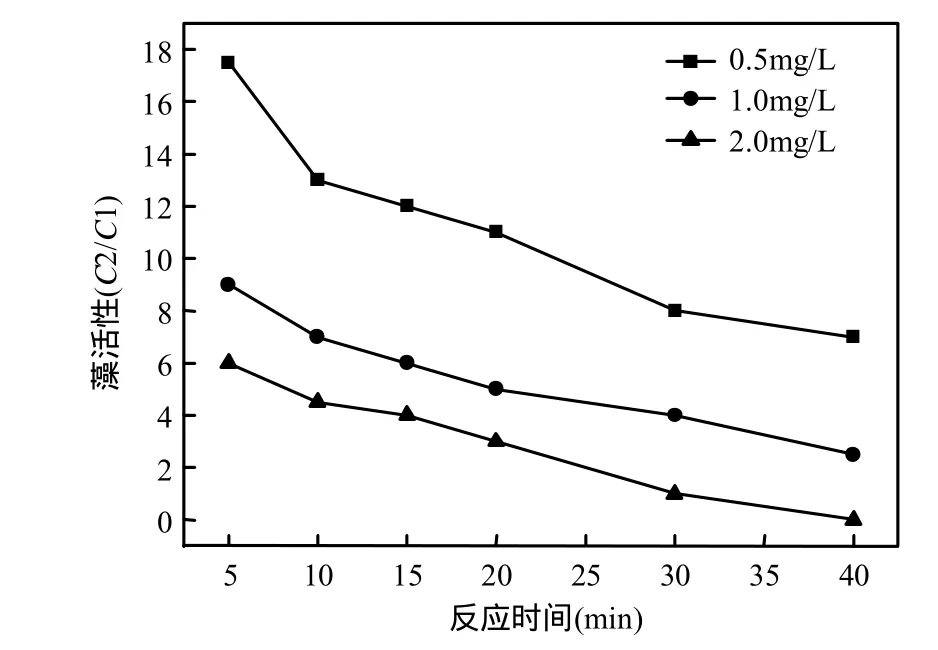
图6 臭氧氧化后对微囊藻活性的影响Fig.6 Effects of algae activity after ozonation by O3
工艺处理后藻类活性试验能明确地表征藻类生存状态,为水处理除藻机制研究和工艺设计提供更清晰的信息.藻类活性测试见材料与方法,比较不同浓度臭氧处理藻后其繁殖能力.比值P=C2/C1表示原来水样中藻类的活性, P值越高,藻类活性/繁殖能力越强.从图6可见,臭氧作用导致藻类活性显著降低,当臭氧浓度为 0.5mg/L,处理时间40min以内时,藻类活性由原来17.5(5min)降低到 7.0(5min);臭氧剂量越高,藻类活性越差,当臭氧浓度为2.0mg/L,处理时间40min以内时,藻类活性由原来 6.0(5min)降低到 0(5min).原因可能是铜绿微囊藻经臭氧氧化处理后,其细胞的完整性破坏,导致藻细胞的繁殖能力受到限制.亚油酸的抑制作用结果表明,可能通过自由基的链锁反应,使铜绿微囊藻 O2-·产生增多,胞膜的通透性增加,大分子核酸或蛋白质受损伤,细胞生长受抑制[20].一直以来,臭氧对微生物的灭活机制尚不完全清楚,有人认为臭氧灭活微生物首先攻击细胞膜,导致细胞发生通透性畸变,导致细胞死亡;也有报道认为臭氧破坏细胞器和细胞内核酸,破坏了细胞的物质代谢和繁殖过程[21],臭氧灭活藻细胞的机制尚需进一步研究.
3 结论
3.1 臭氧灭活铜绿微囊藻与其浓度和作用时间都有关系,随着臭氧浓度和作用时间的延长,藻灭活率明显增加,最高去除率达到99.0%(初始藻细胞密度1.0×107个/L,臭氧浓度2.0mg/L,作用时间40min,浊度为1.0 NTU,温度25℃, pH 7.5).
3.2 浊度0.5~20NTU,温度5~35℃,pH值6.0~9.0,初始藻细胞密度在1.0×107~5.0×109个/L范围内,浊度越低,灭活效果越好;随温度上升,臭氧灭活铜绿微囊藻能力减弱;碱性较酸性条件下臭氧杀藻能力更强.
3.3 当臭氧为2.0mg/L以上作用时间,在饮用水消毒的浊度、温度、pH值、初始藻细胞密度浓度范围内,铜绿微囊藻的灭活率在98.0%以上.
3.4 臭氧处理后藻类活性试验表明,臭氧剂量越高,藻类活性越差,当臭氧浓度为2.0mg/L,处理时间40min,藻类繁殖能力降低到0.
[1] 闫 海,潘 纲,张明明,等.微囊藻毒素的提取和提纯研究 [J].环境科学学报, 2004,24(2):355-359.
[2] Lahtl K, Rapala J, Kivimaki A L, et al. Occurrence of microcystins in raw water sources and treated drinking water of finnish waterworks [J]. Wat. Sci. Tech., 2001,43(12):225-228.
[3] Beasley V R. Algae intoxication in livestock and water flow [J]. Vet Clin North Am. Food Anim. Pract., 1989,5(2):345-361.
[4] Graham N J D, Wardlaw V E, Perry R, et al. The significance of algae as trihalomethane precursors [J]. Wat. Sci. Tech., 1998,37(2):83-89.
[5] Hoehn R C, Barnes D B, Thompson B C, et al. Algae as sources of trihalomethane precursors [J]. J. Am. Water Works Assoc., 1980,72(6):344-350.
[6] Oliver B G, Shindle D B. Trihalomethanes from the chlorination of aquatic algae [J]. Environ. Sci. Technol., 1983,17(2):80-83.
[7] 王立宁,方晶云,马 军,等.化学预氧化对藻类细胞结构的影响及其强化混凝除藻 [J]. 东南大学学报(自然科学版), 2005, 35(sup I):182-185.
[8] 刘卫华,季 民,杨 洁,等.高藻水预氧化除藻效能与水质安全性分析[J].中国公共卫生, 2005,21(11):1323-1325.
[9] 赵志伟,崔福义,任 刚,等.预氧化对滦河天津段高藻期藻类的控制效果 [J]. 沈阳建筑大学学报, 2006,22(4):617-621.
[10] 方晶云,马 军,王立宁,等.臭氧预氧化对藻细胞及胞外分泌物消毒副产物生成势的影响 [J]. 环境科学, 2006,27(6): 1127-1132.
[11] 付 军,闫 海,王东升,等.聚铝及其加载黏土矿物高效絮凝沉降铜绿微囊藻的研究 [J]. 环境污染治理技术与设备, 2006,7(1):76-79.
[12] Schneider O D, Tobiason J E. Preozonation Effects on Coagulation [J]. J AWWA, 2000,92(10):74-87.
[13] Bader H, Hoigne J. Determination of ozone in water by the indigo method [J]. Water Research, 1981,15(4):449-456.
[14] 刘海龙,杨 栋,赵智勇,等.高藻原水预臭氧强化混凝除藻特性研究 [J]. 环境科学, 2009,30(7):1914-1919.
[15] Gurol M D, Singer P C. Kinetics of ozone decomposition: A dynamic approach [J]. Environmental Science and Technology, 1982,16(7):377-383.
[16] 冉治霖,李绍峰,黄君礼,等.氯气灭活饮用水中隐孢子虫的影响因素 [J]. 中国环境科学, 2010,30(6):786-790.
[17] Falabi J A, Gerba C P, Karpiscak M M. Giardia and Cryptosporidium removal from waste-water by a duckweed (Lemna gibba L.) covered pond [J]. Letters in Applied Microbiology, 2002,34(5):384-387.
[18] 冉治霖,李绍峰,朱 静,等.二氧化氯灭活水中隐孢子虫的影响因素及机理研究 [J]. 中国环境科学, 2011,31(6):904-909.
[19] 张 涛,陈忠林,马 军,等.水合氧化铁催化臭氧氧化去除水中痕量硝基苯 [J]. 环境科学, 2004,25(4):43-47.
[20] 张庭廷,郑春艳,聂刘旺,等.亚油酸对铜绿微囊藻的抑制机理[J]. 中国环境科学, 2009,29(4):419-424.
[21] Giovanni W, Tim C, Honorine D. et al. Structural and biochemical alterations in Giardia lamblia cysts exposed to ozone [J]. Journal of Parasitology, 2002,88(6):1100-1106.
