异丁醛加氢制异丁醇宏观动力学研究
2012-01-10蔡清白张新平原宇航张春雷
程 双,蔡清白,张新平,原宇航,张春雷
(上海华谊集团技术研究院,上海 200241)
异丁醛加氢制异丁醇宏观动力学研究
程 双,蔡清白,张新平,原宇航,张春雷
(上海华谊集团技术研究院,上海 200241)
在内循环无梯度反应器中研究了铜系催化剂上异丁醛加氢的反应性能,实验采用工业原粒度φ6 mm×6 mm柱状催化剂。实验条件为温度130~180 ℃,压力为0.3~0.8 MPa,液体空速为1.5~4 h-1,考察了反应温度、压力和液体空速对异丁醛加氢反应的影响。结果表明,反应温度和压力升高,异丁醇收率增大;液体空速增大,异丁醇收率减小。选取各组成以分压表示的异丁醛加氢反应的幂函数动力学模型,根据测定的30套动力学数据,运用非线性最小二乘法,通过计算机数值模拟确定动力学参数,异丁醛加氢制备异丁醇的表观活化能Ea为15.89 kJ/mol,对异丁醛和H2分压的反应级数分别为0.16和0.30。残差分析和统计检验表明,动力学模型是适定的。
异丁醛 加氢 宏观动力学 铜系催化剂
异丁醇是合成增塑剂、防老剂、人工麝香、果子精油和药物的重要原料,也是生产涂料、清漆的重要配料[1]。随着下游市场的不断拓展,异丁醇的市场用途日益广泛,处于供不应求状态[2]。2010年随着渤海化工集团羰基醇装置的建成,异丁醇供需矛盾将有一定改善,但对于快速增长的需求来说仍是杯水车薪,市场缺口仍然存在,处于供不应求状态。
异丁醇主要的生产方法是由丙烯羰基化合成丁/辛醇时的副产物异丁醛加氢而得。近年来,为提高丁/辛醇产品的收率,丙烯羰基合成法多已被以铑为催化剂的低压羰基合成技术所取代,产品的正异比增加,使得市场上异丁醇来源受到限制[3]。为此国内外纷纷探索新的异丁醇生产工艺。目前国内的异丁醇产业正处于发展阶段,杨建国等[4]详细研究了异丁醛气相加氢工艺并对产物分离进行研究,得到适宜的工艺条件及分离的实验参数,齐鲁石化公司等单位采用进口的 G-66 铜基加氢催化剂用于丁辛醇生产装置[5],上海华谊集团结合自身优势,积极开展异丁醇合成新工艺的开发。目前,上海华谊丙烯酸公司的异丁烯两段氧化制甲基丙烯酸(MAA)项目已完成2 000 吨/年工业示范装置的试运行,其中间产物甲基丙烯醛(MAL)经两步加氢可得到粗异丁醇产品,加氢工艺的中间产物为异丁醛[6],该工艺可能是目前最具工业化前景的合成新工艺之一,本文研究正以此为背景,对中间产物异丁醛加氢制异丁醇工艺进行研究。另外,在其动力学方面,Colley S W等人[7]研究了G-66 铜基加氢催化剂上丁醛加氢的宏观动力学,张海涛等[5]模拟了丁醛加氢制丁醇的管壳式固定床反应器的操作工况,得到合适的反应器模型。但是文献中关于异丁醛加氢的反应动力学研究尚未见公开报道,而动力学的研究是反应器模拟的基础,因此,本研究将对异丁醛的反应宏观动力学作初步探讨。
本研究使用铜系气相醛加氢催化剂,对异丁醛加氢的宏观动力学进行深入研究,在不同的实验条件下,依据实验数据,采用有效的动力学模型和算法进行优选和参数估计,最终建立起适宜于工业应用的宏观动力学方程,并针对实验所得的结果作相关比较,以考察不同条件下催化剂的活性、反应速率、转化率等。
1 实验部分
1.1 实验流程
实验开始时先用N2对装置进行吹扫,去除装置中的杂质以及残余空气,然后通入H2按还原温度进行升温还原。H2经过减压阀控制压力,然后通过体积流量计计量,原料异丁醛采用体积流量计计量,两者通入内循环无梯度反应器,经催化反应生成异丁醇,反应稳定后进行实验数据测定。反应后混合气通过保温管路至冷凝器,再经气液分离器,得到的液相产物可用作分析,得到的气体分为两路,一路通过气相色谱仪分析其组成,另一路经皂膜流量计测量流量后放空。

图1 异丁醛加氢宏观动力学研究实验装置Fig.1 Kinetics experiment equipment of isobutyraldehyde hydrogenation
1.2 实验条件
结合异丁醛加氢反应的操作条件以及进行宏观动力学实验的基本要求,确定实验条件如下:反应温度130~180 ℃,压力0.5 MPa,原料:异丁醛,阿法埃沙(天津)化学有限公司,分析纯,98%;氢气,上海化学工业区浦江特种气体有限公司,99.999%。无梯度反应器内装填柱状催化剂(Ф6 mm×6 mm) 2.33 g,填装时采用同粒度的玻璃珠与催化剂相间排列。
实验采用的是山东威海化工机械有限公司生产的BSD-2A 型内循环无梯度反应器[8,9],床层温度由精密控温仪控制,温度波动幅度±1 ℃。反应器叶轮由磁力驱动,催化剂筐置于反应器中,筐下有一个高速回转的气体涡轮,转速可以达到2 500 rpm以上。测定动力学数据之前,对反应器进行无梯度检验和排除外扩散干扰的预试验,梯度检验包括浓度、温度的无梯度检验[10]。所有实验数据均在催化剂活性稳定期内测得。
1.3 预实验
1.3.1 空白实验
在无梯度反应器中不装入催化剂,在反应压力0.5 MPa,原料,反应温度为 150 ℃,汽化温度为120 ℃下,通入原料反应4 h,经色谱分析,产物中异丁醛含量与原料相比没有变化。说明反应器本身对反应没有影响。
1.3.2 外扩散的排除
在气固相催化反应中,气相中的反应组分必须向催化剂表面扩散,气体分子被催化剂表面的活性组份吸附活化后在催化剂表面发生化学反应[11,12]。气体分子从气相主体扩散到催化剂表面的速度随无梯度反应器内旋转转速的增加而增加。通过考察转速变化对加氢反应结果的影响,即可判断外扩散影响是否存在。从图中可以看出在异丁醛质量空速为1 h-1和3 h-1时,转速达到2 000 rpm后,异丁醛转化率没有明显变化,可以表明,转速大于2 000 rpm,外扩散已经消除。因此在实验中采用转速为2 500 rpm。
1.3.3 反应稳定性考察

图2 转速对异丁醛转化率的影响Fig.2 Effect of rotational speed on the isobutyraldehyde conversion

图3 反应时间对异丁醛转化率的影响Fig.3 Effect of reaction time on the isobutyraldehyde conversion
2 结果与讨论
2.1 反应条件考察
2.1.1 压力对催化剂加氢性能的影响
可以看出随反应压力的增大,异丁醛的转化率增大。从反应的化学计量式可知异丁醛加氢是一个摩尔数减小的过程,压力增高有利于正反应进行。从动力学实验中得出异丁醛加氢的幂指数动力学方程中可知,异丁醛的反应速度与异丁醛分压和氢气分压呈正指数关系,随着压力升高使得反应速率增加。所以说,压力增加异丁醛转化率也增加。若反应系统压力过高,预热段的汽化温度会有所升高,工业能耗增加,同时对设备材质要求也高,这是不经济的。本研究参照丁/辛醇工业装置压力,认为0.5~0.8 MPa较为适宜,实验中选用压力0.5 MPa,但最优压力值应结合后续反应器模拟结果加以确定,这部分研究成果将在其他论文中发表,这里不再赘述。

图4 反应压力对反应转化率的影响Fig.4 Effect of pressure on the isobutyraldehyde conversion
2.1.2 温度和质量空速对催化剂加氢性能的影响
温度对铜系醛加氢催化剂加氢反应影响很大。异丁醛分子在催化剂上吸附、活化需要能量,升高温度能加速反应物分子活化,从而提高了反应速度。异丁醛加氢反应是强放热反应,平衡常数很大,可视为不可逆反应[3],因此反应温度在热力学上的影响较小。从图5中可以看出反应温度对动力学的影响较大,即反应温度越高,异丁醛的转化率也越高,则异丁醛反应速率也越快。建议在工业化生产中采用150~170 ℃为反应温度。
从图6中可以看出,随空速的增加,异丁醛转化率呈下降趋势。在相同的温度下,随着空速的增大,异丁醛、氢气与催化剂表面接触几率减小,因此导致异丁醛转化率也随之减小。空速大小不但反映了原料在反应器的停留时问长短,也反映了装置的处理能力[12],在保证产品收率的情况下应尽量增加空速。

图5 反应温度对异丁醛转化率的影响Fig.5 Effect of temperature on the isobutyraldehyde conversion

图6 进料空速对异丁醛转化率的影响Fig.6 Effect of liquid space velocities on the isobutyraldehyde conversion
2.2 动力学实验数据及处理
在反应压力0.5 MPa,异丁醛空速LHSV= 3 h-1,反应温度130~180 ℃,汽化温度为120 ℃下,考察了不同氢醛比即原料分压对异丁醛加氢反应中异丁醛转化率的影响,计算得到反应速率,并和拟合后的动力学方程计算得到的反应速率进行比较,具体数据见表1。

表1 异丁醛加氢宏观动力学数据Table1 Experiment data of isobutyraldehyde hydrogenation

续表1
2.3 动力学模型及参数估计
2.3.1 动力学模型
为便于工程设计的应用,宏观动力学方程模型采用幂函数形式:
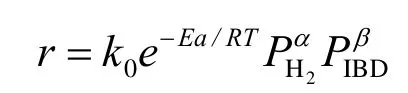
式中α和β分别为氢气和异丁醛的分压指数。
2.3.2 参数估计
对于无梯度反应器,催化床层内达到理想全混流的组成,所以在编程时无需对床层进行积分。反应速率可以下式表示:
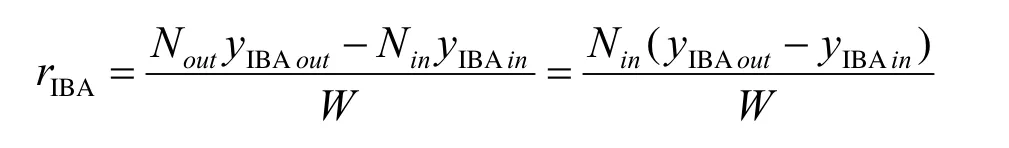
当各实验条件下的异丁醇生成速率已知后,模型方程的参数确定就变成单纯的非线性优化问题。采用非线性最小二乘法对实验数据进行参数估值,目标函数为:

经计算得到模型中各参数为α= 0.16,β= 0.30,k0= 0.198 4 (mol·kPa0.46)/(g·h),Ea= 15 891.19 J/mol。则异丁醛加氢反应的宏观动力学方程为:
2.4 模型适用性检验
2.4.1 残差检验
宏观动力学得到的不同温度下的异丁醛加氢反应速率的模型计算值与实验测定值比较见图7,残差分布见图8,其平均相对误差值为2.83%。

图7 模型计算值和实验值的比较Fig.7 Comparison between experimental and calculated data

图8 模型计算值和实验值之间的残差分布Fig.8 Residual distributions of experimental and calculated data
2.4.2 统计检验
对动力学方程进行F统计和复相关指数检验,以检验动力学模型对实验数据的实用性。ρ2是决定性指标,F为回归均方和与模型残差均方和之比。Mp为参数个数,M为实验次数。

一般认为ρ2> 0.9,F> 10FT时,模型是适定的。FT为显著水平5%相应自由度(MP,M-MP-1)下的F表值,可查表获得。计算得动力学模型的复相关指数ρ2= 0.998 7>0.9、F统计量F= 4 465.5 >10FT(5,28) = 43.0。综上所述,宏观动力学模型是适定的。
2.4.3 误差分析
(1)数据处理导致的误差
数据处理过程中,用Matlab编程分别对六组实验数据进行拟合,每组数据得到不同的k,α和β值,从结果中得到唯一的比较合适的动力学方程的α和β值,导致残差的产生。
(2)引发段的选取
因为引发段会引起实验数据和动力学原理的不符,而对引发段去除的起点和终点靠人来判断,主观性较强,这也是造成结果偏差的原因之一。
(3)实验过程中造成的实验操作误差。
3 结 论
a)本研究在反应压力0.5 MPa,异丁醛空速LHSV= 3 h-1,反应温度130~180 ℃,汽化温度为120 ℃下,考察了铜系气相醛加氢催化剂的宏观动力学数据,选用幂函数型宏观动力学模型,并运用最小二乘法,通过计算机模拟得到模型参数,得到最终表达式为:,经统计检验与残差分析结果表明,宏观动力学模型是适定的。
b)对工业化铜系催化剂进行了工艺评价,考查了各工艺参数对异丁醛加氢反应的影响,得到合适的反应温度为150~170 ℃,压力为0.5~0.8 MPa,空速为2~4 h-1,这些数据为反应器的模拟提供工艺参数的指导,异丁醛加氢宏观动力学的研究将对其工业化进程起到重要作用。
符号说明
LHSV——液相空速,h-1y——摩尔分率
n——物质的量,molM——实验次数
r——宏观反应速率,mol/(g·h)MP——参数个数
k0, k——反应速率常数IBD——异丁醛
R——气体通用常数,8.314 J/(mol·K)IBA——异丁醇
Ea——活化能,J/mol cal——计算值
T——温度,K exp——实验值
P——压力,Pain——反应器进口状态
W——催化剂质量,gout——反应器出口状态
[1]王太文. 异丁醇的应用 [J]. 吉林石油化工, 1992, 4(24):23-26.Wang Taiwen. Isobutyl alcohol applications [J]. Jilin Petrochemical Engineering, 1992, 4(24):23-26.
[2]程 佳, 姜春波. 异丁醇生产技术现状及市场分析 [J]. 化学工业, 2007, 5(10):28-31.Cheng Jia, Jiang Chunbo. Analysis on process technology and market situation of isobutyl alcohol Worldwide [J]. Chemical Industry, 2007,5(10):28-31.
[3]原宇航, 张春雷, 罗 鸽, 等. 一种由甲基丙烯醛加氢连续生产异丁醇的方法:中国, 101570469 [P]. 2009-11-04.
[4]杨建国, 腾相周, 杨世成, 等. 异丁醛气相加氢工艺的研究 [J]. 大庆石油学院学报, 1994, 18(4):108-112.Yang Jianguo, Teng Xiangzhou, Yang Shicheng, et al. The study of the gas phase hydrogenation process of isobutyraldehyde [J]. Journal of Daqing Petroleum Institute, 1994, 18(4):108-112.
[5]张海涛, 张欣荣, 房鼎业. 丁醛加氢制丁醇反应器的数学模拟 [J]. 华东理工大学学报(自然科学版), 2005, 31(1):5-8.Zhang Haitao, Zhang Xinrong, Fang Dingye. Mathematical modeling of the reactor synthesizing butanol from butyraldehyde by hydrogenation[J]. Journal of East China University of Science and Technology ( Natural Science Edition), 2005, 31(1):5-8.
[6]彭水清. 甲基丙烯醛加氢制异丁醇分离过程研究 [D]. 上海: 华东理工大学, 2012.Peng Shuiqing. Refining process of isobutanol synthesized by methylacrolein hydrogenation [D]. Shanghai: East China University of Science and Technology, 2012.
[7]Colley S W, Fawcett C R, Rathmell C. Process for the manufacture of ethyl acetate from ethanol:EP, 990638 [P], 2000-04-05.
[8]Berty J M. Reactor for vapor-phase catalytic studies [J]. Chemical Engineering Progress, 1974, 70(5):78-85.
[9]Borman P C, Bos A N R, Westerterp K R. A novel reactor for determination of kinetics for solid catalyzed gas reactions [J]. AIChE Journal,1994, 40(5):862-869.
[10]郭延红, 丁永朝, 高彩虹. 内循环反应器用于气固反应的动力学研究 [J]. 化学与生物工程, 2009, 26(3):45-49.Guo Yanhong, Ding Yongchao, Gao Caihong. Experimental study on the internal recycle gradientless reactor used for the kinetics of gas-solid reaction [J]. Chemistry and Bioengineering, 2009, 26(3):45-49.
[11]李绍芬. 反应工程 [M]. 第二版. 北京: 化学工业出版社, 2006: 158-183.
[12]Fogler H S. Elements of chemical reaction engineering [M]. Third edition. Birmingham: Pearson Hall PTR, 1999: 454-481.
Macro-Kinetics of Isobutyraldehyde Hydrogenation to Isobutyl Alcohol
Cheng Shuang,Cai Qingbai,Zhang Xinping,Yuan Yuhang,Zhang Chunlei
(Technology Research Institute of Shanghai HuaYi Group, Shanghai 200241, China)
In an internal gradientless recycle reactor, the experiments of isobutyraldehyde hydrogenation were performed over Cu catalyst which was cylindrical particles with the size ofΦ6 mm×6 mm. The experiments were performed at the temperature of 130-180 ℃, liquid space velocities of 1.5-4 h-1and pressures of 0.3-0.8 MPa. The results showed that the yield of isobutyl alcohol increased with increasing temperature and pressure and decreased with increasing liquid space velocities. The power-low kinetics model was used to express the macro-kinetics of the above hydrogenation process. In the proposed models, the reactant components were expressed by their partial pressure. The factors of the proposed models were determined by fitting 30 sets of experimentally obtained partial pressure of both reactants. In order to estimate the kinetic parameters of the proposed models, the nonlinear least squares method was used. The calculations showed that the apparent activation energy for hydrogenation of isobutyraldehyde was 15.89 kJ/mol, and the reaction orders for isobutyraldehyde and H2were 0.16 and 0.30 respectively. The residual error distributions and the statistic tests showed that the proposed macro-kinetic models were reliable and adequate.
isobutyraldehyde; hydrogenation; macro-kinetics; copper catalyst
TQ643.1 文献标识码:A
1001—7631 ( 2012) 01—0037—07
2011-09-26;
2012-02-10
程 双(1985-),女,助理工程师;蔡清白(1983-),男,工程师,通讯联系人。E-mail:qbcai@shhuayitec.com
