pGEX-5X-1-hLMO4原核质粒构建及重组蛋白表达
2012-01-06张红艳李彦姝姚远王春玉王迪李丰
张红艳,李彦姝,姚远,王春玉,王迪,李丰
(1.中国医科大学细胞生物学教研室,卫生部细胞生物学重点实验室,教育部医学细胞生物学重点实验室,辽宁沈阳 110001;2.辽宁省人民医院 消化内科,辽宁 沈阳 110016)
LIM基因是指含有LIM结构域的一大类基因,LIM结构域含有大约55个氨基酸,由两个串联的可与锌结合的富含半胱氨酸的基元组成,调节包括LIM同源异形蛋白在内多种蛋白之间的相互作用[1]。现已发现该家族基因主要有 LMO1、LMO2、LMO3、LMO4、dLMO、XLMO、PDLP 等[2]。含有 LIM 结构域的蛋白称为LIM蛋白,哺乳动物LMO蛋白家族共有4个(LMO1~4),缺少DNA结合域,但是依然能够招募包括转录因子在内的很多蛋白,执行转录调节子的功能[3]。
Kenny等用NL1的LID结构域筛选鼠胚的λ表达文库分离鉴定了LMO4,是LIM转录调节因子亚家族LMO中的新成员,在T淋巴细胞、脑神经脊细胞、体节、背侧肢芽间充质细胞、运动神经元和施万细胞前体细胞中高表达,在胚胎发育中有着重要的调节作用[1]。LMO4在决定细胞命运及肿瘤发生等过程中发挥着重要的作用。LMO4作为转录调节子,在前列腺癌、胰腺癌、乳腺癌等上皮来源的肿瘤中高表达[3-5]。但是人 LMO4(hLMO4)基因,位于染色体1p22.3上[6],在一些人类的癌症中这一区域被删除掉了,例如,肝癌、皮肤癌、肺癌[7-8]。因此 Setogawa等认为LMO4可能执行肿瘤抑制因子的功能[9]。在本研究中旨在利用基因重组技术构建LMO4的原核表达载体,并鉴定其在E.coli BL21中的诱导表达,为进一步研究LMO4的生物学功能奠定一定基础。
1 材料与方法
1. 1 材料
原核表达载体pGEX-5X-1购自美国Clentech公司;大肠杆菌DH5α和BL21为本实验室保存;Pyrobest TM DNA polymerase,dNTP,DNA电泳凝胶回收试剂盒,限制性核酸内切酶BamHⅠ和XhoⅠ均购自大连TaKaRa公 司;DNA marker、Proteinmarker购 自GenScript公司;T4 DNA连接酶购自NEB公司;DNA测序测定由上海生工生物工程有限公司完成;异丙基硫代β-D半乳糖苷(IPTG)为Amresco产品;GST抗体购自Cell Signal公司,HRP标记的羊抗鼠IgG购自北京中杉金桥生物技术有限公司;ECL发光试剂盒购自GE Healthcare公司;其它试剂均为国产分析纯。
1. 2 hLMO4原核表达载体的构建
本实验室通过提取乳腺癌细胞(MCF-7)RNA,逆转录聚合酶链反应获得hLMO4全长编码序列[10],分别用BamHⅠ和 XhoⅠ双酶切pGEX-5X-1载体和hLMO4 PCR片段后,凝胶回收纯化产物[11]。将两个片断用T4 DNA连接酶常温连接2 h,然后16℃连接过夜,得到连接产物。取5 μl转化感受态细胞E.coli DH5α中,37℃培养过夜。挑取菌落,接种于3 ml含氨苄西林的Luria-Bertani(LB)培养基中,37℃振荡过夜。用碱裂解法提取质粒DNA,用BamHⅠ和XhoⅠ双酶切鉴定重组质粒,质粒DNA送上海生工生物工程有限公司进行测序分析,经测序正确后将构建的质粒命名为pGEX-5X-1-hLMO4。
1. 3 重组质粒的诱导表达
将测序正确的重组质粒pGEX-5X-1-hLMO4和pGEX-5X-1载体分别转化E.coli BL21,涂布于含氨苄霉素的LB琼脂平板,37℃培养过夜。挑取转化后的单菌落用碱裂解法制备质粒DNA,经BamHⅠ和XhoⅠ双酶切鉴定阳性克隆。将阳性克隆接种到含氨苄霉素LB培养基中,37℃震荡培养过夜后,将菌液按1∶50接种到50 ml氨苄LB培养基,37℃培养至OD 600为0.6左右时(3~4 h),加入终浓度 1.0 mmol·L-1的IPTG,30℃诱导培养3 h,收集细菌,加入50 μl 1倍稀释的上样缓冲液中,100 ℃加热5 min,4 ℃、10 000 r·min-1离心5 min,冰上放置,取上清进行10%SDS-PAGE电泳。电泳结束后进行考马斯亮蓝染色,脱色后观察诱导结果。
1. 4 GST融合蛋白的纯化
将pGEX-5X-1-LMO4和pGEX-5X-1阳性克隆接种到含有氨苄霉素的LB培养基中,37℃培养过夜后将2 ml过夜菌接种到100 ml LB培养基中,37℃摇菌3 h后加入IPTG,再30℃诱导培养3 h。4℃ 7 000 r·min-1收集细菌,用2 ml细菌裂解液充分重悬细菌,超声破碎30 s,冰上孵育30 min,4 ℃、10 000 r·min-1离心5 min。取上清加入 GST-beads,4℃旋转孵育 3 h,4℃、500 r·min-1离心2 min。收集 GST-beads,使用 NP-40缓冲液清洗GST-beads 3次,每次10 min,然后加入与GST-beads等体积的NP-40缓冲液。取10 μl纯化蛋白,加入2倍稀释的上样缓冲液,100℃加热5 min,4 ℃、10 000 r·min-1离心5 min,冰上放置,取上清进行10%SDS-PAGE电泳。电泳结束后进行考马斯亮蓝染色,脱色后观察纯化蛋白表达。
1. 5 Western blot检测
将诱导表达蛋白经10%SDS-PAGE凝胶分离,4℃40 V恒压转膜过夜,用5%脱脂奶粉常温封闭1 h[12],加入 anti-GST 抗体(1∶2 000),室温孵育 2 h,TBST洗膜3次,每次15 min,加入辣根过氧化物酶标记的山羊抗鼠IgG二抗(1∶5 000),室温孵育2 h,TBST洗膜3次,每次15 min。ECL显色观察结果。
2 结 果
2. 1 hLMO4重组原核表达质粒的构建及鉴定
重组质粒pGEX-5X-1-hLMO4经 BamHⅠ和XhoⅠ双酶切后得到约4 900 bp和500 bp左右的两条带,与预期结果相符(图1),并经测序鉴定正确,无移码突变。
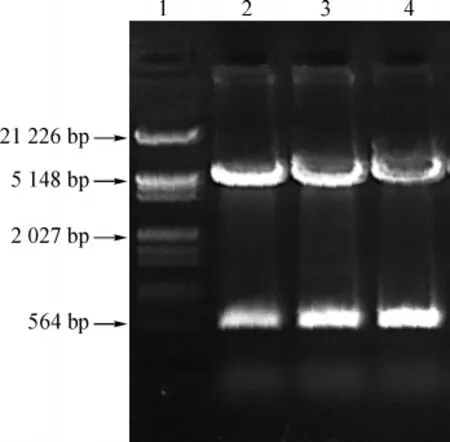
图1 重组质粒pGEX-5X-1-hLMO4酶切分析Lane 1.Lambda DNA marker;Lane 2,3,4.Recombinant plasmid pGEX-5X-1-hLMO4 digested by BamHⅠ and XhoⅠFig 1 Restriction enzyme digestion analysis of the recombinant plasmid pGEX-5X-1-hLMO4
2. 2 原核表达质粒在E.coli中的诱导表达
构建融合表达质粒pGEX-5X-1-hLMO4在BL21 E.coli中经IPTG诱导表达,在大约49 000 Da处出现一条明显的特异性蛋白条带(图2)。
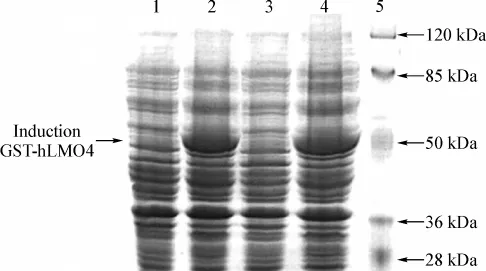
图2 SDS-PAGE电泳分析GST-hLMO4在E.coli BL21中诱导表达Lane 1,3.Without IPTG induced pGEX-5X-1-hLMO4;Lane 2,4.IPTG induced pGEX-5X-1-hLMO4;Lane 5.Protein molecular weight markerFig 2 SDS-PAGE analysis of induction expression of GST-hLMO4 fusion protein in E.coli BL21
2. 3 原核表达质粒在E.coli中的诱导纯化IPTG-5X-1-5X-1-hL
诱导pGEX和pGEXMO4在BL21 E.coli中大量表达,利用 GST-beads对 GST及GST-hLMO4融合蛋白进行纯化(图3)。1列为蛋白分子量标记,在蛋白标准50 kDa所在位置,﹡处出现明显的特异性蛋白条带(49 000 Da),是GST(26 000 Da)与LMO4(23 000 Da)分子质量之和,﹡指示纯化的GST-hLMO4融合蛋白。
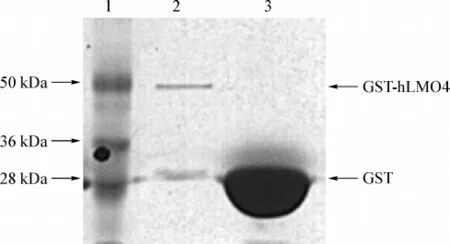
图3 SDS-PAGE电泳分析GST和GST-hLMO4在E.coli BL21中诱导纯化Lane 1.Protein molecular weight marker;Lane 2.the purification of GST-hLMO4 protein;Lane 3.the purification of GST proteinFig 3 SDS-PAGE analyse the purification of GST and GST-hLMO4 fusion protein in E.coli BL21
2. 4 Western blot鉴定融合蛋白的表达
使用anti-GST单克隆抗体进行Western blot鉴定纯化融合蛋白的表达(图4),﹡表示纯化的GST-hLMO4,分子质量大约为49 000 Da,1列代表阴性对照,为纯化的GST蛋白,在相对应的2列﹡位置上没有蛋白表达。
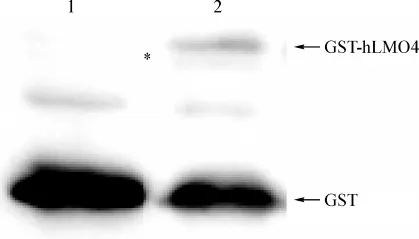
图4 使用anti-GST抗体对融合蛋白GST-hLMO4表达进行Western blot检测Lane 1.The purification of GST protein;Lane 2.The purification of GST-hLMO4 proteinFig 4 Western blot detect the expression of GST-hLMO4 fusion protein using anti-GST mAb
3 讨 论
LMO4是由两个串联的不含有DNA结合域的LIM结构域组成的,与多种蛋白相互作用,在多种蛋白复合体中扮演着桥梁因子的作用。它能够将辅抑制子(例如 MTA1、辅因子 CtIP 及 BRCA1[13])招募到转录因子上,抑制转录活性。另外,LMO4通过招募活性因子或者减少招募辅抑制子来促进转录活性,例如BMP7[14]。目前已经证实,能与其发生相互作用的蛋白还包括核内普遍存在的 Lbd1[15]、DEAF1[16]、HEN1[17]、Get-1[18]等。这些研究提示LMO4作为转录调节子,在不同肿瘤中发挥着多重功能,一方面作为致癌基因促进细胞增殖,另一方面作为肿瘤抑制子促进细胞凋亡,在哺乳动物正常发育和肿瘤形成过程中起着重要的调控作用。
Racevskis等[19]发现LMO4是人类乳腺癌的一种自身抗原,可引起细胞增殖,增强细胞侵袭能力,从而直接导致乳腺细胞癌变。Sum等[13]报道,10种乳腺癌细胞株中,有5种细胞株LMO4 mRNA高表达,原位杂交检测177例乳腺癌样本,56%LMO4高表达。在口腔癌侵袭前沿LMO4表达上调,提示LMO4在癌症细胞侵袭中扮演重要角色[20]。与非肿瘤的胰腺导管细胞株相比,14种胰腺癌细胞株中,有9株高表达LMO4,原代培养的胰腺成纤维细胞也高表达LMO4[3]。
本研究中采用pGEX-5X-1原核表达载体,此类载体含有高效的原核表达启动子,能够在E.coli体内高效表达重组蛋白。本实验成功构建了pGEX-5X-1-hLMO4表达质粒,并建立GST-hLMO4体外纯化表达系统,利用体外纯化蛋白可进行生物学实验研究,例如GST pull-down验证蛋白相互作用,体外激酶实验验证磷酸化等,为深入探讨LMO4在肿瘤中的生物学作用提供了可靠的研究手段和实验依据。
[1]KENNY D A,JURATA LW,SAGA Y,et al.Identification and characterization of LMO4,an LMO gene with a novel pattern of expression during Embryogenesis[J].Proc Natl Acad Sci USA,1998,95(19):11257-11262.
[2]惠玲,蔡文琴.LIM-only转录因子研究进展[J].国外医学分子生物学分册,2003,25(4):238-241.
[3]YU J,OHUCHIDA K,NAKATA K,et al.LIM only 4 is overexpressed in late stage pancreas cancer[J].Molecular Cancer,2008,7:93-103.
[4] MOUSSES S,BUBENDORF L,WAGNER U,et al.Clinical validation of candidate genes associated with prostate cancer progression in the CWR22 model system using tissue microarrays[J].Cancer Res,2002,62(5):1256-1260.
[5]VISVADER J E,VENTER D,HAHM K,et al.The LIM domain gene LMO4 inhibits differentiation of mammary epithelial cells in vitro and is overexpressed in breast cancer[J].Proc Natl Acad Sci USA,2001,98(25):14452-14457.
[6]TSE E,GRUTZ G,GARNER A A,et al.Characterization of the Lmo4 gene encoding a LIM-only protein:genomic organization and comparative chromosomal mapping[J].Mamm Genome,1999,10:1089-1094.
[7]EMI M,MATSUMOTO S,IIDA A,et al.Correlation of allelic losses and clinicopathological factors in primary breast cancers[J].Breast Cancer,1997,4:243-246.
[8]HOGGARD N,BRINTNELL B,HOWELl A,et al.Allelic imbalance on chromosome 1 in human breast cancer.II.Microsatellite repeat analysis[J].Genes,Chromosomes & Cancer,1995,12:24-31.
[9]SETOGAWA T,SHINOZAKI-YABANA S,MASUDA T,et al.The tumor suppressor LKB1 induces p21 expression in collaboration with LMO4,GATA-6,and Ldb1[J].Biochemical and Biophysical Research Communications,2006,343:1186-1190.
[10]李彦姝,王春玉,苏楠,等.hLMO4基因重组质粒的构建及蛋白表达和定位[J].解剖科学进展,2009,15(1):85-87,92.
[11]郭英,徐佳佳,商延芳,等.RegⅣ基因缺失CRD结构域片段获得及其表达载体的构建与转染[J].东南大学学报:医学版,2009,28(3):166-170.
[12]张红艳,王春玉,李彦姝,等.3*Flag-hPAK4重组质粒的构建及其在COS7细胞中的表达与定位[J].东南大学学报:医学版,2011,30(6):869-873.
[13]SUM E Y,PENG B,YU X,et al.The LIM domain protein LMO4 interacts with the cofactor CtIP and the tumor suppressor BRCA1 and inhibits BRCA1 activity[J].J Biol Chem,2002,277(10):7849-7856.
[14]WANG N,LIN K K,LU Z,et al.The LIM-only factor LMO4 regulates expression of the BMP7 gene through an HDAC2-dependent mechanism,and controls cell proliferation and apoptosis of mammary epithelial cells[J].Oncogene,2007,26(44):6431-6441.
[15]DEANE J E,RYAN D P,SUNDE M,et al.Tandem LIM domains provide synergistic binding in the LMO4:Ldb1 complex[J].EMBO J,2004,23(18):3589-3598.
[16] SUGIHARA T M,BACH I,KIOUSSI C,et al.Mouse deformed epidermal autoregulatory factor 1 recruits a LIM domain factor,LMO-4,and CLIM coregulators[J].Proc Natl Acad Sci USA,1998,95:15418-15423.
[17]MANETOPOULOS C,HANSSON A,KARLSSON J,et al.The LIM-only protein LMO4 modulates the transcriptional activity of HEN1[J].Biochem Biophys Res Commun,2003,307(4):891-899.
[18]KUDRYAVTSEVA E I,SUGIHARA T M,WANG N,et al.I-dentification and characterization of Grainyhead-like epithelial transactivator(GET-1),a novel mammalian Grainyheadlike factor[J].Dev Dyn,2003,226(4):604-617.
[19]RACEVSKIS J,DILL A,SPARANO J A,et al.Molecular cloning of LMO4,a new human LIM domain gene[J].Biochim Biophys Acta,1999,1445:148-153.
[20]SUM EY,SEGARA D,DUSCIO B,et al.Overexpression of LMO4 induces mammary hyperplasia,promotes cell invasion,and is a predictor of poor outcome in breast cancer[J].Proc Natl Acad Sci USA,2005,102:7659-7664.
