系列黄酮化合物与血清白蛋白结合及其结构相关性
2012-01-06崔艳花郭春梅孙明忠郭一萌鱼红闪刘淑清
崔艳花,郭春梅,孙明忠,郭一萌,鱼红闪,刘淑清
(1.大连医科大学 生物化学与分子生物学教研室,辽宁 大连 116044;2.大连医科大学生物技术系,辽宁 大连 116044;3.大连工业大学 生物工程学院,辽宁 大连 116034)
系列黄酮化合物与血清白蛋白结合及其结构相关性
崔艳花1,郭春梅2,孙明忠2,郭一萌1,鱼红闪3,刘淑清1
(1.大连医科大学 生物化学与分子生物学教研室,辽宁 大连 116044;2.大连医科大学生物技术系,辽宁 大连 116044;3.大连工业大学 生物工程学院,辽宁 大连 116034)
目的 比较具有不同取代基基团的八种黄酮类化合物与牛血清白蛋白(BSA)的相互作用及与其结构的相关性。方法 基于黄酮化合物能够猝灭色氨酸残基的内源性荧光,采用荧光光谱法研究黄酮类化合物与BSA结合作用,根据荧光猝灭方程计算黄酮类化合物与BSA的表观结合常数(KA)和结合位点数。结果 八种黄酮类植物化学物与BSA的结合强弱依次为:橙皮素(5.59×105)>槲皮素(4.94×105)>柚皮素(3.04×105)>异槲皮素(4.66×104)>淫羊藿苷(3.60×104)>芦丁(1.65×104)>橙皮苷(2.50×103)>柚皮苷(8.70×102)。结论 糖苷基取代对黄酮类化合物与BSA的结合作用有很大影响,A环可能是黄酮类化合物插入BSA疏水区的关键部位,其C7位上的糖苷基取代是影响其与BSA结合的关键基团。此研究探讨了黄酮类化合物与BSA的作用及其与结构相关性规律,对了解黄酮类化合物在体内的运输、代谢和分布提供了一定实验依据。
黄酮类化合物;牛血清白蛋白;荧光光谱;结构
血清白蛋白是血液中最为丰富的载体蛋白,具有储运内源性代谢产物和外源性药物小分子的作用,是药物发挥药效的重要载体和靶分子;药物进入血浆后与血清白蛋白结合,再被运送到身体各部位而发挥药效[1]。药物与血清白蛋白相互作用的强弱决定着药物作用强度、作用时间、清除速度及分布等[2-3]。因此研究药物与血清白蛋白的相互作用对了解药物的转运和代谢过程、研究药物与蛋白质的相互作用机理、了解药物发挥药效的作用机制、预测药物毒性剂量和不良反应、揭示药物药效、对药量调整、药物改良和新药研发等都具有重要借鉴意义[4-5]。牛血清白蛋白(BSA)与人血清白蛋白(HSA)具有相似的序列和构型,所以BSA常被选为研究药物与蛋白相互作用的首选底物。
黄酮类化合物是天然多酚类植物化学物,具有潜在治疗癌症、抗炎症、抗自由基、抗氧化、抗病毒、调节血压和血糖、防治心脑血管疾病等作用[6]。黄酮类化合物发挥药效的目标分子为蛋白质,药物活性高低取决于与靶向分子的相互作用、作用方式及亲和力大小,而黄酮类化合物结构上的差异常导致其生物学活性的变化[7-8]。目前,对黄酮类化合物构效关系研究相对较少,其构效关系对药物的选用和开发、作用机制的研究意义重要。
本文采用荧光光谱法分析了具有不同取代基基团的八种黄酮类化合物,包括槲皮素、异槲皮素、芦丁、橙皮素、橙皮苷、柚皮素、柚皮苷和淫羊藿苷(图1)与BSA的表观结合常数(KA)和结合位点数(n),探讨了该类化合物与BSA相互作用规律及与其结构的关系。

图1 八种黄酮类化合物化学结构图Fig.1 The chemical structures of eight flavonoid phytochemicals
1 材料
槲皮素、异槲皮素、芦丁、橙皮素、橙皮苷、柚皮素、柚皮苷和淫羊藿苷由大连工业大学提供;BSA(98%)购于Acros公司;其他试剂均为国产分析纯。
HITACHI 650-60荧光分光光度计,日本日立公司;Waters 2690/996高效液相色谱仪,美国Waters公司。
2 方法
2.1 八种黄酮类化合物纯度分析
八种黄酮类化合物各0.55 mg,分别用甲醇2 mL溶解,0.2μm过滤器过滤后,分别取10μL进样,用高效液相色谱法(HPLC)检测其纯度。色谱条件:Intersil ODS-3 C18色谱柱(4.6 mm × 250 mm);流动相:甲醇-0.2%磷酸溶液(60∶40);流速:1.0 mL/min;检测波长:槲皮素、异槲皮素、芦丁、柚皮素、柚皮苷254 nm,橙皮素、橙皮苷283 nm,淫羊藿苷270 nm;柱温:25℃。
2.2 八种黄酮类化合物与BSA的相互作用
八种黄酮类化合物分别用二甲亚砜(DMSO)配制成浓度为 2.65 ×10-4,2.59 ×10-4,2.07 ×10-4,2.59 × 10-4,2.07 × 10-4,2.59 × 10-4,2.07 × 10-4和2.07×10-4mol/L的储备溶液,以 0.1 mol/L Tris-HCl缓冲液(pH 7.4)将BSA配制成浓度为1×10-5mol/L的标准溶液。在10 mL试管中加入1×10-5mol/L BSA溶液0.5 mL,再分别加入不同体积的黄酮类化合物,最后加0.1 mol/L Tris-HCl缓冲液(pH 7.4)至5 mL,摇匀,将BSA浓度相同而黄酮类化合物浓度由低到高的一系列溶液在室温下静置1 h,然后测定样品的荧光发射强度,激发波长为280 nm,发射波长为346 nm,激发和发射光栅狭缝宽均为4 nm。
3 结果
3.1 八种黄酮类化合物纯度分析
采用HPLC峰面积归一法计算,得出槲皮素、芦丁、异槲皮素、淫羊藿苷、橙皮素、橙皮苷、柚皮素和柚皮苷的纯度分别为 98.22%,99.33%,97.12%,96.85%,95.85%,96.53%,95.64% 和 95.06%。用于BSA相互作用研究的这八种黄酮类化合物纯度高,保证了实验结果的可信性和准确性。
3.2 八种黄酮类化合物与BSA相互作用
BSA分子中含有色氨酸、酪氨酸残基,在280 nm激发下能产生较强的内源荧光[4]。在保持BSA浓度固定不变的情况下,随着黄酮类化合物浓度的增加,BSA的内源性荧光有规律的降低;表明黄酮化合物与BSA相互作用,使BSA分子中能够产生内源性荧光的氨基酸残基的微环境发生变化,而使BSA的内源性荧光产生猝灭。
假设BSA与黄酮类化合物(D)与BSA(P)之间可以式(1)表达:

式(1)中n是D在P上的结合位点数,KA为D与P的表观结合常数。则KA可以式(2)表达:
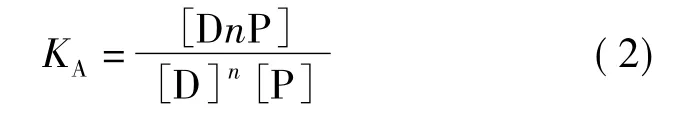
对式(2)做数学变换得到式(3):
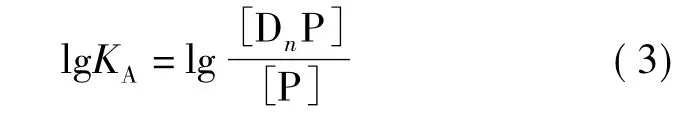
由于黄酮类化合物与BSA结合后会发生荧光猝灭,假定DnP不发射荧光,则:

将(4)代入(3)得到猝灭方程式:
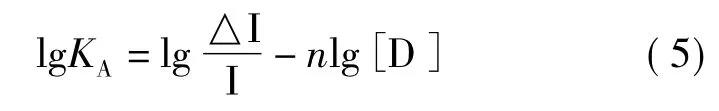
式(5)中[D]为黄酮化合物的浓度,I0为不加D的初始荧光强度,I为加入D后荧光强度。△I=I0-I。
以 lg[D]为横坐标,lg(△I/I)为纵坐标作图,得图2。槲皮素、芦丁、异槲皮素、淫羊藿苷、橙皮素、橙皮苷、柚皮素和柚皮苷分别在浓度为5.30×10-7~5.30 × 10-6,8.30 × 10-7~ 3.73 × 10-6,1.55 ×10-6~5.18 ×10-6,1.04 ×10-6~5.18 ×10-6,1.04×10-6~5.18 ×10-6,5.18 ×10-7~5.18 × 10-6,4.15 ×10-7~3.73 ×10-6和8.30 ×10-7~4.15 ×10-6mol/L范围内呈现很好的线性关系,根据其线性方程式即可得到各黄酮类化合物的KA和n。
槲皮素、芦丁、异槲皮素、淫羊藿苷、橙皮素、橙皮苷、柚皮素和柚皮苷与BSA的结合位点n分别为0.97,0.86,0.92,0.95,1.08,0.74,1.06 和 0.63,八种黄酮类化合物与BSA的结合位点数约为1,即在实验浓度范围内,每个BSA约能与一分子的黄酮化合物结合。根据KA,八种黄酮类化合物与BSA结合的强弱顺序为:橙皮素(5.59×105)>槲皮素(4.94×105)>柚皮素(3.04×105)>异槲皮素(4.66×104)>淫羊藿苷(3.60×104) >芦丁(1.65×104)>橙皮苷(2.50×103)>柚皮苷(8.70×102)。构效关系比较表明,糖苷基的取代与黄酮类化合物与BSA结合力强弱有密切关系。

图2 八种黄酮类植物化学物荧光猝灭图Fig.2 Double-logarithm curves of eight flavonoid phytochemicals quenching BSA fluorescence
4 讨论
槲皮素、橙皮素和柚皮素均比它们相应的苷芦丁、异槲皮素、橙皮苷和柚皮苷与BSA的结合作用要强,这可能是因为芦丁、异槲皮素、橙皮苷和柚皮苷的羟基被糖苷基取代之后分子体积增大,由于空间位阻作用不利于其插入到BSA疏水腔。药物与BSA的结合受药物分子疏水性的影响,因为色氨酸等疏水性氨基酸残基大多位于BSA疏水腔内,脂溶性的药物更易进入疏水腔从而与BSA形成分子缔合物,槲皮素、橙皮素和柚皮素较芦丁、异槲皮素、橙皮苷和柚皮苷的脂溶性好,更易进入BSA的疏水腔,使 BSA 荧光猝灭[3,5,7,9]。
A环C7位上的糖苷基取代要比C环C3位糖苷基取代对黄酮类化合物与BSA的结合影响大。橙皮苷和柚皮苷均为A环C7位上的双糖苷基取代,它们均比C环C3位双糖苷基取代的芦丁的表观结合常数低约1个数量级。更进一步推论A环可能是黄酮类化合物插入BSA疏水区的关键部位。淫羊藿苷比橙皮苷和柚皮苷结合作用强,可能由于淫羊藿苷A环C7位上的糖苷基取代仅为单糖,体积小于橙皮苷和柚皮苷,而A环C8位上的烯烃结构又增加了淫羊藿苷的脂溶性,故其与BSA的结合作用强于橙皮苷和柚皮苷。
黄酮类化合物可通过氢键和(或)疏水作用与BSA相互作用[10-12]。这也说明槲皮素、橙皮素和柚皮素与BSA的结合作用更强,是因为它们既有更多羟基基团参与的氢键作用,又有母核的疏水作用。而橙皮苷和柚皮苷由于空间位阻较大,插入BSA的疏水区困难,故主要通过氢键与BSA结合,结合的强度自然就弱于槲皮素、橙皮素和柚皮素。异槲皮素和芦丁与BSA的结合强度居中,可能由于其糖苷基的位置离插入到蛋白质疏水区的位置相对较远,虽因体积的增大对结合产生阻碍作用,但其影响远没有橙皮苷和柚皮苷的大。
总之,糖苷基的取代对黄酮类化合物与BSA的结合作用有很大影响。A环C7位上的糖苷基取代可能是影响二者结合的关键基团,A环可能是黄酮类化合物插入到BSA疏水区的关键部分。本实验结果可为深入研究黄酮类化合物与蛋白的作用机理、探索药物分子构效关系提供有价值的信息,并对阐明黄酮类化合物在体内的运输过程及对相应疾病的预防和治疗有提供一定实验基础和理论依据。
[1]Bolli A,Marino M,Rimbach G,et al.Flavonoid binding to human serum albumin[J].Biochem Biophys Res Commun,2010,398(3):444-449.
[2]Matei I,Hillebrand M.Interaction of kaempferol with human serum albumin:a fluorescence and circular dichroism study[J].J Pharm Biomed Anal,2010,51(3):768-773.
[3]Diniz A,Escuder-Gilabert L,Lopes N P,et al.Characterization of interactions between polyphenolic compounds and human serum proteins by capillary electrophoresis[J].Anal Bioanal Chem,2008,391(2):625-632.
[4]Fang R,Jing H,Chai Z,et al.Study of the physicochemical properties of the BSA:flavonoid nanoparticle[J].Eur Food Res Technol,2011,233(6):275-283.
[5]Zhang Y,Shi S,Sun X,et al.The effect of Cu2+on interaction between flavonoids with different C-ring substituents and bovine serum albumin:structure-affinity relationship aspect[J].J Inorg Biochem,2011,105(12):1529-1537.
[6]Cavia-Saiz M,Busto M D,Pilar-Izquierdo M C,et al.Antioxidant properties,radical scavenging activity and biomolecule protection capacity of flavonoid naringenin and its glycoside naringin:a comparative study[J].JSci Food Agric,2010,90(7):1238-1244.
[7]Xie M X,Xu X Y,Wang Y D.Interaction between hesperetin and human serum albumin revealed by spectroscopic methods[J].Biochim Biophys Acta,2005,1724(1-2):215-224.
[8]Pastukhov A V,Levchenko L A,Sadkov A P.Spectroscopic study on binding of rutin to human serum albumin[J].J Mol Struct,2007,842(5):60-66.
[9]Papadopoulou A,Green R J,Frazier R A.Interaction of flavonoids with bovine serum albumin:a fluorescence quenching study[J].J Agric Food Chem,2005,53(1):158-163.
[10] Rawel H M,Frey S K,Meidtner K,et al.Determining the binding affinities of phenolic compounds to proteins by quenching of the intrinsic tryptophan fluorescence[J].Mol Nutr Food Res,2006,50(8):705-713.
[11] Liu E H,Qi L W,Li P.Structural relationship and binding mechanisms of five flavonoids with bovine serum albumin[J].Molecules,2010,15(12):9092-9103.
[12] Vial Y,Tod M,Hornecker M,et al.In vitro influence of fatty acids and bilirubin on binding of mycophenolic acid to human serum albumin[J].J Pharm Biomed Anal,2011,54(3):607-609.
The binding and structural association of flavonoids with bovine serum albumin
CUI Yan-hua1,GUO Chun-mei2,SUN Ming-zhong2,GUO Yi-meng1,YU Hong-shan3,LIU Shu-qing1
(1.Department of Biochemistry and Molecular Biology,Dalian Medical University,Dalian 116044,China;2.Department of Biotechnology,Dalian Medical University,Dalian 116044,China;3.School of Bioengineering,Dalian Polytechnic University,Dalian 116034,China)
Purpose To investigate the binding capacities and structural association of eight flavonoids with similar core structure with bovine serum albumin(BSA).Methods As the flavonoids can quench the intrinsic fluorescence of tryptophan residues,the apparent association constant(KA)and the number of flavonoids binding to BSA were determined by fluorescence spectroscopy following the derived fluorescence quenching equation.Results The binding capacities of eight flavonoid phytochemicals were ordered as hesperetin(5.59×105)>quercetin(4.94×105)>naringenin(3.04×105) >isoquercitrin(4.66×104) >icariin(3.60×104) >rutin(1.65×104) > hesperidin(2.50×103)>naringin(8.70×102).Conclusion Glycoside substituent plays an important role in the interaction of flavonoids with BSA.The A ring of flavonoids should be the critical structural component merging into the hydrophobic region of BSA.The group at the site of C7was the key group interrupting the binding of flavonoid to BSA.The current work investigated the interaction and structural basis of flavonoids binding to BSA.The results provided certain experimental data for revealing the transport,metabolism and distribution of flavonoids in vivo.
flavonoids;bovine serum albumin;fluorescence;structure
Q284
A
1005-1678(2012)06-0728-04
2012-03-15
国家自然科学基金(81050010,81100722);辽宁省教育厅高等学校科研项目(2008S077);辽宁省自然科学基金(20082158)
崔艳花,女,研究生,从事植物化学物生物学意义研究;刘淑清,通信作者,博士,副教授,主要从事疾病蛋白组学和肿瘤淋巴道转移研究,Tel:0411-86110307,E-mail:lsqsmz@163.com。
