U(Ⅵ)在Na-凹凸棒石黏土上的吸附
2012-01-05牛智伟范桥辉潘多强许君政吴王锁
牛智伟,范桥辉,潘多强,许君政,吴王锁
兰州大学 放射化学与核环境研究所,甘肃 兰州 730000
高放废物地质处置是放射化学领域的前沿研究课题,也是世界各国面临的涉及环境保护和核能可持续发展的重大问题。因此,研究放射性核素和重金属离子在黏土表面的吸附/解吸和迁移,对高放废物地质处置库的性能评价和模型计算具有重要的理论和实际意义。
凹凸棒石黏土是一种链层状的富镁铝纳米级硅酸盐粘土。其晶体结构属2∶1型(图1),分为3层,上下2层是Si—O四面体,中间1层是(Al,Mg,Fe)—O—OH八面体。凹凸棒石黏土含有大量的结构羟基,如Si—OH、Mg—OH和Al—OH等。由于其结构中存在着Al3+对Si4+,Fe2+、Mg2+对A13+或Si4+等产生同晶置换现象[1-3],形成铝凹凸棒石和铁凹凸棒石等变种,故晶体中含有不定量的Na+、Ca2+、Fe3+和Al3+等,各种离子替代的综合结果使凹凸棒石常常带少量的永久性的负电荷,因此凹凸棒石黏土具有很强的物理和化学吸附能力[3]。
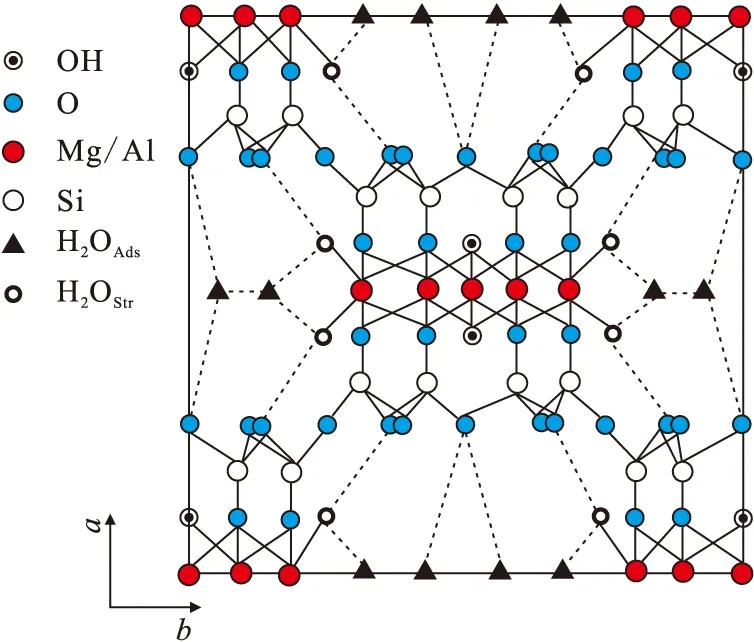
图1 凹凸棒石粘土在001晶面结构示意图
我国凹凸棒石黏土储量丰富、价格低廉,其原土和活化改性产物在废物、废水处理及其它领域具有非常广阔的应用前景。lvarez-Ayuso等[4]研究并发现凹凸棒石黏土对Pb2+、Cu2+、Zn2+和Cd2+均有较强的吸附能力,其顺序为Cu>Pb>Zn>Cd,认为凹凸棒石黏土能有效富集污染水体中的重金属离子。Fan等[5]研究了磁改性凹凸棒石黏土对的吸附,发现凹凸棒石黏土经磁改性后吸附能力明显增强,且易于固液分离。殷竟洲等[6]发现经壳聚糖改性的凹凸棒石黏土对Pb2+和Cd2+的吸附性能优于凹凸棒石黏土,且经5次再生后凹凸棒石黏土仍具有很高的吸附容量。
虽然国内学者对凹凸棒石黏土的吸附性能做了一些研究,但仍有很多问题亟待解决,如对显著影响吸附的重要因素的考察不够细致,凹凸棒石黏土与重金属离子的吸附机理还很模糊。本工作拟采用X射线衍射、扫描电镜对天然和Na-凹凸棒石黏土的结构进行表征;重点研究离子强度、pH值、富里酸及温度对U(Ⅵ)在Na-凹凸棒石黏土上吸附的影响。
1 实验部分
1.1 主要实验试剂
凹凸棒石黏土由兰州凯西科技公司提供;富里酸(FA)由甘肃兴隆山土壤中提取,组成分析见文献[7];实验中所用其它试剂均为分析纯。
标准铀溶液的配制:准确称取1.179 2 g经850 ℃灼烧过的八氧化三铀,用10 mL盐酸和3 mL过氧化氢加热溶解,蒸至近干。再加入20 mL水,使其完全溶解后转入1 000 mL容量瓶中,加0.1 mol/L盐酸溶液至刻度,摇匀,此溶液中铀的浓度为1.00 g/L(即4.20 mmol/L)。
Na-凹凸棒石的制备:将原凹凸棒石黏土研磨、过140目筛,用0.500 mol/L NaCl配制成含凹凸棒石40.0 g/L的悬浮液,调节其pH值稳定在4.0左右,振荡24 h,10 000 r/min下分离,重复2次;再用0.100 mol/L NaCl配成含凹凸棒石40.0 g/L的悬浮液,振荡、10 000 r/min下分离,重复3次,第4次在1 500 r/min下分离,倾出上层凹凸棒石悬浮液,弃去残渣,在10 000 r/min下分离,干燥、研磨过筛后置于干燥器中备用。
1.2 实验仪器
V-1800型分光光度计,上海美谱达仪器有限公司;BS110S型电光分析天平,北京塞多利斯天平有限公司,感量0.1 mg;PHSJ-4A型精密pH计,上海精密科学仪器有限公司;H2050R-1型高速离心机,湖南湘仪实验室仪器开发有限公司;微量可调移液枪(200 μL、1 mL、5 mL);聚乙烯试管(10 mL)。
1.3 实验方法
(1)吸附实验
依次向聚乙烯管中加入2.00 mL 12.0 g/L的Na-凹凸棒石悬浮液,1.00 mL 1.00 mol/L NaCl溶液,振荡平衡24 h后继续向体系中加入一定体积的铀溶液和去离子水,使总体积为8.00 mL,用微量的HCl或NaOH调节pH至所需值。在25 ℃下振荡48 h后12 000 r/min下离心分离,取上清液4.00 mL于25 mL容量瓶中,加入1.00 mL 0.500 mol/L HCl、5.00 mL 0.1%的偶氮胂Ⅲ,用去离子水定容,在波长650 nm处测吸光度。
(2)解吸实验
将吸附实验所得的悬浮液经离心后,移去4.00 mL上清液,向剩余悬浮液中加入4.00 mL相同浓度的NaCl溶液,调节pH值与吸附实验时的相同,在25 ℃下振荡48 h,12 000 r/min下离心分离,其它实验方法与吸附实验方法相同。所有实验数据都是2次测量值的平均值,相对误差小于5%。
吸附结果用吸附百分数(Y)和分配系数(Kd)表示:
(1)
(2)
式中:c0、ce分别为U(Ⅵ)的初始浓度(mol/L)和平衡浓度(mol/L),V为凹凸棒石悬浮液的体积;m为凹凸棒石的质量。
2 结果与讨论
2.1 X射线衍射(XRD)分析
图2是天然凹凸棒石与Na-凹凸棒石的XRD谱。由图2可看出,凹凸棒石的主要峰(2θ=8.360°、19.740°、27.980°、34.580°和42.360°)没有发生明显的变化,说明二者的基本结构没有发生显著变化。根据布拉格公式:
2dsinθ=nλ
(3)
式中:θ为X光的入射角度(°),n为衍射级数,d为晶面间距(nm),λ为波长(nm)。可计算出天然凹凸棒石黏土在(001)晶面方向上的晶面间距d=1.062 nm,Na-凹凸棒石的d=1.052 nm,与文献报道基本吻合[8]。
2.2 扫描电镜(SEM)分析
图3为凹凸棒石的SEM表征照片。由图3可知,天然凹凸棒石和Na-凹凸棒石的基本形态相似,呈现一种长条状粘结聚集起来的针棒状和纤维状致密有序的晶束,并互相交织形成“柴垛”状结构。Na-凹凸棒石由于除去了碳酸盐及其它杂质,呈现出更多孔隙,具有更强的吸附能力[9]。
2.3 接触时间对吸附的影响
为了研究U(Ⅵ)在Na-凹凸棒石上的吸附动力学,引入假二级动力学方程[10]:
(4)
式中:qe和qt分别为平衡时刻和t时刻U(Ⅵ)在Na-凹凸棒石上的吸附量,mg/g;k为假二级动力学方程吸附速率常数,g/(mg·h)。
由图4可知,U(Ⅵ)在Na-凹凸棒石上的吸附2~3 h达到平衡;3 h以后吸附百分数基本不变。图5为U(Ⅵ)在Na-凹凸棒石上吸附的假二级动力学的线性拟合。利用其直线的斜率和截距求得吸附速率常数k=1.54 g/(mg·h),吸附达平衡后的吸附量qe=2.63 mg/g。线性相关系数(r=0.999 7)非常接近1,说明U(Ⅵ)在Na-凹凸棒石上的吸附符合假二级动力学模型。
2.4 Na-凹凸棒石用量(m/V)对吸附的影响
Na-凹凸棒石用量对吸附的影响示于图6。由图6可以看出,当m/V<15.0 g/L时,U(Ⅵ)在Na-凹凸棒石上的吸附百分数随着Na-凹凸棒石用量的增大而迅速增大;当m/V>15.0 g/L时,吸附百分数达90%以上,且吸附百分数的增加非常缓慢。随着Na-凹凸棒石用量增大,体系中Na-凹凸棒石提供吸附位的总量随之增加,更多的表面位与U(Ⅵ)形成表面络合物而促进U(Ⅵ)的吸附[11-12]。图6还表明,当m/V<15.0 g/L时,U(Ⅵ)在Na-凹凸棒石黏土上的分配系数Kd随用量的增大而增大;当m/V>15.0 g/L时,Kd值却随吸附剂用量的增大而略有减小。鉴于表观分配系数Kd的物理化学意义,Kd通常不随吸附剂用量的改变而发生变化。以上结果可能是因为在较低的m/V下,吸附在凹凸棒石黏土表面上的U(Ⅵ)继续通过孔道和晶格扩散至凹凸棒石黏土颗粒的内部,空缺的表面可继续吸附溶液中的U(Ⅵ),从而使得Kd增大;当m/V较高时,吸附剂颗粒之间相互作用增大而导致Kd略有减小。

图3 凹凸棒石的SEM表征
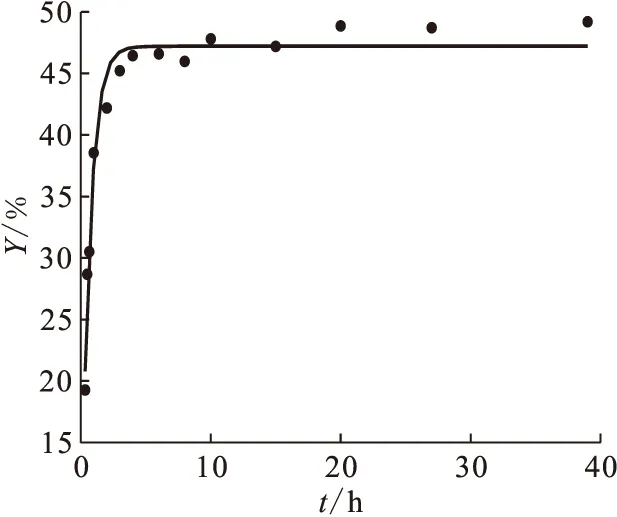
图4 接触时间对U(Ⅵ)在Na-凹凸棒石上吸附的影响
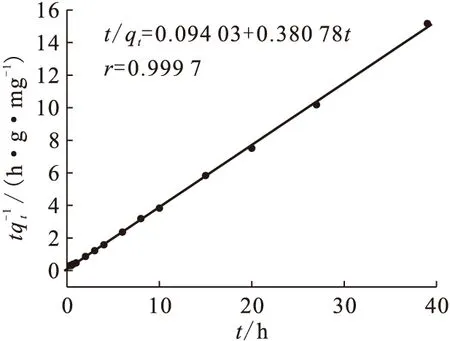
图5 假二级反应动力学线性拟合
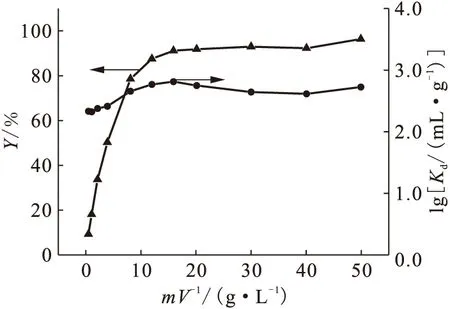
图6 Na-凹凸棒石用量(m/V)对吸附的影响
2.5 pH值、离子强度对吸附的影响
图7为不同浓度的背景电解质(NaCl)下pH对吸附的影响。由图7可知,在酸性范围内,U(Ⅵ)在Na-凹凸棒石上的吸附百分数随pH的增大而增大,随背景电解质浓度的增大而减小;而在碱性范围内,吸附百分数随pH的增大而减小,随背景电解质浓度的增大而增大。
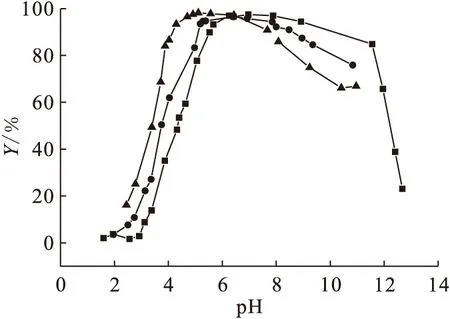
图7 不同浓度背景电解质下pH对吸附的影响
在液相中,凹凸棒石黏土表面的羟基官能团在不同pH值下会发生质子化或去质子化可逆反应:
pH<7.0时,随着NaCl浓度的增大,Na+对凹凸棒石表面位的吸附竞争效应增强,使得U(Ⅵ)的吸附下降;另外,离子强度增大,溶液的活度系数减小,导致U(Ⅵ)在溶液中的有效浓度减小[15]。所以,U(Ⅵ)在凹凸棒石上的吸附百分数随NaCl浓度的增大而减小。而当pH>7.0时,U(Ⅵ)在凹凸棒石上的吸附百分数随NaCl浓度的增大而增大,其原因有待进一步研究说明。
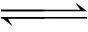
2.6 富里酸(FA)对吸附的影响
图8为富里酸(FA)对U(Ⅵ)在Na-凹凸棒石上吸附的影响。由图8可知,富里酸对吸附有明显的促进作用,这是由于富里酸(FA)含大量可与金属离子配位的羧基、醇羟基、酚羟基和酮羰基[16]。许多研究表明,在酸性条件下,吸附在黏土表面的FA可增加其表面的负电性,且提供大量的配位位点,因此FA可促进金属离子在黏土表面的吸附;但是在碱性条件下,带负电的黏土表面与FA产生静电排斥,使FA游离在液相中,而液相中的FA与金属离子可形成络合物,从而降低黏土表面对金属离子的吸附[17]。
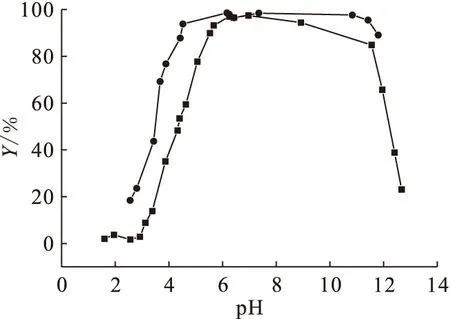
图8 FA对吸附的影响
2.7 温度对吸附的影响
(1)吸附等温线
采用Langmuir和Freundlich吸附模型对吸附等温线进行拟合,表达式如下:
Langmuir模型:
(5)
式中,qe为U(Ⅵ)在Na-凹凸棒石上吸附达平衡后的吸附量,ce为U(Ⅵ)在液相中的平衡浓度,qmax为最大吸附量,KL为Langmuir吸附平衡常数。
Freundlich模型:
(6)
式中KF、n为Freundlich吸附平衡常数。
由图9及表1可知,Langmuir和Freundlich的线性相关系数r均大于0.96,相对而言,Lang-muir模型能更好地拟合吸附结果,表明Na-凹凸棒石表面位点对U(Ⅵ)具有均一的吸附活性,且U(Ⅵ)在Na-凹凸棒石表面的吸附是单层吸附,已吸附的U(Ⅵ)不再与其他铀物种相作用。另外,富里酸的加入使得qmax增大(无FA时,qmax=1.47×10-5mol/g;ρ(FA)=20 mg/L时,qmax=2.44×10-5mol/g),说明富里酸能够促进Na-凹凸棒石对U(Ⅵ)的吸附。
图9 Langmuir(a)和Freundlich(b)吸附等温线

表1 Langmuir和Freundlich模型相关参数
(2)吸附-解吸等温线
(3)吸附热力学

3个热力学函数基本公式[19]如下:
(7)
(8)
(9)
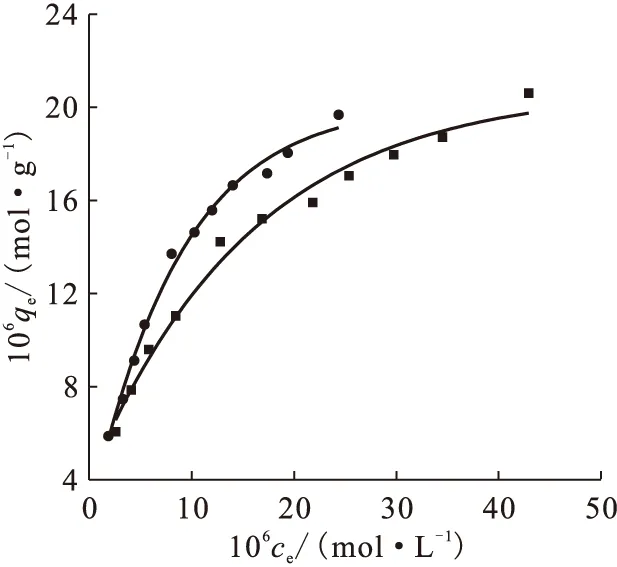
图10 吸附-解吸等温线

(10)
式中:qe为金属离子在吸附剂上吸附达平衡后的吸附量,mol/g;ce为金属离子在液相中的平衡浓度,mol/L。
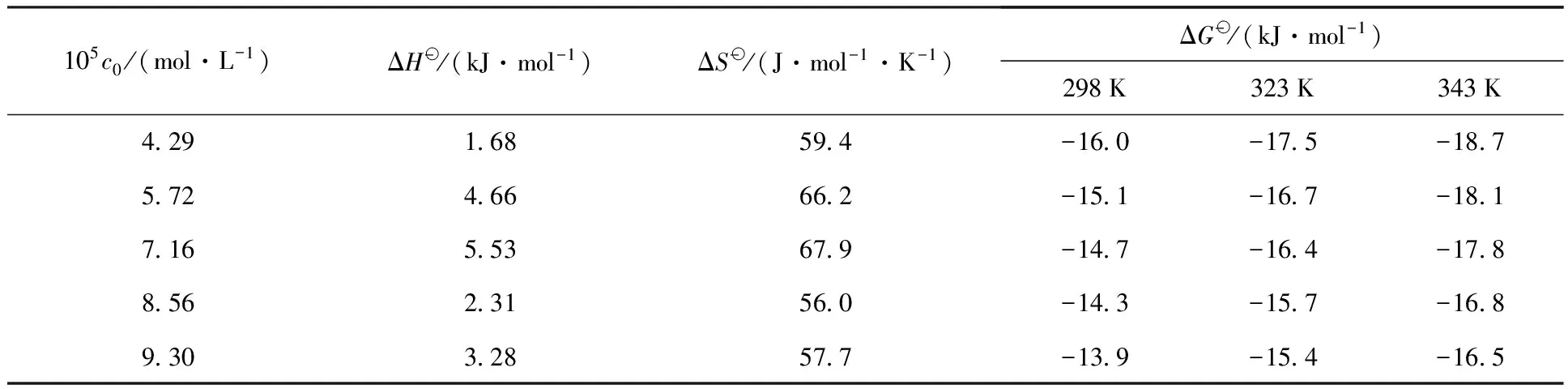
表2 U(Ⅵ)在Na-凹凸棒石粘土上的吸附热力学参数
3 结 论
(1)U(Ⅵ)在Na-凹凸棒石粘土上的吸附速率较快,其吸附动力学符合假二级动力学方程。
(2)在酸性条件下,背景电解质(NaCl)对U(Ⅵ)在Na-凹凸棒石上的吸附有抑制作用;而在强碱性条件下,背景电解质(NaCl)促进U(Ⅵ)在Na-凹凸棒石上的吸附。
(3)pH对吸附的影响强烈。在较低pH范围内,随着pH增大,U(Ⅵ)在凹凸棒石上的吸附量增大,吸附主要为离子交换或外层络合吸附;而在强碱性条件下,U(Ⅵ)在Na-凹凸棒石上的吸附随着pH增大而减小,吸附以内层络合及静电作用为主。富里酸的存在能促进U(Ⅵ)的吸附。
(4)温度的升高有利于Na-凹凸棒石对U(Ⅵ)的吸附,且该吸附过程是吸热的、自发的不可逆过程。
[1]Chisholm J E.An X-Ray Powder-Diffraction Study of Palygorskite[J].Can Mineral,1990,28:329-339.
[2]Chiari G,Giustetto R,Ricchiardi G.Crystal Structure Refinements of Palygorskite and Maya Blue From Molecular Modelling and Powder Synchrotron Diffraction[J].Eur J Miner,2003,15:21-33.
[3]Fan Q H,Shao D D,Hu J,et al.Comparison of Ni2+Sorption to Bare and ACT-Graft Attapulgite:Effect of pH,Temperatures and Foreign Ions[J].Surf Sci,2008,602:778-785.
[4]Alvarez-Ayuso E,García-Snchez A.Palygorskite as a Feasible Amendment to Stabilize Heavy Metal Polluted Soils[J].Environ Pollut,2003,125:337-344.
[5]Fan Q H,Li P,Chen Y F,et al.Preparation and Application of Attapulgite/Iron Oxide Magnetic Composites for the Removal of U(Ⅵ)From Aqueous Solution[J].J Hazard Mater,2011,192(3):1 851-1 859.
[6]殷竟洲,杨文澜,夏士朋.壳聚糖改性凹凸棒土对重金属离子的吸附[J].化工环保,2007,27(3):276-279.
[7]Xu D,Wang X K,Chen C L,et al.Influence of Soil Humic Acid and Fulvic Acid on Sorption of Thorium(Ⅳ)on MX-80 Bentonite[J].Radiochim Acta,2006,94:429-434.
[8]Wu W S,Fan Q H,Xu J Z,et al.Sorption-Desorption of Th(Ⅳ)on Attapulgite:Effects of pH,Ionic Strength and Temperature[J].Appl Radiat Isot,2007,65:1 108-1 114.
[9]Pan B L,Yue Q F,Ren J F,et al.A Study on Attapulgite Reinforced PA6 Composites[J].Polym Test,2006,25:384-391.
[10] Ho Y S,McKay G.The Kinetics of Sorption of Divalent Metal Ions Onto Sphagnum Moss Peat[J].Water Res,2000,34:735-742.
[11] Anirudhan T S,Divya L,Suchithra P S.Kinetic and Equilibrium Characterization of Uranium(Ⅵ)Adsorption Onto Carboxylate-Functionalized Poly-Grafted Lignocellulosics[J].J Environ Manage,2009,90:549-560.
[12] Chang P P,Wang X K,Yu S M,et al.Sorption of Ni(Ⅱ)on Na-Rectorite From Aqueous Solution:Effect of pH,Ionic Strength and Temperature[J].Colloid Surf A,2007,302:75-81.
[13] Psareva T S,Zakutevrskgy O I,Chubar N I,et al.Uranium Sorption on Cork Biomass[J].Colloid Surf A,2005,252:231-236.
[14] Waite T D,Davis J A,Payne T E,et al.Uranium(Ⅵ)Adsorption to Ferrihydrite:Application of a Surface Complexation Model[J].Geochim Cosmochim Acta,1994,58:5 465-5 478.
[15] Han R P,Zou W H,Wang Y,et al.Removal of Uranium(Ⅵ)From Aqueous Solutions by Manganese Oxide Coated Zeolite:Discussion of Adsorption Isotherms and pH Effect[J].J Environ Radioact,2007,93:127-143.
[16] 吴景贵,席时权,姜岩.土壤腐殖质的分析化学研究进展[J].分析化学,1997,25:1221-1 227.
[17] 许君政,范桥辉,白洪彬,等.离子强度、温度、pH和腐殖酸浓度对Th(Ⅳ)在凹凸棒石上吸附的影响[J].核化学与放射化学,2009,31(3):179-185.
[18] Businelli M,Casciari F,Businelli D,et al.Mechanisms of Pb(Ⅱ)Sorption and Desorption at Some Clays and Goethite-Water Interfaces[J].Agron J,2003,23:219-225.
[19] Shahawi M S,Othman M A,Abdel-Fadeel M A.Kinetics,Thermodynamic and Chromatographic Behaviour of the Uranyl Ions Sorption From Aqueous Thiocyanate Media Onto Polyurethane Foams[J].Anal Chim Acta,2005,546:221-228.
[20] Aksu Z.Determination of the Equilibrium,Kinetic and Thermodynamic Parameters of the Batch Biosorption of Nickel(Ⅱ)Ions Onto Chlorella Vulgaris[J].Process Biochem,2002,38:89-99.
[21] Namasivayam C,Ranganathan K.Waste Fe(Ⅲ)/Cr(Ⅲ)Hydroxide as Adsorbent for the Removal of Cr(Ⅵ)Fromaqueous Solution and Chromium Plating Industry Wastewater[J].Environ Pollut,1993,82:255-261.
[22] Chen C L,Wang X L.Adsorption of Ni(Ⅱ)From Aqueous Solution Using Oxidized Multi-Walled Carbon Nanotubes[J].Ind Eng Chem Res,2006,45:9 144-9 149.
[23] Genc-Fuhrman H,Tjell J C,Mcconchie D.Adsorption of Arsenic From Water Using Activated Neutralized Red Mud[J].Environ Sci Technol,2004,38:2 428-2 434.
