不同电荷肿瘤乏氧显像剂的合成及生物分布
2012-01-04黄士堂王祥云褚泰伟
黄士堂,王祥云,褚泰伟
北京大学 化学与分子工程学院,放射化学与辐射化学重点学科实验室,北京分子科学国家实验室,北京 100871
组织乏氧是实体肿瘤化疗和放疗耐受的重要原因,对组织乏氧程度的深入了解将会对肿瘤的诊断和治疗提供便利[1-3]。硝基咪唑类化合物能够在细胞内酶(主要是黄嘌呤氧化酶)的作用下发生单电子还原,产生阴离子自由基。在正常细胞中,该中间体被迅速氧化成原化合物,扩散到细胞外;在乏氧细胞中,该中间体被进一步不可逆还原,与细胞内组分共价结合,并滞留在细胞内达到持续性摄取的效果。因而硝基咪唑类化合物被广泛用于靶向乏氧组织的药物载体[4-6]。影响乏氧组织摄取的因素有很多,例如化合物的脂溶性、分子大小、电荷性质以及氧化还原电位等[7-10]。电荷能够影响药物分子的溶解性、细胞穿透性、组织器官分配、细胞代谢以及体内清除[11-12]。因此,研究不同电荷性质的乏氧显像剂具有潜在的应用价值和一定的理论意义。
本工作拟选用容易被131I标记的酪氨酸分子骨架,偶联乏氧靶向基团2-硝基咪唑,再通过适当的修饰分别获得(S)-3-(4-羟基苯基)-2-(3-(2-硝基咪唑基)丙酰胺基)丙酸甲酯(NI-Y-M)、(S)-3-(4-羟基苯基)-2-(3-(2-硝基咪唑基)丙酰胺基)丙酸(NI-Y)和(S)-N-(3-胺丙基)-3-(4-羟基苯基)-2-(3-(2-硝基咪唑基)丙酰胺基)丙酰胺(NI-Y-A)等3种化合物,并进行131I标记,考察标记物的各种性质及其在荷瘤小鼠体内的生物分布。
1 实验部分
1.1 仪器和试剂
2-硝基咪唑、1,3-丙二胺和N,N-二异丙基乙胺(DIEA),比利时Acros 公司;1,3,4,6-四氯-3α,6α-二苯基甘脲(Iodogen),美国Sigma公司;L-酪氨酸甲酯盐酸盐(H-Tyr-OMe·HCl),吉尔生化(上海)有限公司;Na131I(无载体溶液)由中国原子能科学研究院提供。雄性昆明小鼠,(20±2)g,中国科学院动物所;S180细胞株由北京大学生命科学学院提供。丙烯酰氯参照文献[13]合成;三乙胺和1,3-丙二胺在使用前通过蒸馏纯化,其他试剂均为分析纯,并未作进一步纯化。
Bruker ARX-400核磁共振谱仪,Bruker-APEX Ⅳ傅里叶高分辨质谱(ESI-MS),瑞士Bruker公司;Waters 1525高效液相谱仪,美国Waters 公司;Radiomatic 500TR 液体闪烁计数器,美国Packard 公司;自动γ计数器,美国Perkin Elmer 公司;Simplicity 185 纯水仪,美国Milipore公司;CRC-15R放射性活度计,美国Capintec 公司;DY-W1型电泳仪,北京试验设备厂。
1.2 合成部分
三种2-硝基咪唑酪氨酸衍生物的合成路线示于图1,具体操作如下。
(1)(S)-2-丙烯酰胺基-3-(4-羟基苯基)丙酸甲酯 (2)
将2.31 g H-Tyr-OMe·HCl (0.010 mol)和4.0 mL Et3N(0.027 mol)溶于30 mL CH2Cl2,冰水浴下缓慢滴加0.89 mL丙烯酰氯(0.011 mol)后,室温下搅拌16 h。分别用1 mol/L HCl(20 mL×1)、饱和NaHCO3(20 mL×1)和饱和NaCl(20 mL×1)洗涤有机相,干燥,硅胶色谱柱分离,洗脱剂为石油醚和乙酸乙酯的混合溶剂(体积比为1∶1)。最终产品0.863 g,产率为34.6%。

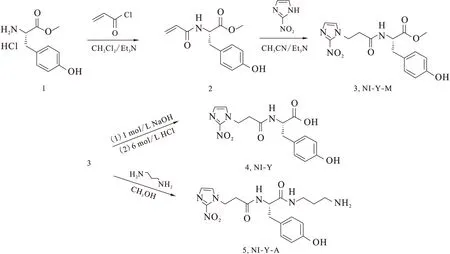
图1 酪氨酸衍生物的合成
(2)(S)-3-(4-羟基苯基)-2-(3-(2-硝基咪唑基)丙酰胺基)丙酸甲酯(NI-Y-M,3)
将0.045 g 2-硝基咪唑(0.398 mmol)和0.249 g化合物2(1.00 mmol)溶于3.0 mL Et3N/CH3CN(体积比为1∶1)中,加热回流36 h。旋干溶剂,硅胶色谱柱分离,梯度洗脱,洗脱剂为石油醚和乙酸乙酯的混合溶剂(体积比为2∶1~1∶1)。最终产品0.056 g,产率为38.8%。
1H NMR δ(DMSO-d6):9.24(1H,s,—C6H4—OH),8.41(1H,d,CO—NH—),7.40(1H,s,imi-H),7.12(1H,s,imi-H ),6.90(2H,d,—C6H4—),6.62(2H,d,—C6H4—),4.52(2H,t,imi-N—CH2—CH2—CO),4.32(1H,m,NH—CH—CO),3.56(3H,s,—OCH3),2.72(2H,m,CH—CH2—C6H4),2.68(2H,t,imi-N—CH2—CH2—CO)。高分辨质谱(ESI-MS)C16H19N4O6[ M+H ]+:m/z理论值为363.129 91,检测值为363.129 81。
(3)(S)-3-(4-羟基苯基)-2-(3-(2-硝基咪唑基)丙酰胺基)丙酸(NI-Y,4)
室温下,向0.049 g 化合物3(0.14 mmol)滴加1 mol/L NaOH溶液至全部溶解;5 min后,用6 mol/L HCl酸化至pH≈1,出现大量白色晶体,室温下静置12 h,过滤,洗涤。最终产品0.025 g,产率为53.1%。
1H NMR δ(DMSO-d6):12.65(1H,s,COOH),9.20(1H,s,—C6H4—OH),8.26(1H,d,CO—NH—),7.39(1H,s,imi-H ),7.09(1H,s,imi-H),6.91(2H,d,—C6H4—),6.62(2H,d,—C6H4—),4.51(2H,t,imi-N—CH2—CH2—CO),4.30(1H,m,NH—CH—CO),2.70(2H,m,CH—CH2—C6H4),2.67(2H,t,imi-N—CH2—CH2—CO)。高分辨质谱(ESI-MS)C15H17N4O6[ M+H ]+:m/z理论值为349.114 26,检测值为349.113 94。
(4)(S)-N-(3-胺丙基)-3-(4-羟基苯基)-2-(3-(2-硝基咪唑基)丙酰胺基)丙酰胺(NI-Y-A,5)
将0.056 g 化合物3(0.15 mmol)溶于2.0 mL甲醇,缓慢滴加0.5 mL 1,3-丙二胺(6.0 mmol),室温下搅拌6 h。旋干溶剂、过柱分离,洗脱剂为二氯甲烷和甲醇的混合溶剂(体积比为5∶1)。得最终产品0.045 g,产率为72.6%。
1H NMR δ(DMSO-d6):8.17(1H,d,CO—NH—CH),7.90(1H,t,CO—NH—CH2),7.33(1H,s,imi-H),7.08(1H,s,imi-H),6.92(2H,d,—C6H4—),6.61(2H,d,—C6H4—),4.51(2H,t,imi-N—CH2—CH2—CO),4.33(1H,m,NH—CH—CO),3.05(2H,m,NH—CH2),2.72(2H,m,CH—CH2—C6H4),2.67(2H,t,imi-N—CH2—CH2—CO),2.58(2H,m,CH2—CH2—CH2),1.40(2H,m,CH2—CH2—CH2)。高分辨质谱(ESI-MS)C18H25N6O5[ M+H ]+:m/z理论值为405.188 09,检测值为405.187 81。
1.3 标记物的制备及性质测定
根据文献[14-15],利用Iodogen作为氧化剂,从而分别得到[131I]NI-Y-M、[131I]NI-Y和[131I]NI-Y-A等3种碘标记化合物。以[131I]NI-Y-M的制备为例,方法如下:
将100 μg化合物3(NI-Y-M)溶于0.4 mL 0.20 mol/L磷酸盐缓冲溶液中(pH=7.0),然后转入已涂好100 μg Iodogen的0.5 mL的离心管中,再加入2.96 MBq Na131I,漩涡振荡5 min。静置20 min后,将反应物转移,终止反应。
通过HPLC分析标记物的放射化学纯度。采用高效液相系统配置Packard 500TR系列的放射性检测器,C-18反相柱(Agilent HC-C18.5 μm,4.6 mm×150 mm),梯度洗脱,流速为1 mL/min。流动相条件如下:溶剂A为95%水和5%甲醇,溶剂B为95%甲醇和5%水,溶剂A和溶剂B均含有0.1%的三氟乙酸(TFA),淋洗梯度列入表1。
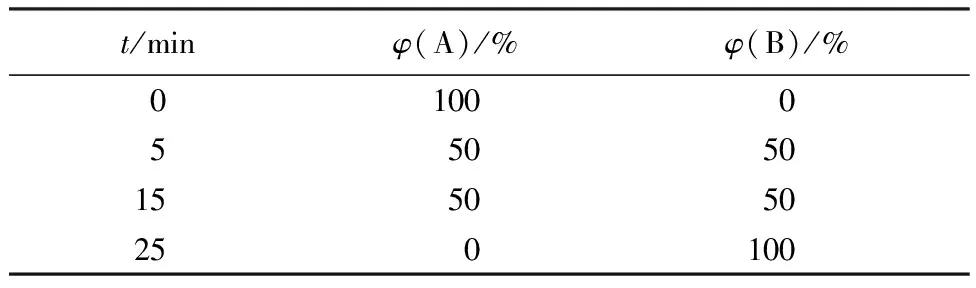
表1 流动相淋洗条件
将标记物的溶液室温放置24 h后测定标记率的变化。
取0.1 mL标记物于离心管中,分别加入4.0 mL正辛醇,4.0 mL 0.025 mol/L 磷酸盐缓冲溶液(pH=7.4),漩涡振荡2 min,离心5 min(3 000 r/min),分别取出水相和有机相各0.1 mL检测。根据有机相与水相的放射性活度比,求出相应的油水分配比PO/W,重复3次取平均值。
1.4 电泳实验
以0.050 mol/L、pH=7.4的磷酸盐缓冲液为电泳液,电泳载体为Whatman 3号滤纸条,长度20 cm,先用电泳液浸湿,再分别将3种标记物点在纸条中间,在200 V电压下电泳4 h。取出干燥后,将纸条剪成每段1 cm的小段,相同条件下检测每段纸条的放射性活度。
1.5 动物实验
健康雄性昆明小白鼠,体重(20±2)g,向其左侧腋部皮下移植约106个S180细胞。7~8 d后,肿瘤直径约10~15 mm。实验前三天喂食1% KI水溶液进行甲状腺封闭,实验时,分别取[131I]NI-Y-M、[131I]NI-Y和[131I]NI-Y-A标记液0.1 mL(约111 kBq),通过尾静脉注射到小鼠体内。在注射后1、2、4 h,从小鼠眼底取血后,断颈处死,每个时间点平行5只。剥离肿瘤、各脏器和组织,用水洗涤,拭干后称重,然后测量其放射性计数。0.1 mL的注射液被作为标准也测量其放射性计数,用来计算各器官的放射性摄取(%ID/g)。最后结果表示为(平均值±标准偏差)。
2 结果和讨论
2.1 化合物合成
实验中合成的化合物均通过1H NMR、ESI-MS检测。
在合成化合物2时,试剂丙烯酰氯是参照文献[13]的方法合成,活性高、易潮解,同时,由于酪氨酸的酚羟基也具有一定的活性,所以实验必须控制丙烯酰氯的滴加速度,不能过快。即使这样仍不能避免酚羟基副反应的发生,因而副反应的存在制约了目标化合物产率的提高。化合物3(NI-Y-M)的合成反应属于Michael 加成,反应条件比较苛刻,同时由于2-硝基咪唑溶解度的原因,最终所得产物NI-Y-M 产率较低。化合物4(NI-Y)的合成属于经典的酯类水解反应,实验方法简单易行,温和的水解条件既保证了目标产物的生成,又避免了酰胺键的断裂。对于化合物5(NI-Y-A),最初采用羧酸和胺的直接缩合反应,考虑到酪氨酸酚羟基的活性,选用温和的缩合试剂苯并三氮唑-1-氧三(二甲胺基)磷鎓六氟磷酸盐(BOP)。TLC监测显示,缩合反应的转化率高,但是由于反应体系生成的副产物影响NI-Y-A的分离提纯,后来尝试酯的氨解反应。实验发现,对于本反应体系,室温条件下反应能够顺利进行,反应较快、转化率高、分离方便。
2.2 标记物性质的测定
采用RP-HPLC法分析131I的标记物,标记结果示于图2。由图2可知:Na131I溶液以及Iodogen与Na131I 反应产物的保留时间均为1.8 min;[131I]NI-Y-M的保留时间为11.6 min;[131I]NI-Y的保留时间为9.8 min;[131I]NI-Y-A的保留时间为7.6 min。3种标记物的标记率均大于95%,室温下将标记物在空气中放置24 h后,其标记率仍大于95%。因而实验所得标记物具有很好的稳定性。
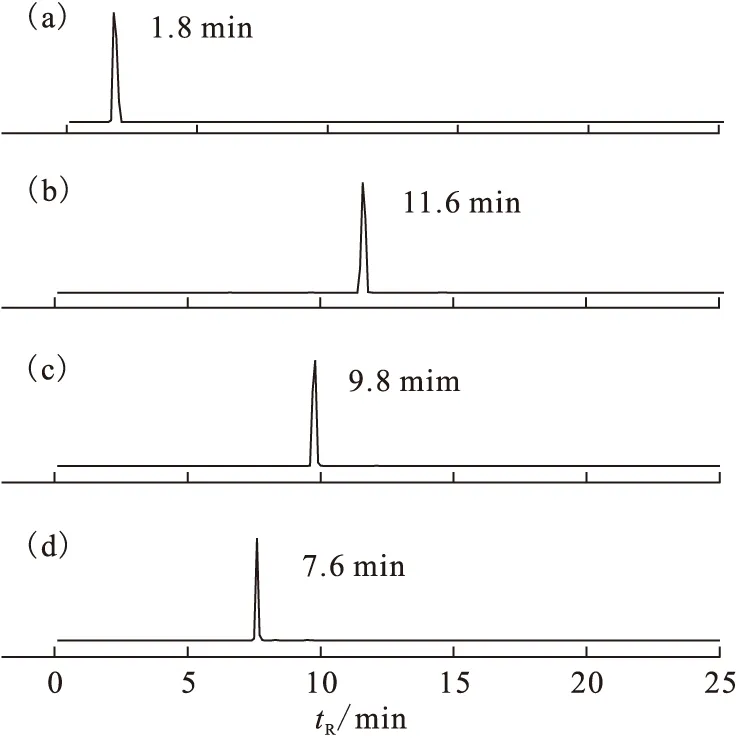
图2 131I-(a)、[131I]NI-Y-M(b)、[131I]NI-Y(c)和[131I]NI-Y-A(d)的RP-HPLC检测谱图
电泳实验的结果示于图3。由图3可知:对于[131I]NI-Y-M 几乎所有的放射性聚集在原点附近,而[131I]NI-Y、[131I]NI-Y-A分别不同程度的向正极和负极迁移。这说明在生理条件下(pH=7.4),标记物[131I]NI-Y-M不带电荷,[131I]NI-Y和[131I]NI-Y-A分别带负电和正电。
油水分配比的实验显示:[131I]NI-Y-M、[131I]NI-Y 和[131I]NI-Y-A 的lgPO/W分别为1.46±0.03(n=3)、-1.97±0.04(n=3)和-1.31±0.03(n=3),[131I]NI-Y-M具有高的脂溶性,[131I]NI-Y 和[131I]NI-Y-A亲水性较高。
2.3 生物分布结果
[131I]NI-Y-M、[131I]NI-Y 和[131I]NI-Y-A在荷S180肿瘤小鼠体内的生物分布结果列入表2。由表2可知,3种化合物在心、肌肉、脑、脾、肺等器官的放射性摄取低,并且清除较快,而在肿瘤部位则呈现出快摄取慢清除的趋势。因而在注射后随着时间的延长,肿瘤与肌肉放射性摄取的比值能持续维持在相对较高的水平。以4 h的数据为例,[131I]NI-Y-M的肿瘤与肌肉放射性摄取的比值上升至3.33,[131I]NI-Y为2.80,[131I]NI-Y-A为5.00。为了避免小鼠甲状腺对碘标记化合物的特异性摄取,实验采用1% KI水溶液喂食小鼠,从甲状腺的低摄取值可以确认甲状腺已经被成功封闭。
从表2还可发现,虽然3种化合物肿瘤的放射性摄取相对较高,但是由于它们不同的带电性质,导致在某些器官组织的摄取、代谢、清除存在明显的差异,肿瘤与这些器官组织的放射性比值差异较大。例如:4 h 时,[131I]NI-Y-M的肿瘤与血液放射性摄取的比值为0.48,[131I]NI-Y为0.68,[131I]NI-Y-A为1.43。具体而言,对于[131I]NI-Y-M,血液、肝脏、小肠等器官放射性摄取值高,这也可能与其高脂溶性有关;而对于[131I]NI-Y 和[131I]NI-Y-A,肾的放射性摄取值明显较高,这可能是由于它们的亲水性好的缘故。
Kim等[16]发现,以DO3A、DO2A或NOTA为双功能连接剂,以三苯基膦为靶向基团的64Cu的标记物电荷对其肿瘤特异性影响很大。带一个正电荷的64Cu(DO2A-xy-TPP)+比带2个正电荷、中性及带负电荷的其余5个标记物的肝摄取低,肿瘤/肝的摄取比高。本实验结果与他们的结论基本类似。
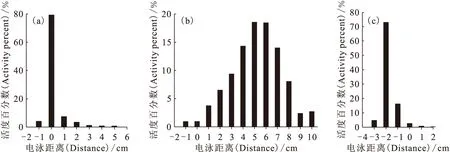
图3 [131I]NI-Y-M(a)、[131I]NI-Y(b)和[131I]NI-Y-A(c)电泳实验的检测谱图
综合以上的分析,可以确认带有不同电荷的化合物其在动物体内的分配、吸收摄取、代谢清除的情况存在不同。由于本实验仅选用一个母体分子(2-硝基咪唑的酪氨酸骨架),样本太少,目前还难以明确是否化合物电性的改变能够有效改善肿瘤对乏氧显像剂的摄取,但是对于本实验选定评价体系,从肿瘤与血液、肿瘤与肌肉放射性摄取的比值数据能够确认带正电的标记物[131I]NI-Y-A要优于中性的标记物[131I]NI-Y-M和呈现负电性的标记物[131I]NI-Y。

表2 [131I]NI-Y-M、[131I]NI-Y和[131I]NI-Y-A在荷瘤小鼠中的生物分布
3 结 论
合成了3种含有2-硝基咪唑的酪氨酸骨架结构化合物NI-Y-M、NI-Y 和NI-Y-A,并采用Na131I,以Iodogen为氧化剂,完成了化合物的标记。3种标记物的标记率均大于95%,室温下放置24 h稳定。电泳实验数据表明,同等条件下,标记物[131I]NI-Y-M为电中性,[131I]NI-Y和[131I]NI-Y-A分别带负电和正电。小鼠体内分布实验结果说明,在一定程度上具有不同电荷的化合物在体内的生物学行为存在不同。虽然所选评价体系的结果显示,带正电的标记物[131I]NI-Y-A具有最优的肿瘤与血液、肿瘤与肌肉放射性摄取的比值,但是限于实验评价体系样本太少,目前尚难以对电荷的影响得出明确的结论,仍需要进一步的研究和探索。
[1]Sun X,Chu T W,Wang X Y.Preliminary Studies of Tc-99m-BnAO and Its Analogues: Synthesis,Radiolabeling andinVitroCell Uptake[J].Nucl Med Biol,2010,37(2): 117-123.
[2]Mallia M B,Mathur A,Subramanian S,et al.A Novel [99Tcm≡N]2+Complex of Metronidazole Xanthate as a Potential Agent for Targeting Hypoxia[J].Bioorg Med Chem Lett,2005,15(14): 3 398-3 401.
[3]Chu T W,Li R J,Hu S W,et al.Preparation and Biodistribution of Technetium-99m-Labeled 1-(2-Nitroimidazole-1-yl)-Propanhydroxyimino Amide (N2IPA)as a Tumor Hypoxia Marker[J].Nucl Med Biol,2004,31(2): 199-203.
[4]Chu T W,Li Z J,Wang X Y.Synthesis and Biological Evaluation of Radioiodinated 2NUBTA as a Cerebral Ischemia Marker[J].Bioorg Med Chem Lett,2009,19(3): 658-661.
[5]Krohn K A,Link J M,Mason R P.Molecular Imaging of Hypoxia[J].J Nucl Med,2008,49: 129S-148S.
[6]Li Z J,Chu T W,Liu X Q,et al.Synthesis andinVitroandinVivoEvaluation of Three Radioiodinated Nitroimidazole Analogues as Tumor Hypoxia Markers[J].Nucl Med Biol,2005,32(3): 225-231.
[7]Brown J M,Workman P.Partition Coefficient as a Guide to the Development of Radiosensitizers Which are Less Toxic Than Misonidazole[J].Radiat Res,1980,82(1): 171-190.
[8]Su Z F,Ballinger J R,Rauth A M,et al.A Novel Amine-Dioxime Chelator for Technetium-99m: Synthesis and Evaluation of 2-Nitroimidazole-Containing Analogues as Markers for Hypoxic Cells[J].Bioconjug Chem,2000,11 (5): 652-663.
[9]Zhang X G,Su Z F,Ballinger J R,et al.Targeting Hypoxia in Tumors Using 2-Nitroimidazoles With Peptidic Chelators for Technetium-99m: Effect of Lipophilicity[J].Bioconjug Chem,2000,11(5): 401-407.
[10]Zhang G D,Yang Z,Lu W,et al.Influence of Anchoring Ligands and Particle Size on the Colloidal Stability andinVivoBiodistribution of Polyethylene Glycol-Coated Gold Nanoparticles in Tumor-Xenografted Mice[J].Biomaterials,2009,30(10): 1 928-1 936.
[11]Adams D J,Morgan L R.Tumor Physiology and Charge Dynamics of Anticancer Drugs: Implications for Camptothecin-Based Drug Development[J].Curr Med Chem,2011,18(9): 1 367-1 372.
[12]Prankerd R J.Critical Compilation of pKa Values for Pharmaceutical Substances[M].Elsevier Academic Press: San Diego,2007,33: 1-33.
[13]Stempel G H,Cross R P,Mariella R P.The Preparation of Acrylyl Chloride[J].J Am Chem Soc,1950,72(5): 2 299-2 300.
[14]Farah K,Farouk N.Electrophilic Radioiodination of Tyrosine Derivatives[J].J Labelled Compd Radiopharm,1998,41(4): 255-259.
[15]Seevers R H,Counsell R E.Radioiodination Techniques for Small Organic-Molecules[J].Chem Rev,1982,82(6): 575-590.
[16]Kim Y S,Yang C T,Wang J,et al.Effects of Targeting Moiety,Linker,Bifunctional Chelator,and Molecular Charge on Biological Properties of64Cu-Labeled Triphenylphosphonium Cations[J].J Med Chem,2008,51(10): 2 971-2 984.
