2株嗜碱性放线菌的分离鉴定及特性研究
2012-01-02余金辉阿不都克里木热依木魏艳红莫小妍陈湖星袁永泽刘德立
熊 鹰,余金辉,阿不都克里木·热依木,魏艳红,李 逸,莫小妍,陈湖星,袁永泽,刘德立*
(1.华中师范大学 生命科学学院 遗传调控与整合生物学重点实验室,武汉 430079;2.新疆师范大学 生命科学与化学学院,乌鲁木齐 830054)
2株嗜碱性放线菌的分离鉴定及特性研究
熊 鹰1,余金辉1,阿不都克里木·热依木2,魏艳红1,李 逸1,莫小妍1,陈湖星1,袁永泽1,刘德立1*
(1.华中师范大学 生命科学学院 遗传调控与整合生物学重点实验室,武汉 430079;2.新疆师范大学 生命科学与化学学院,乌鲁木齐 830054)
从新疆巴洲和硕县碱性土壤中分离纯化出2株放线菌菌株XJ-1和XJ-4,对其形态特征、生理生化特性、抗生素产生以及16SrRNA基因序列分析等方面进行了多种特性研究.结果表明.2株放线菌在pH7.0的中性条件下不能生长,在pH12.0的强碱性条件下能够生长,最适生长pH为10.0,属于嗜碱性放线菌.2株放线菌菌株能耐受10%的NaCl,最高耐受温度为45℃.菌株XJ-1产生抗生素,能抑制柑橘绿霉菌、水稻轮纹菌、棉花枯萎菌和小麦赤霉菌的生长.16SrRNA基因同源性分析表明XJ-1属于拟诺卡氏菌属的Nocardiopsis dassonvillei,序列相似性达到了99.9%.而XJ-4与Nocardiopsis.sp.AF-333的序列相似性达到了99.3%,有可能是一新种.
嗜碱性放线菌;分离;鉴定;抗生素
放线菌作为生物活性物质的主要产生菌之一早已成为人们研究的焦点.嗜碱性放线菌作为极端环境放线菌的特殊类群,它们形成极为特殊的生理机制,并产生特殊的代谢产物,如特殊的酶类(耐热酶、碱性酶等)及各种有生物活性的物质,如抗生素及酶的抑制剂等,具有广泛的应用价值[1-5].同时,它们必然具有独特的基因类型,在生命进化及系统发育等研究中具有重要的理论意义[6-7].
目前人们所知道的微生物的种类约占实际总数的1%~10%,而对极端环境下微生物的认识则更加缺乏,目前国际上对极端环境放线菌的研究也很少[8].我国新疆地区广泛分布着重盐碱环境,这些天然环境资源为我们研究其中的放线菌提供了得天独厚的条件.本研究从我国新疆巴洲和硕县采集样品,进行了放线菌的分离和筛选,并对分离到的菌株进行了形态和生理生化、耐碱性和耐盐性、产特殊抑菌活性物质、16SrRNA序列分析等方面的研究,采用多相分类技术对其分类地位进行了最终确定.
1 材料和方法
1.1 菌株来源
从新疆巴洲和硕县碱性土壤中采集样品,适当处理后,采用添加50mg/L重铬酸钾的HV琼脂培养基[9]和高氏一号培养基进行菌种分离,30℃培养5~7d,共分离出20多株碱性放线菌菌株,进一步筛选出2株嗜碱性菌株,编号为XJ-1和XJ-4.
1.2 主要仪器和试剂
PCR扩增仪(美国生科公司)、凝胶成像系统(Bio-Rad)、连接仪(美国polyscience)、光学显微镜(Nicon)、pH510台式pH 计(EUTECH)、5415R 小型高速冷冻离心机(德国eppendorf);DNA聚合酶、dNTP、pMD18-T载体、EcoR I和 HindⅢ酶(TaKaRa公司).
1.3 培养基
Bennett培养基:葡萄糖10g,酶解酪素2g,酵母浸膏1g,牛肉膏1g,蒸馏水1 000mL.
高氏一号琼脂培养基:可溶性淀粉20.0g,K2HPO40.5g,MgSO4·7H2O 0.5g,KNO31.0g,FeSO4·7H2O 0.01g,NaCl 0.5g,琼脂18g,蒸馏水1 000mL.
察氏培养基:NaNO33.0g,K2HPO41.0g,MgSO4·7H2O 0.5g,NaCl 0.5g,FeSO4·7H2O 0.01g,
蔗糖30g,琼脂18g,蒸馏水1 000mL.
燕麦粉酵母膏培养基:燕麦粉20g,酵母浸膏lg,琼 脂 18g,微量盐溶液1.0mL,蒸馏水1 000mL.(微量盐溶液配方:FeSO4·7H2O 0.1g,MnCl2·4H2O 0.1g,ZnSO40.1g,蒸馏水1 000mL)
无机盐淀粉琼脂:淀粉10g,(NH4)2SO42g,K2HPO41g,CaCO33g,NaCl 1g,琼脂18g,蒸馏水1 000mL.
马铃薯浸汁琼脂培养基(PDA):马铃薯块200g(削皮称量,水煮30min,然后过滤得清滤液,补足水),蔗糖20g,NaCl 10g,琼脂18g.
碳源利用基础培养基(CM无碳培养基):KCl 0.2g,(NH4)2HPO41g,MgSO4·7H2O 0.2g,琼脂18g,蒸馏水1 000mL.
酪氨酸琼脂培养基(黑色素产生实验):L一酪氨酸l.0g,酵母浸汁1.0g,NaCl 8.5g,琼脂18g,蒸馏水1 000mL.
黄豆粉浸汁培养基:可溶性淀粉5.0g,蔗糖10.0g,蛋白胨2.0g,酵母膏2.0g,NaCl 10.0g,K2HPO40.5g,MgSO4·7H2O 0.5g,CaCO31.0g,琼脂18g,2%黄豆粉浸汁1 000mL.
以上培养基均调 pH 为 9.0,121℃ 灭菌30min.
1.4 形态和培养特征观察
将放线菌菌株XJ-1和XJ-4接种到燕麦片琼脂培养基、察氏琼脂培养基、营养琼脂培养基、高氏一号培养基、马铃薯浸汁琼脂培养基和无机盐淀粉琼脂培养基上(培养基均调节pH为10),30℃培养14d,观察其宏观形态特征,包括菌落形态、基丝颜色、气丝颜色、孢子形状、孢子链特征、有无可溶性色素等.用燕麦片琼脂培养基埋片培养,30℃培养21d后取埋片,光学显微镜观察其微观形态特征.
1.5 生理生化特性
按Shirling和Gottlieb[10]等人的方法进行生理生化特性研究.观察并记录碳源的利用、酶类产生、黑色素产生等特征.
NaCl耐受实验:ISP5作为基础培养基,调节pH为9.0,添加NaCl浓度分别为:0%、2%、4%、6%、8%、10%、12%.培养基与盐分别灭菌后充分混匀,倒平板,30℃条件下培养21d.每3~5d观察记录,重复2次[10].
温度耐受实验:高氏一号琼脂作为基础培养基调节,调节pH为9.0.不同温度条件下培养30d,每2~3d观察记录,重复2次.
pH耐受实验:ISP5作为基础培养基,pH分别为 6.0、7.0、8.0、9.0、10.0、11.0、12.0.30℃条件下培养21d,每1~2d观察并记录,重复4次.
1.6 抗生素测定
1.6.1 供试菌 棉花枯萎菌(Fusariumoxysporum),水稻纹枯菌(Rhizoctonia solani),小麦赤霉病菌(Fusarium raminearum),苹果轮纹菌(Macrophoma kuwatsukai),柑橘绿霉菌(Penicillium digitatum),玉米黑粉菌(Ustilago maydis).
1.6.2 放线菌产生的特殊抑菌活性物质的测定
采用琼脂块法[11]对放线菌产生的特殊抑菌活性物质进行测定.将放线菌菌株接种在黄豆粉浸汁琼脂培养基平板上涂布均匀,28℃恒温培养7d.用打孔器(直径8.0mm)在皿内菌落生长均匀的地方打孔,制备琼脂块以备用.将供试菌(棉花枯萎菌、水稻纹枯菌、小麦赤霉病菌、苹果轮纹菌、柑橘绿霉菌和玉米黑粉菌)悬液涂布于PDA平板上备用.然后将制备好的琼脂块用无菌镊子挑出,反面放置于制备好的供试菌PDA平板上,放置于28℃恒温培养箱培养3d观察并测量抑菌圈直径大小,进行结果记录.用抑菌圈直径大小表示放线菌对病原菌拮抗作用的强弱.
1.6.3 抑制菌丝生长速率测定 对有抑制圈的菌株采用抑制菌丝生长速率法[12-13]进一步测定对于菌丝的抑制作用.黄豆粉浸汁培养基液体发酵有抗性菌株放线菌,取培养7d的发酵液1mL和9mLPDA混匀倒平板,制成带毒培养基,以蒸馏水代替发酵液为对照.用直径为8.0mm的打孔器在培养好的供试菌菌落边缘切下菌饼反接于带毒培养基和对照培养基,30℃培养3d,用十字交叉法测量菌落直径,用下列公式计算菌丝生长抑制率:

1.7 16SrRNA基因序列确定与分析
1.7.1 总DNA的提取及16SrRNA基因扩增总DNA的提取参考Kutchma A.J的方法[14]并加以改进.16SrRNA基因的扩增与克隆参照分子克隆手册进行.PCR扩增采用以下引物:P1∶5’AGAGTTTGATCCTGGCTCAG 3’;P2∶5’GGTTACCTTGTTA CGACTT3’.反应条件为:95℃变性30s,54℃退火30s,72℃延伸31min 30s,共30个循环,72℃延伸5min.PCR产物用1%的琼脂糖凝胶电泳检测.
1.7.2 16SrRNA基因序列测定及分析 利用胶回收试剂盒回收PCR产物,与pMD18-T进行连接,反应体系为10μL(T载体1μL,PCR产物5μL,连接缓冲液4μL),16℃连接过夜.取10μL连接反应液转化E.coli DH5α感受态细胞,涂布在含氨苄青霉素的LB平皿上,37℃培养过夜挑选单克隆继续培养后提质粒,利用限制性内切酶EcoR I/HindⅢ双酶切以及EcoRⅠ单酶切验证.取经酶切鉴定后的阳性克隆,送上海英俊生物技术有限公司测序.据测序结果,利用Blast软件从GenBank数据库中搜索相关放线菌菌株的16S rRNA序列,随后用mega软件进行多序列比对以及构建系统进化树和同源性比较.
2 结果
2.1 菌株XJ-1和XJ-4的形态和培养特征
菌株XJ-1和XJ-4在燕麦片琼脂培养基上生长最好,马铃薯浸汁琼脂、高氏一号琼脂、察氏琼脂培养基上生长适中,无机盐淀粉琼脂、营养琼脂培养基上生长均较差,在所有培养基上都无可溶性色素产生.菌株XJ-1的气生菌丝和基内菌丝均较丰富,气生菌丝主要呈黄白色系,基内菌丝主要呈现棕色色系.基内菌丝纤细分支,孢子链呈现短串状,较伸直,螺旋缠绕很少(图1a),孢子椭圆形.菌株XJ-4气生菌丝较稀少,主要呈粉白色系,气生菌丝上着生长短不一的孢子链(图1b),伸直或螺旋缠绕,孢子椭圆形.基内菌丝稀少分支,颜色较单一,基本为黄棕色.菌株XJ-1和XJ-4的培养特征见表1.

图1 菌株XJ-1和XJ-4在燕麦片琼脂培养基上培养的光镜照片(×1 000)Fig.1 Morphological characteristics of strains XJ-1和 XJ-4on Oatmeal agar medium

表1 2株嗜碱性放线菌菌株的培养形态特征Tab.1 Cultural characteristics of two basophilic actinomycosis
2.2 菌株XJ-1和XJ-4的生理生化特性
两株嗜碱性放线菌菌株的生理生化特性见表2.两株放线菌菌株的大部分生理生化特征很相似,只是在个别糖类利用方面有区别.两株放线菌菌株碳源利用谱均不宽,产生卵磷脂酶,水解淀粉,纤维素分解呈阴性.均不产生黑色素和硫化氢,牛奶凝固和胨化强.菌株XJ-1的明胶液化呈阳性,而菌株XJ-4的明胶液化呈阴性.
两株嗜碱性放线菌菌株的NaCl耐受实验结果表明,菌株XJ-1和XJ-4的最高耐盐程度均为10%,属于轻度耐盐菌.两株放线菌菌株最适生长温度均为37℃,最高耐受温度为45℃,最适生长pH为10.0,在中性pH条件下不能生长,属于嗜碱性放线菌.两株嗜碱性放线菌菌株部分生理生化特性见表2.

表2 2株嗜碱性放线菌菌株部分生理生化特性Tab.2 Physiological and biochemical properties of two basophilic actinomycosis

续表2
2.3 菌株XJ-1和XJ-4的16SrRNA序列分析
菌株XJ-1的16SrRNA核苷酸序列长度为1 500bp,XJ-4的16SrRNA核苷酸序列长度为1 501bp.以上2株嗜碱性放线菌菌株的16SrRNA核苷酸序列已被GenBank注册,XJ-1和XJ-4的注册号分别为EU882851和EU882852.
将这两株嗜碱性放线菌的16SrRNA序列在NCBI中进行Blast比对,利用比对结果从Gen-Bank数据库收集其它放线菌菌株的16SrRNA相应序列,运用MEGA软件Clustal W进行多序列比对分析,按照Neighbor-joining法构建系统进化树(图2).如图2所示,XJ-1属于拟诺卡氏菌属,它与拟诺卡氏菌属的Nocardiopsis.dassonvillei聚为同一支,进化距离最近,利用DNAMAN软件比对其序列相似性达到了99.9%.XJ-4也属于拟诺卡氏菌属,它与Nocardiopsis.sp.AF-333的进化距离最近,同样利用DNAMAN软件比对其序列相似性达到了99.3%.
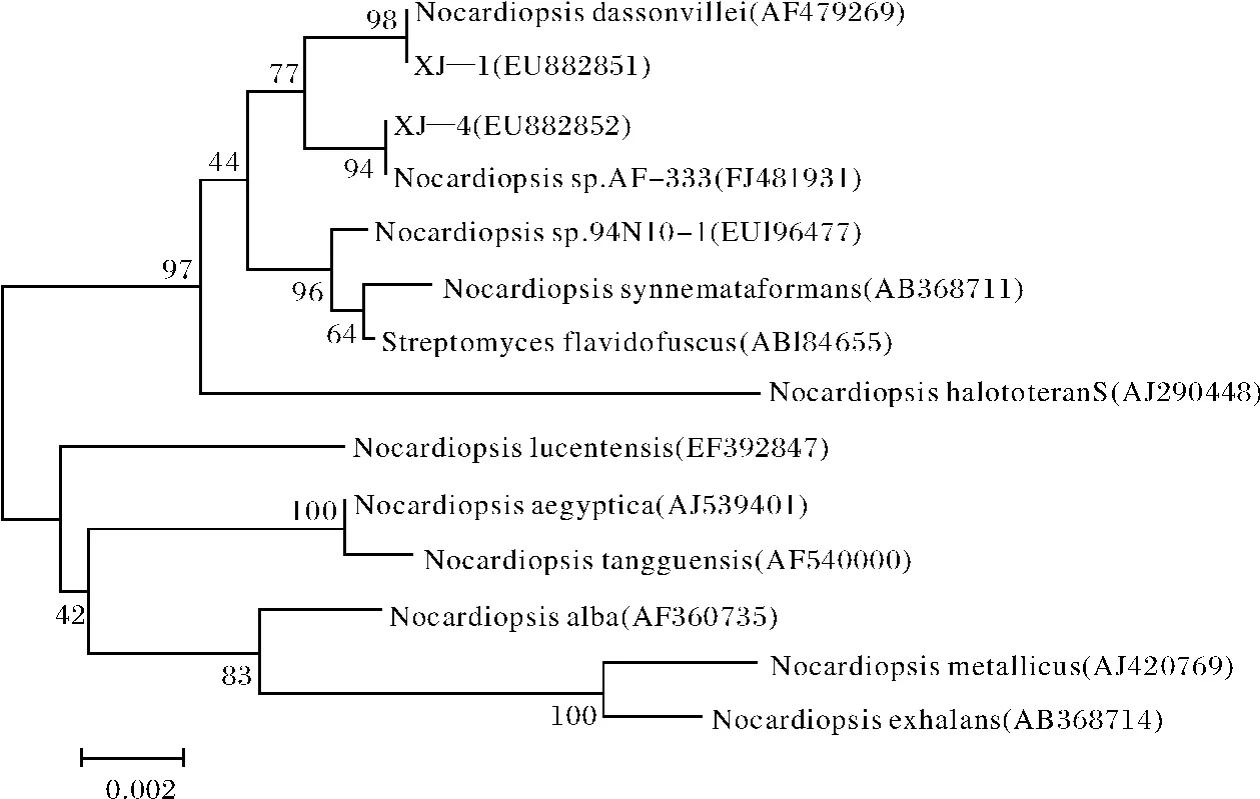
图2 基于16SrRNA序列用Neighour-joining方法构建的系统进化树状图Fig.2 Phylogenetic tree showing the relationships among type strains and experimental strains based on 16SrRNA sequences with Neighour-joining method
2.4 菌株XJ-1和XJ-4产生的抗生素活性分析测定结果
碱性放线菌XJ-1可以产生抗生素,该菌株对于柑橘绿霉菌、水稻轮纹菌、棉花枯萎菌、小麦赤霉菌四种植物病原菌均有一定的抗性作用,其中对于抑制柑橘绿霉菌的抑制作用最为明显,尤其是抑制柑橘绿霉菌的孢子生长比较有效.通过抑制菌丝生长速率法进一步测定了XJ-1菌株发酵液对于以上4种植物病原菌的抑制作用.表3为XJ-1菌株对于植物病原菌的抑菌圈直径(抑菌圈直径=水解圈直径-菌饼直径)以及抑制率.XJ-4没有检测到抗生素活性.
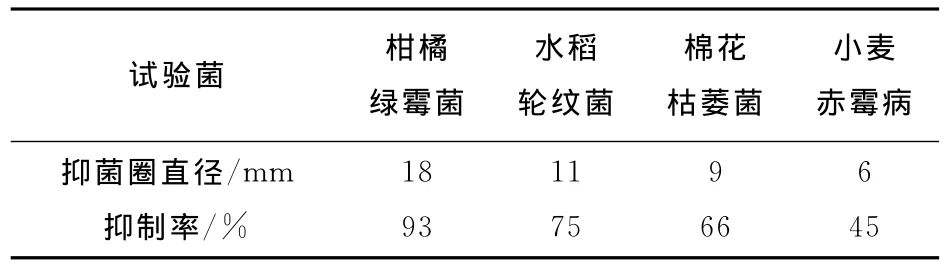
表3 XJ-1菌株的抗菌性能Tab.3 Antibiotic activities of strain XJ-1
3 讨论
综合以上2株嗜碱性线菌菌株的形态和培养特征、生理生化特性以及其16SrRNA序列分析,再结合构建的进化树分析发现:XJ-1具备拟诺卡氏菌属的基本特征,而且其与Nocardiopsis das-sonvillei的序列相似性达到了99.9%,所以初步确定其属于拟诺卡氏菌属的Nocardiopsis dassonvillei.而XJ-4与Nocardiopsis.sp.AF-333聚为1支,序列同源性达到了99.3%,运用DNAMAN软件将其于拟诺卡氏菌属的其他已知种进行了一系列比对分析,发现该菌株的16SrRNA序列和拟诺卡氏菌属已知种的序列相似性比对均大于2%,与尼诺卡式菌属的未知种Nocardiopsis.sp.AF-333的序列同源性最大,推断其可能是一新种.
柑橘绿霉菌是致柑橘采后发生贮藏病害的主要致病菌,其生命力非常旺盛,尤其是其孢子增殖能力很强,即使在恶劣条件下也能快速繁殖.据统计,由于青霉病和绿霉病的感染柑橘采后损失为30%~50%[15].目前有效的防治技术是使用大量的化学杀菌剂[16].但长期使用杀菌剂,易导致病菌产生抗药性,也可能导致农药残留量对人体有害.生物防治对其是一个有效的途径,分离鉴定的XJ-1放线菌菌株对于柑橘绿霉菌的抑制作用,可以进一步研究以生物制剂代替化学防腐保鲜剂,有较强的现实意义.
[1]Bahn Y S,Park J M,Bai D H,et al.YUA001,a novel aldose reductase ingihitor isolated from alkalophilic Corynebacteriumsp YUA25.Taxonomy,fermentation,isolation and characterization[J].J Antibiot,1998,51(10):902-907.
[2]Krulwich T A,Guffanti A A.Alkalophilic bacteria[J].Annu Rev Microbiol,1989,26:663-677.
[3]赵邑尘,薛泉宏,白 霜,等.青海高寒地区油菜地土壤中放线菌组成及拮抗性放线菌研究[J],西北农林科技大学学报:自然科学版,2009,37(7):176-182.
[4]韩立荣,孙平平,张 宁,等.油菜菌核病生防放线菌的分离与筛选[J].安徽农业科学,2011 39(5):2668-2670.
[5]安登第,陈玉梅,李 进,等.银沙槐内生放线菌抗菌活性及其与内生细菌的拮抗关系[J].应用生态学报,2010,21(4):1021-1025.
[6]姜 怡,李文均,徐 平,等.盐碱环境放线菌多样性研究[J].微生物学报.2006,46(2):191-195.
[7]陈森洲,刘 菁,陈建宏,等.红树林海洋淤泥中放线菌的分离与鉴定[J],贵州农业科学,2011,39(2):110-113.
[8]刘志恒,姜成林.放线菌现代生物学与生物技术[M].北京:科学出版社,2004.
[9]Hayakawa M,Nonomura H.Humic acid vitamin agar,a new medium for the selective isolation of soil actinomycetes[J].Fermemt Technol,1987,65:501-509.
[10]Shirling E B,Gottlieb D.Methods for characterization of Streptomyces species[J].Int J Syst Bacteriol,1966,16:313-340.
[11]马海丹,周文明,吴绍东.拮抗放线菌 M18的分离鉴定及杀菌活性研究[J].西北农业学报,2007,16(5):291-294.
[12]刘晓妹,陈秀蓉,蒲金基.两株芽孢杆菌无菌液抗菌谱及稳定性测定[J].中国生物防治,2003,19(3):141-143.
[13]申端玉,魏少鹏,姬志勤,等.放线菌A19菌株次生代谢产物的初步研究[J].西北农林科技大学学报:自然科学版,2008,36(1):173-178.
[14]Kutchma A J,Roberts M A,Knaebel D B,et al.Smallscale isolation of genomic DNA from Streptomyces mycelia of spores[J].BioTech,1998,24:452-457.
[15]邓伯勋.园艺产品贮藏运销学[M].北京:中国农业出版社,2002.
[16]Spadaro D,Gullino M L.State of the art and future prospects of the biological control of postharvest fruit diseases[J].International Journal of Food Microbiology,2004,91:185-194.
Isolation,identification and characterization of two basophilic actinomycosis
XIONG Ying1,YU Jinhui1,Abdukerim Rehim2,WEI Yanhong1,LI Yi1,MO Xiaoyan1,CHEN Huxin1,YUAN Yongze1,LIU Deli1
(1.College of Life Science,Laboratory of Genetic Regulation and Integrative Biology,Huazhong Normal University,Wuhan 430079;2.College of Life Science and Chemistry,Xinjiang Normal University,Urumqi 830054)
Two actinomycete strains XJ-1and XJ-4were isolated from the alkaline soil of Shuo County and BaZhou County in Xinjiang Province.Based on the morphology,physiological and biochemical characteristics,antibiotics production and 16SrRNA gene sequence analysis,the results showed that the optimum growth pH of these two basophilic actinomycosis was 10.0;they could not grow in the neutral conditions of pH7.0 and could grow in the strong alkaline conditions of pH12.0.Two actinomycete strains had a tolerance of 10%NaCl and the highest tolerance of temperature were 45℃.XJ-1 was able to produce antibiotics.It could obviously inhibit the growth of Penicillium digitatum,but also inhibit the growth of Rhizoctonia solani,Fusariumoxysporum and Fusarium raminearum.XJ-1was preliminarily determined to be the Nocardiopsis dassonvillei,their sequence similarity reached 99.9%.The homology of the 16SrDNA sequences of strain XJ-4with Nocardiopsis.sp.AF-333was more than 99.0%,so the strain XJ-4maybe a new species belonged to the basophilic actinomycetes.
basophilic actinomycosis;isolation;identification;antibiotics.
Q93
A
1000-1190(2012)05-0596-05
2012-02-21.
湖北省科技攻关项目(2007AA301C26,2007AA201C50);教育部博士点基金项目(20060511002).
*通讯联系人.E-mail:deliliu2002@yahoo.com.cn.
