一种有效区分移植细胞和宿主细胞脑损伤模型的建立
2011-12-25杨上川董锦润瞿家桂胡新天王正波
杨上川, 董锦润, 瞿家桂,3, 胡新天,, 王正波,
(1. 中国科学院生物物理研究所 脑与认知国家重点实验室, 北京 100101; 2 .中国科学院昆明动物研究所,云南 昆明 650223; 3. 中国科学技术大学 生命科学学院, 安徽 合肥 230026)
一种有效区分移植细胞和宿主细胞脑损伤模型的建立
杨上川1,2, 董锦润1,2, 瞿家桂1,2,3, 胡新天1,2,*, 王正波1,2,*
(1.中国科学院生物物理研究所 脑与认知国家重点实验室,北京100101; 2 .中国科学院昆明动物研究所,云南 昆明650223; 3.中国科学技术大学 生命科学学院,安徽 合肥230026)
为了区分移植神经细胞和宿主细胞, 便于将来在宿主体内对移植细胞进行在体的电生理记录以及其它方面的研究, 通过机械损毁的方法, 建立了一种特殊的脑损伤模型。结果发现, 通过机械损毁的方法, 在大鼠大脑皮层形成形态规则的损伤空洞, 其模型稳定, 重复性好; 在空洞内进行干细胞移植, 能够长时间存活, 移植神经干细胞绝大部分细胞分化为神经元, 只有少量细胞分化为胶质细胞, 而且移植细胞与宿主细胞分界明显; 对移植细胞进行单细胞电生理记录, 记录到神经元放电信号。这些结果表明, 通过机械损毁的方法, 在大鼠大脑皮层成功建立了一个稳定、精确定位移植细胞与宿主细胞界限的脑损伤模型。
机械损毁法; 移植细胞; 宿主细胞;神经干细胞; 脑损伤
神经系统性疾病, 包括变性疾病、脑卒中后遗症等多为大量神经元缺失, 致使中枢神经系统损伤后结构和功能难以恢复, 严重影响了患者的生活质量。随着对神经干细胞研究的深入, 揭示神经干细胞能够分化成为神经元并促进脑组织结构和功能的恢复, 越来越多的研究者热衷于细胞替代治疗神经损伤。
当前的研究表明, 神经干细胞不仅能在宿主中枢系统中存活、迁移, 并分化成几乎所有已知类型的神经元(Gage, 2000; Temple, 2001; Wennersten et al, 2004; Alvarez-Dolado et al, 2006; Makri et al, 2010), 而且能和宿主的神经元建立突触联系(Lundberg et al, 1997; Gaillard et al, 2007)。另外, 神经干细胞在治疗某些神经疾病方面已取得明显进展, 向中枢损伤疾病模型动物直接移植干细胞可以明显改善被试动物的症状(Svendsen et al, 1997; McDonald et al, 1999; Englund et al, 2002b; Riess et al, 2002; Ikeda et al, 2005; Cui et al, 2008; Morita et al, 2008; Ideguchi et al, 2010)。但也有研究者认为,这些改善也许来自神经系统自身的代偿功能, 也许是移入的干细胞促进了残存神经元的功能恢复(Lu et al, 2003)。移植存活并有突触形成的神经干细胞并没有起作用, 因为脑内大部分的突触是处在没有功能的状态。解决这一争议的最有效方法是利用电生理记录技术直接检测移植神经元是否参与了脑内信息的传递。目前对移植细胞进行电生理检测主要采取脑片离体电生理的方法(van Praag et al, 2002; Benninger et al, 2003; Rüschenschmidt et al, 2005; Sørensen et al, 2005; Ding et al, 2006), 该方法对于检测移植细胞在宿主体内的功能状态还有一定差距。当前对移植细胞进行在体电生理记录最大的难题是如何找到移植进去的细胞。本实验拟通过机械损毁的方法, 建立一个便于区分宿主细胞和移植细胞的脑损毁模型。
1 材料与方法
1.1 脑皮层损毁实验及电生理记录装置
自制外径18 Gauge的不锈钢导管和导管持握器; 不锈钢硬脑膜切刀和硬脑膜切刀支架; 不锈钢空洞侧壁切刀和空洞底面切刀; 直径0.8 mm的不锈钢空洞塞和0.8 mm的不锈钢细胞悬液塞, 以及外径21 Gauge不锈钢细胞移植注射器。国产M1.2不锈钢平底螺钉; 自凝牙托粉和牙托水; 大鼠脑立体定位仪(深圳瑞沃德); 1.0和1.4 mm钻头(德国),电钻(韩国)。电极材料25 µm铂铱丝(美国A-M systems); 电生理记录仪型号NI PXI 1033(美国National instruments公司)。
1.2 实验动物
选取20只成年SD大鼠, 体重(250±20) g, 自由采食和饮水, 随机分为正常对照组(2只)、假手术组(6只)和脑损伤组(12只, 选取其中6只进行神经干细胞移植实验), 分笼饲养。
1.3 大脑皮层损毁
实验大鼠肌注0.2 mL的阿托品10 min后, 腹腔注射(60 mg/kg)戊巴比妥钠麻醉。用剃毛剪剃掉大鼠头顶部的毛, 将动物头颅固定在立体定位仪上。经碘酊和酒精局部消毒后, 在大鼠头顶部区域,用手术刀由前向后切开约1.5~2 cm的切口, 裸露出头顶骨, 清除顶骨上附着的肌肉组织。用立体定位仪, 在欲损毁皮层区域上方的头骨表面做一标记。接着用直径1.4 mm钻头在标记处钻通颅骨, 造成一个导管埋置孔。再在导管埋置孔四周, 以导管埋置孔为中心, 3~4 mm为半径处, 钻4个1 mm的牙托水泥增强螺钉埋植孔(勿损伤硬脑膜), 用灭菌生理盐水冲洗钻好了的骨孔, 清除钻孔产生的骨头残渣。
在螺钉孔内植入M1.2不锈钢螺钉, 深度为头骨的厚度或刚好触及到硬脑膜, 螺钉在颅骨上方外露2~3 mm。随后用硬脑膜切刀切除导管埋置孔内下方的硬脑膜, 暴露出大脑皮层。通过导管持握器将导管下端轻压在大脑皮层软脑膜上, 在导管四周及增强螺钉上浇上牙托水泥固定。
待牙托水泥固化后, 通过埋植好的导管, 用脑空洞侧壁切刀和空洞底面切刀, 对大脑皮层进行切除(深度约1.5 mm)和清除切下的皮层组织, 在导管内插入空洞塞。假性手术组, 只是插入堵管, 不行皮层切除。
1.4 神经干细胞移植
一周后, 选取6只大脑皮层损毁的SD大鼠进行神经干细胞移植实验。大鼠肌注0.2 mL的阿托品10 min后, 腹腔注射(60 mg/kg)戊巴比妥钠麻醉并固定在立体定位仪上。挑选玫瑰花环神经干细胞,将细胞悬液调至密度为5×107个/µL备用。在大鼠进入麻醉状态后, 取出导管内的空洞塞, 用细胞注射器直接将体积1 µL的细胞注射到人工制造的空洞内, 插入细胞悬液塞, 即完成神经干细胞移植。随后每天肌注(10 mg/kg)环孢霉素A。
1.5 移植神经干细胞电生理记录
实验大鼠在神经干细胞移植后1个月, 在戊巴比妥钠麻醉状态下, 取出导管内的细胞悬液塞, 将记录电极从导管内插入移植有神经干细胞的孔洞内, 进行电生理记录。
1.6 组织形态学检查
正常对照组、假手术组和不行移植细胞脑损伤组大鼠于损毁后一周, 移植组大鼠于移植细胞后2个月, 腹腔注射60 mg/kg的戊巴比妥钠麻醉, 4%的多聚甲醛经心脏灌流, 快速取出脑组织, 在4%的多聚甲醛中后固定, 进行大体解剖观察, 然后冰冻切片, H.E染色和免疫组化实验, 在激光共聚焦显微镜下观察并拍照。
2 结 果
动物死亡率:本实验所采用的建模方法安全可靠, 在所有实验组包括正常对照组、假手术组和脑损伤组均无大鼠死亡。
大体病理变化:六只脑创伤鼠损伤程度一致,模型稳定, 可控性好, 在损毁区域均可见一个形态规则的人造损毁空洞, 直径约0.8 mm, 深度约为1.5 mm。
H.E染色光镜检查损伤组:皮层损伤一周后, 病灶断面形态规则, 损伤灶的周围出现明显的神经胶质细胞浸润(图1)。在损伤病灶空洞区域边缘, 出现2~3层神经胶质细胞, 利于移植细胞的存活。
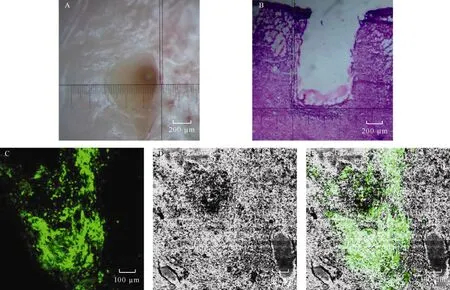
图1 大鼠脑皮层损毁及移植Fig. 1 The injured rat brain and the neural stem cells transplanted into the lesion site
神经干细胞移植:对大鼠损毁后一周进行GFP标记神经干细胞移植, 2个月后, 灌流动物, 取脑。此时, 人工损毁的空洞几乎不可见, 已经被组织填满, 略有凹陷。
冰冻切片后, 在激光共聚焦显微镜下观察发现,在先前损毁的空洞内, 充满移植的GFP细胞。在移植细胞的浅表部分, 有部分细胞出现死亡, 在空洞的底部, 部分细胞发生迁移, 迁移向宿主动物脑部的深层(图1)。
对脑切片进行免疫荧光染色发现, 移植细胞少量分化为神经胶质细胞(图2), 大多数分化形成了神经元。同时, 观察到有些宿主自身的胶质细胞突起生长到移植的细胞组织中(图3)。
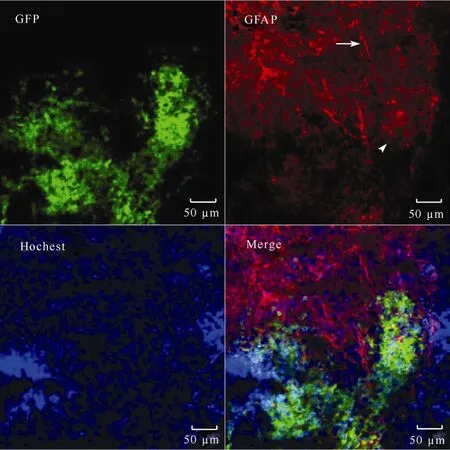
图2 对大鼠移植神经干细胞进行免疫组化染色Fig. 2 The immuno-histological stained rat brain with transplanted neural stem cells
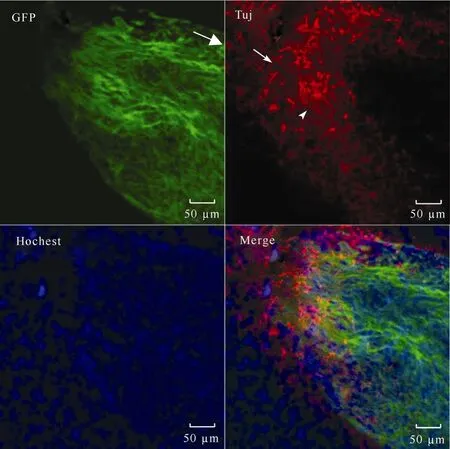
图3 对大鼠移植神经干细胞进行免疫组化染色Fig. 3 The immuno-histological stained rat brain with transplanted neural stem cells
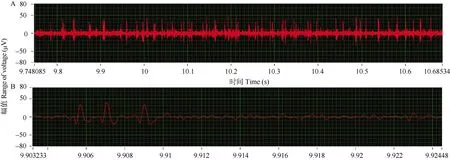
图4 在体记录大鼠移植区神经细胞放电Fig. 4 In vivo electrophysiological recording on transplanted nerve cells
对皮层损毁大鼠移植神经干细胞一个月后进行单细胞电生理记录, 记录到较好的单细胞自发放电(图4)。
3 讨 论
建立脑损伤模型的方法多种多样, 实验目的不同采用的方法也不尽相同。常用的方法有液压损伤(McIntosh et al, 1989)、重物打击损伤法(Edward Dixon et al, 1991; Marmarou et al, 1994)、压缩气击法(Lighthall, 1988), 以及冷冻伤脑水肿模型(Murakami et al., 1999)、药物损伤模型(Kim et al, 2002; Dauer & Przedborski, 2003)和负压吸除损伤(Kesslak et al, 1986)等。这些模型能较好地模拟脑损伤后的生理病理变化, 能够提供较好的病理模型;但是这些造模方法存在重复性不高, 动物损毁程度不一致等缺点, 且重度损伤时, 动物死亡率相对较高。本实验通过机械切除损毁的方法, 能够较好地在大鼠大脑皮层人工损毁出一个形态规则的空洞,相对于先前的造模实验, 动物死亡率较低, 稳定性和重复性好。先前动物模型证实移植神经干细胞能够在宿主体内存活、 迁移和分化, 并能与宿主神经元形成突触联系, 在一定程度上改善病理症状; 但是由于在先前动物模型进行神经干细胞移植实验时, 在活体情况下, 很难利用电生理的方法定位到移植细胞, 因此不能证明移植细胞是否与宿主细胞产生了真正意义上的功能性联系。本模型可以较好地将宿主细胞与移植细胞加以区分, 有效地解决了上述难题。
当前动物实验及临床应用中所使用的干细胞移植途径主要包括局部注射移植、经脑脊液注射移植、经血液循环注射移植(Chen et al, 2001; Chu et al, 2003; Jin et al, 2005)。很多学者认为, 将细胞直接移植到损毁脑组织周围, 可以把干细胞全部集中到病灶及其周边发挥治疗作用, 神经功能改善迅速、直接(Lindvall & Kokaia, 2004; Magnus & Rao, 2005; Fullwood, 2007; Marutle et al, 2007)。但是也有学者认为, 神经干细胞直接移植到病灶中, 其生存不好,相反若移植的细胞与病灶保持一定的距离, 则能较好地存活, 其原因可能是病灶区大量的细胞死亡、水肿带形成及各种炎性反应产生, 导致微环境的改变, 不利于移植细胞存活(Jeong et al, 2003), 并且移植神经干细胞能够向受损部位发生迁移, 利于干细胞存活并发挥功能(Kelly et al, 2004)。在本实验中,我们也是采用局部注射移植, 将神经干细胞直接移植到人工损毁的空洞内, 2月后处死大鼠后发现, 移植细胞几乎填满人工损毁的空洞, 表明细胞存活情况较好, 并未出现由于病灶区的炎症反应环境而影响到移植细胞的存活。笔者认为, 可能是由于在我们动物损毁模型中, 损毁病灶直径为0.8 mm, 组织营养因子能够较好地渗透到移植细胞中间来, 并且脑组织中免疫反应可能相对较弱的缘故。
先前人们对移植细胞是否与宿主细胞产生功能性突触, 大多采用离体电生理脑片记录技术(Englund et al, 2002a; Benninger et al, 2003; Rüschenschmidt et al, 2005; Uchida et al, 2005; Anderová, 2006; Prajerova et al, 2010), 这样得到的结果不能真实反应移植细胞在活体动物中的作用, 只能证明移植细胞与宿主细胞之间形成了突触, 并且能够进行突触传递。本实验中, 存活细胞大多数分化为神经元,少量细胞分化为神经胶质细胞, 分化形成的神经细胞突起能够向宿主脑内延伸生长, 在交界面移植细胞能够向宿主脑内发生迁移, 大多数移植细胞与宿主细胞界限明显, 对其中两只埋置电极大鼠进行单细胞电生理记录时, 记录到较好的细胞放电, 说明该模型可以用于移植细胞在体的电生理记录。
总之, 通过机械切割损毁的方法, 在大鼠大脑皮层能够较好地损毁出一个人为的空洞模型, 稳定性好, 可重复性高, 感染性低, 并且在损毁原位进行神经干细胞移植, 能够长期存活, 并分化为神经元和胶质细胞。能够较好地将移植细胞和宿主细胞分开, 利于将来对移植细胞进行电生理方面进一步的研究。
Alvarez-Dolado M, Calcagnotto M, Karkar K, Southwell D, Jones-Davis D, Estrada R, Rubenstein J, Alvarez-Buylla A, Baraban S. 2006. Cortical inhibition modified by embryonic neural precursors grafted into the postnatal brain[J]. J Neurosci,26(28): 7380-7389.
Benninger F, Beck H, Wernig M, Tucker KL,Brüstle O, Scheffler B. 2003. Functional integration of embryonic stem cell-derived neurons in hippocampal slice cultures[J]. J Neurosci,23(18): 7075-7083.
Chen J, Sanberg P, Li Y, Wang L, Lu M, Willing A, Sanchez-Ramos J, Chopp M. 2001. Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J]. Stroke,32(11): 2682-2688.
Chu K, Kim M, Jeong S, Kim S, Yoon B. 2003. Human neural stem cells can migrate, differentiate, and integrate after intravenous transplantation in adult rats with transient forebrain ischemia[J]. Neurosci Lett,343(2): 129-133.
Cui L, Jiang J, Wei L, Zhou X, Fraser J, Snider B, Yu S. 2008. Transplantation of embryonic stem cells improves nerve repair and functional recovery after severe sciatic nerve axotomy in rats[J]. Stem Cells,26(5): 1356-1365.
Dauer W, Przedborski S. 2003. Parkinson's Disease: Mechanisms and Models[J]. Neuron,39(6): 889-909.
Ding S, Messam C, Li P, Selzer M, Dichter M, Haydon P. 2006. Murine brain progenitor cells have the ability to differentiate into functional neurons and integrate into the CNS[J]. Cell Transplant,15(8-9): 699-710.
Edward Dixon C, Clifton G, Lighthall J, Yaghmai A, Hayes R. 1991. A controlled cortical impact model of traumatic brain injury in the rat[J]. J Neurosci Methods,39(3): 253-262.
Englund U, Björklund A, Wictorin K, Lindvall O, Kokaia M. 2002a. Grafted neural stem cells develop into functional pyramidal neurons and integrate into host cortical circuitry[J]. Proc Natl Acad Sci USA,99(26): 17089-17094.
Englund U, Fricker-Gates RA, Lundberg C, Björklund A, Wictorin K. 2002b. Transplantation of human neural progenitor cells into the neonatal rat brain: extensive migration and differentiation with long-distance axonal projections[J]. Exp Neurol,173(1): 1-21.
Fullwood N. 2007. Neural stem cells, acetylcholine and Alzheimer's disease[J]. Nat Chem Biol,3(8) 435.
Gage F. 2000. Mammalian neural stem cells[J]. Science,287(5457): 1433-1438.
Gaillard A, Prestoz L, Dumartin B, Cantereau A, Morel F, Roger M, Jaber M. 2007. Reestablishment of damaged adult motor pathways by grafted embryonic cortical neurons[J]. Nat Neurosci,10(10): 1294-1299.
Ideguchi M, Palmer T, Recht L, Weimann J. 2010. Murine embryonic stem cell-derived pyramidal neurons integrate into the cerebral cortex and appropriately project axons to subcortical targets[J]. J Neurosci,30(3): 894-904.
Ikeda R, Kurokawa M, Chiba S, Yoshikawa H, Ide M, Tadokoro M, Nito S, Nakatsuji N, Kondoh Y, Nagata K. 2005. Transplantation of neural cells derived from retinoic acid-treated cynomolgus monkey embryonic stem cells successfully improved motor function of hemiplegic mice with experimental brain injury[J]. Neurobiol Dis,20(1): 38-48.
Jeong S, Chu K, Jung K, Kim S, Kim M, Roh J. 2003. Human neural stem cell transplantation promotes functional recovery in rats with experimental intracerebral hemorrhage[J]. Stroke,34(9): 2258-2263.
Jin K, Sun Y, Xie L, Mao X, Childs J, Peel A, Logvinova A, Banwait S, Greenberg D. 2005. Comparison of ischemia-directed migration of neural precursor cells after intrastriatal, intraventricular, or intravenous transplantation in the rat[J]. Neurobiol Dis,18(2): 366-374.
Kelly S, Bliss T, Shah A, Sun G, Ma M, Foo W, Masel J, Yenari M, Weissman I, Uchida N. 2004. Transplanted human fetal neural stem cells survive, migrate, and differentiate in ischemic rat cerebral cortex[J] Proc Natl Acad Sci USA,101(32): 11839-11844.
Kesslak J, Nieto-Sampedro M, Globus J, Cotman C. 1986. Transplants of purified astrocytes promote behavioral recovery after frontal cortex ablation[J]. Exp Neurol,92(2): 377-390.
Kim JH, Auerbach JM, Rodríguez-Gómez JA, Velasco I, Gavin D, Lumelsky N, Lee SH, Nguyen J, Sánchez-Pernaute R, Bankiewicz K, McKay R. 2002 Dopamine neurons derived from embryonic stem cells function in an animal model of Parkinson's disease[J]. Nature,418(6893): 50-56.
Lighthall J. 1988. Controlled cortical impact: a new experimental brain injury model[J]. J Neurotrauma,5(1): 1-15.
Lindvall O, Kokaia Z. 2004. Recovery and rehabilitation in stroke: stem cells[J]. Stroke,35(11 Suppl 1): 2691-4.
Lu P, Jones L, Snyder E, Tuszynski M. 2003. Neural stem cells constitutively secrete neurotrophic factors and promote extensive host axonal growth after spinal cord injury[J]. Exp Neurol,181(2): 115-129.
Lundberg C, Martínez-Serrano A, Cattaneo E, McKay RD, Björklund A. 1997. Survival, integration, and differentiation of neural stem cell linesafter transplantation to the adult rat striatum[J]. Exp Neurol,145(2 Pt 1): 342-360.
Magnus T, Rao M. 2005. Neural stem cells in inflammatory CNS diseases: mechanisms and therapy[J]. J Cell Mol Med,9(2): 303-319.
Makri G, Lavdas A, Katsimpardi L, Charneau P, Thomaidou D, Matsas R. 2010. Transplantation of embryonic neural stem/Precursor cells overexpressing BM88/Cend1 enhances the generation of neuronal cells in the injured mouse cortex[J]. Stem Cells ,28(1): 127-139.
Marmarou A, Foda M, Brink W, Campbell J, Kita H, Demetriadou K. 1994. A new model of diffuse brain injury in rats[J]. J Neurosurg,8(2)0: 291-300.
Marutle A, Ohmitsu M, Nilbratt M, Greig N, Nordberg A, Sugaya K. 2007. Modulation of human neural stem cell differentiation in Alzheimer (APP23) transgenic mice by phenserine[J]. Proc Natl Acad Sci USA,104(30): 12506.
McDonald J, Liu X, Qu Y, Liu S, Mickey S, Turetsky D, Gottlieb D, Choi D. 1999. Transplanted embryonic stem cells survive, differentiate and promote recovery in injured rat spinal cord[J]. Nat Med,5(12): 1410-1412.
McIntosh T, Vink R, Noble L, Yamakami I, Fernyak S, Soares H, Faden A. 1989. Traumatic brain injury in the rat: characterization of a lateral fluid-percussion model[J]. Neuroscience,28(1): 233-244.
Morita E, Watanabe Y, Ishimoto M, Nakano T, Kitayama M, Yasui K, Fukada Y, Doi K, Karunaratne A, Murrell W. 2008. A novel cell transplantation protocol and its application to an ALS mouse model[J]. Exp Neurol,213(2): 431-438.
Murakami K, Kondo T, Yang G, Chen S, Morita-Fujimura Y, Chan P. 1999. Cold injury in mice: a model to study mechanisms of brain edema and neuronal apoptosis[J].Prog Neurobiol,57(3): 289-299.
Prajerova I, Honsa P, Chvatal A, Anderova M. 2010. Neural stem/progenitor cells derived from the embryonic dorsal telencephalon of D6/GFP mice differentiate primarily into neurons after transplantation into a corticallesion[J]. Cell Mol Neurobiol,30(2): 199-218.
Rüschenschmidt C, Koch PG, Brüstle O, Beck H. 2005. Functional properties of ES cell-derived neurons engrafted into the hippocampus of adult normal and chronically epileptic rats[J]. Epilepsia ,46 Suppl 5: 174-183.
Riess P, Zhang C, Saatman K, Laurer H, Longhi L, Raghupathi R, Lenzlinger P, Lifshitz J, Boockvar J, Neugebauer E. 2002. Transplanted neural stem cells survive, differentiate, and improve neurological motor function after experimental traumatic brain injury[J]. Neurosurgery ,51(4):1043.
Sørensen AT, Thompson L, Kirik D, Björklund A, Lindvall O, Kokaia M. 2005. Functional properties and synaptic integration of genetically labelled dopaminergic neurons in intrastriatal grafts[J]. Eur J Neurosci,21(10): 2793-2799.
Svendsen C, Caldwell M, Shen J, ter Borg M, Rosser A, Tyers P, Karmiol S, Dunnett S. 1997. Long-term survival of human central nervous system progenitor cells transplanted into a rat model of Parkinson's disease [J]. Exp Neurol,148(1): 135-146.
Temple S. 2001. The development of neural stem cells[J]. Nature,414(6859): 112-117.
Uchida K, Momiyama T, Okano H, Yuzaki M, Koizumi A, Mine Y, Kawase T. 2005. Potential functional neural repair with grafted neural stem cells of early embryonic neuroepithelial origin[J]. Neurosci Res, ,52(3): 276-286.
van Praag H, Schinder A, Christie B, Toni N, Palmer T, Gage F. 2002. Functional neurogenesis in the adult hippocampus[J]. Nature,415(6875): 1030-1034.
Wennersten A, Meijer X, Holmin S, Wahlberg L, Mathiesen T. 2004. Proliferation, migration, and differentiation of human neural stem/progenitor cells after transplantation into a rat model of traumatic brain injury[J]. J Neurosurg,100(1): 88-96.
A traumatic brain injury model for distinguishing between transplanted neural cells and host cellsin vivo
YANG Shang-Chuan1,2, DONG Jin-Run1,2, QU Jia-Gui1,2,3, HU Xin-Tian1,2,*, WANG Zheng-Bo1,2,*
(1. State Kay Laboratory of Brain and Cognitive Science, Institute of Biophysics, the Chinese Academy of Sciences, Beijing 100101, China; 2. Kunming Institute of Zoology, the Chinese Academy of Sciences, Kunming 650223, China; 3. School of Life Science, University of Science and Technology of China, Hefei 230026, China)
To perform electrophysiological recording and other investigations on transplanted neural cellsin vivo, we used mechanical damage to establish a special traumatic brain injury model that could distinguish transplanted cells from host cells. The morphology of the trauma-induced holes in the cortex of the rat brain was regular. The model was stable and repeatable. Neural stem cells were transplanted into the trauma-induced hole, and were able to survive for a long time. Most of the transplanted cells differentiated into neurons, and only a small amount turned into glia cells. There was a clear boundary between the host cells and the transplanted cells. Single cell electrophysiological recording on transplanted neural cells were detectedin vivo. This study established a stable and repeatable traumatic brain injury model, which could be used to conductin vivoelectrophysiological recording research on transplanted neural cells.
Mechanical damaging method; Neural cell; Host cell; Neural stem cells; Traumatic brain injury
Q42; R-331; R742;Q813.2
A
0254-5853-(2011)04-0421-07
10.3724/SP.J.1141.2011.04421
2011-01-06;接受日期:2011-04-14
“973”项目(2007CB947703)
∗通讯作者(Corresponding authors),E-mail: xthu@mail.kiz.ac.cn; wangzb@mail.kiz.ac.cn
杨上川, E-mail: Yangsc@mail.kiz.ac.cn
猜你喜欢
杂志排行
Zoological Research的其它文章
- Metabolism and thermoregulation between Mrs Hume’s Pheasant (Syrmaticus humiae) and Elliot’s Pheasant (S. ellioti)
- Behavioral migration diversity of the Yangtze River Japanese Eel, Anguilla japonica, based on otolith Sr/Ca ratios
- Visual modeling reveals cryptic aspect in egg mimicry of Himalayan Cuckoo (Cuculus saturatus) on its host Blyth’s Leaf Warbler (Phylloscopus reguloides)
- Afferent and efferent pathways in the visual system of the freshwater snail Planorbarius corneus
- Notch signaling dependent differentiation of cholangiocyte-like cells from rhesus monkey embryonic stem cells
- Localization of stationary pronuclei during conjugation of Paramecium as indicated by immunofluorescence staining
