DNA与蛋白质结合的共振光散射研究及应用
2011-12-09李艳坤
李艳坤
(华北电力大学 环境科学与工程学院,河北 保定 071003)
DNA与蛋白质结合的共振光散射研究及应用
李艳坤
(华北电力大学 环境科学与工程学院,河北 保定 071003)
在pH 2.21~4.35的Britton-Robinson(BR)缓冲溶液中,脱氧核糖核酸(DNA)与蛋白质相互作用形成复合物,引起较DNA或蛋白质单独存在时的共振光散射(RLS)信号的强烈增强.用于分析蛋白质与DNA结合的相互作用.实验结果显示:DNA与蛋白质之间存在较强的静电相互作用.在最佳实验条件下,波长315.0nm处,RLS强度的增强与牛血清白蛋白(BSA)在0.05~1.3μg/mL呈良好的线性关系,检出限达到纳克级.该方法不需要任何特殊试剂,快速简便,建立了蛋白质检测分析的新方法,可用于人血清实际样品的测定.
共振光散射;蛋白质;脱氧核糖核酸;相互作用
蛋白质、核酸是生物大分子的代表,是生物化学研究的重要对象.蛋白质与核酸的相互作用是许多生命活动的重要组成部分,也是分子生物学研究的中心问题之一.蛋白质参与DNA的复制、重组、病毒整合和转录等细胞活动[1].蛋白质与DNA相互作用非常复杂,蛋白质-DNA复合物通过蛋白质与DNA之间的特异性和非特异性相互作用形成.目前除了凝胶迁移(EMSA)、DNaseⅠ足迹法(DNaseⅠfootprinting)、免疫沉淀法(ChIP)、酵母单杂交技术[2-4]等经典方法,还包括原子力显微镜(AFM)、表面等离子共振(SPR)、生物质谱技术、指数富集配体系统进化法(Selex)[5-6]等新兴方法,在阐明蛋白质结合DNA形成的复合物的结构上已经取得不少进展.但这些方法大都存在操作步骤复杂、实验条件要求严格、实验成本高等缺点.共振光散射(RLS)分析方法是一种能在普通荧光分光光度计上进行测量的光散射分析技术,在研究生物大分子识别、组装和聚集时出现灵敏而丰富的信号,可取得与常用的荧光法同样高的灵敏度.共振光散射分析方法不仅可用于生物大分子的定量检测,而且可用于生物大分子间、生物大分子与其他物质之间相互作用机理的研究[7].有关蛋白质和核酸种类及其含量的测定在生命科学和医药领域中也有着重大的意义和广泛的应用.DNA与蛋白质相结合,形成DNA-蛋白质复合物,较DNA或蛋白质的体积增大,引起光散射信号的强烈增强.目前,共振光散射用于分析DNA-蛋白质复合物方面的文章尚未见报道.本文利用共振光散射技术研究DNA与蛋白质的相互作用,并由此建立了操作简便、灵敏度高的蛋白质检测分析的新方法.
1 实验部分
1.1 仪器和试剂
F-4500荧光分光光度计(日本日立公司);WH-861型旋涡混合器(江苏太仓市科教器材厂);pH酸度计(S-3C,上海伟业仪器厂);DNA贮备液:准确称量小牛胸腺DNA(ctDNA,Sigma D-1501),直接溶于水配成100μg/mL的溶液,并于0~4℃冰箱中保存;BSA贮备液:准确称取牛血清白蛋白(BSA),直接溶于水中配成100μg/mL的溶液,并于0~4℃冰箱中保存;Britton-Robinson(BR)缓冲溶液用于控制溶液的酸度;NaCl储备液:0.5mol/L.所用试剂均为分析纯,所用的蒸馏水全部为二次蒸馏水.
1.2 实验方法
在10mL比色管中,依次加入0.7mL 10μg/mL的ctDNA溶液,0.5mL的BR缓冲溶液(pH=3.78),适量的标准BSA溶液,每加一种试剂都将体系旋涡混合.最后将试液用二次蒸馏水稀释至刻度,混合均匀后于荧光分光光度计上进行同步扫描(λex=λem),获得共振光散射(RLS)光谱,并在315.0nm处测定RLS强度.激发和发射狭缝宽度均为5nm,负高压为400V.
2 结果与讨论
2.1 散射光谱
ctDNA(Calf thymus DNA,ctDNA),BSA-ctDNA的RLS光谱如图1所示.DNA,BSA的水溶液属于高分子均相溶液,其散射应属于瑞利散射.根据瑞利散射定律(rayleigh law),在校正仪器特性的影响下,散射光的强度与波长λ的四次方成反比.其溶液的散射是由于它们的浓度涨落引起的,由于DNA,BSA单独存在时,浓度很低,瑞利散射强度太弱,根本不能用作分析测定.但是当DNA与BSA处于同一溶液体系中时,两者发生相互作用,形成体积较大的复合体,此时产生强烈的共振光散射现象.因为根据共振光散射理论,粒子体积的增大和强静电结合及大结合数所导致的高度的电子离域共轭,都会产生强烈的共振光散射现象.所以,从图1可以看出,在pH 3.78的BR缓冲溶液中,波长250~700nm,BSA-DNA复合物的RLS信号比DNA的RLS信号有明显的增强,并在接近DNA分子吸收谱带附近315.0nm处产生最大RLS峰.而且RLS强度随BSA浓度的增大而增强,并在一定范围内呈线性关系.
2.2 BSA和DNA的相互作用
根据目前各种对蛋白质与DNA结合的复合物的研究,蛋白质与DNA形成复合物时能使DNA分子发生扭曲、拉伸而变形,从而使蛋白质更紧密地与DNA接触[8].DNA碱基上的氨基或亚氨基和蛋白质上的氨基或亚氨基相互交联在一起,在几分钟内形成生物复合体(biopolymers)[9].在DNA与蛋白质复杂的特异性和非特异性相互作用中,蛋白质的氨基末端和DNA主链骨架上带负电的磷酸基(PO22-)产生静电相互作用,提供结合能,有利于DNA-蛋白质复合物的稳定[10];此外,还发现蛋白质的氨基末端和DNA嘌呤碱基之间有氢键存在.
本文考察了溶液处于不同pH时,BSA与DNA作用的RLS强度,结果如图2所示.可以看出,在大约pH<4.7的酸性范围内,BSA在ctDNA存在下产生很强的RLS信号.由此证明了BSA与DNA之间存在的静电相互作用.因为蛋白质的等电点接近pH 4.7,在pH<4.7时带有正电荷,而核酸表面的磷酸基带有负电荷,所以二者可以结合形成复合体从而产生较强的RLS信号;而当pH>4.7时,蛋白质带负电荷,二者之间的静电作用减弱,RLS信号急剧降低.当pH值为3.78时,BSA的RLS信号增强最大,选定为实验最佳pH值.
同时通过向体系中加入不同浓度的NaCl溶液,考察了离子强度对DNA-BSA相互作用的影响.在10mL比色管中,使DNA质量浓度为0.7μg/mL,BSA质量浓度为1.0μg/mL,BR(pH 3.78)缓冲溶液0.5mL,然后分别加入NaCl溶液,使稀释后的NaCl溶液的最终浓度分别为0.001,0.01,0.1mol/L.经考察后发现,溶液中NaCl为0.001,0.01mol/L时,体系的RLS强度基本不变.然而当NaCl为0.1mol/L时,体系的RLS强度急剧降低了22%;DNA-BSA复合物在高的离子强度下遭到破坏,表明了在DNA与蛋白质各种复杂的相互作用中,蛋白质的氨基酸残基和DNA磷酸基团发生的静电相互作用是主要因素.
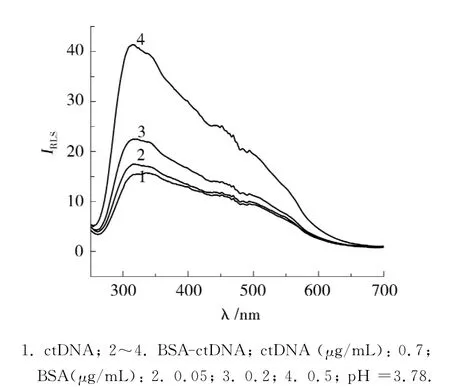
图1 共振光散射谱Fig.1 Resonace light-scattering spectra
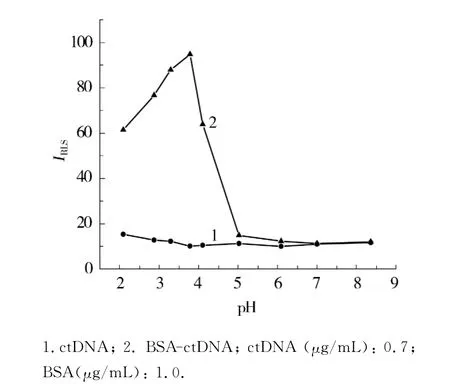
图2 不同pH下BSA-DNA的RLS强度Fig.2 RLS intensity of BSA-DNA with different pH values
2.3 基于DNA与蛋白质结合的蛋白质分析方法
2.3.1 DNA质量浓度的影响
在pH 3.78的BR缓冲溶液中,保持BSA的质量浓度1.0μg/mL不变,ctDNA质量浓度变化与RLS强度的变化特征如图3所示.可以看出,最初随着ctDNA质量浓度的增大,RLS强度逐渐增强;当ctDNA质量浓度大于0.7μg/mL后,随着ctDNA质量浓度的增大,RLS强度反而逐渐减小.根据对DNA凝聚的理论研究[11-12],在此DNA与蛋白质的相互作用应该经历2个阶段:首先,DNA与蛋白质结合形成大的凝聚体,蛋白质的氨基和DNA的磷酸基之间的静电作用,促使DNA-蛋白质复合物的稳定;当2者达到一定的化学结合计量比后,随着DNA质量浓度的增大,DNA-蛋白质复合物链开始结合另一条DNA链,DNA表面的磷酸基所带电荷逐渐被中和而变为电中性,导致DNA从溶液中沉淀出来,所以RLS强度逐渐减小.ctDNA质量浓度为0.7μg/mL时,RLS强度达到最大值.所以选择0.7μg/mL的ctDNA质量浓度为测定蛋白质含量的最佳浓度.
2.3.2 BR缓冲溶液用量的影响
在体系中分别加入BR缓冲溶液(pH 3.78)0.25,0.5,1.0,1.5,2.0mL,考察BR缓冲溶液用量对RLS强度的影响,结果如图4所示.可以看出,当BR缓冲溶液用量小于1.5mL时,ctDNA的RLS强度随BR缓冲溶液用量的增加而增强,ctDNA-BSA的RLS强度基本不变;当BR缓冲溶液用量大于1.5mL时,由于溶液中离子强度的增大,BSA与DNA表面的磷酸基之间的静电作用减弱,所以RLS强度减弱.当加入0.5mL BR缓冲溶液时,ctDNA-BSA的RLS信号增强最大,所以选择在10mL比色管中加入BR缓冲溶液0.5mL.
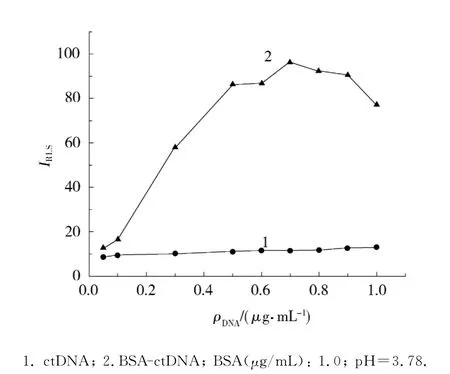
图3 不同DNA质量浓度下BSA-DNA的RLS强度Fig.3 RLS intensity of BSA-DNA with different DNA concentrations
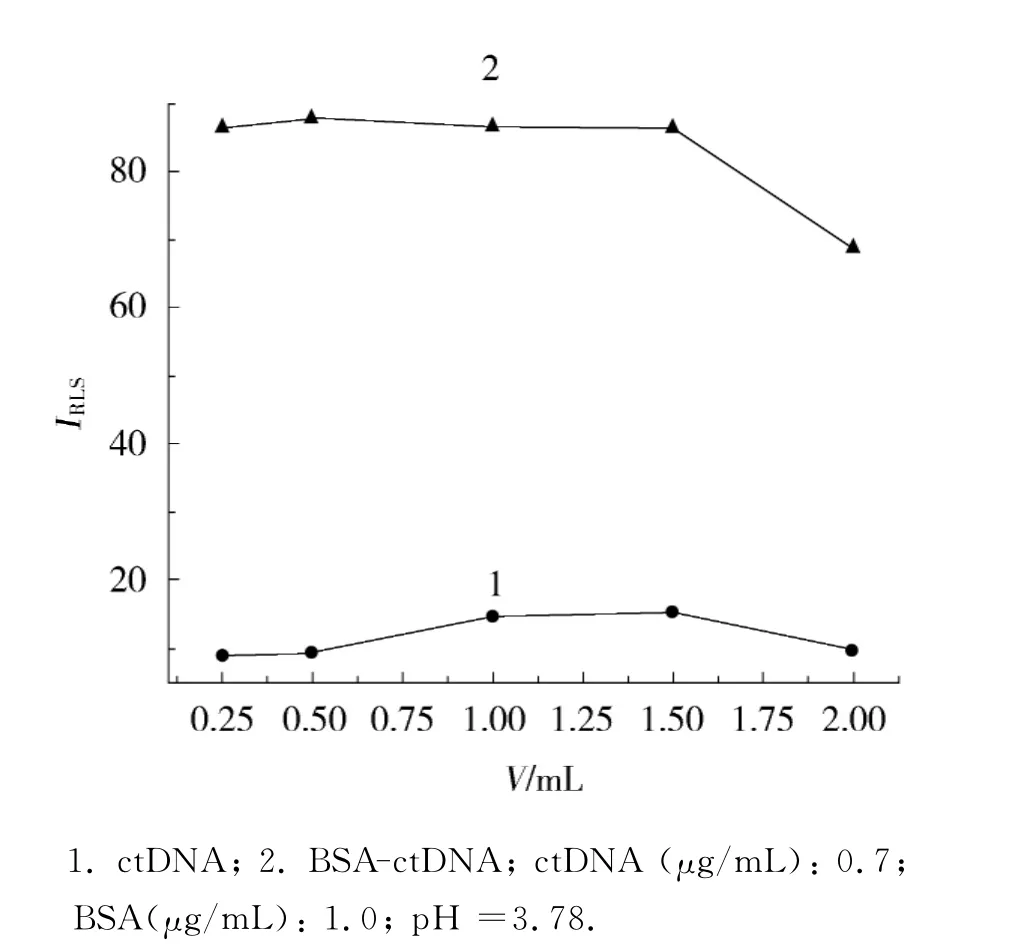
图4 不同体积BR溶液下BSA-DNA的RLS强度Fig.4 RLS intensity of BSA-DNA with different volumes of BR solution
2.3.3 光谱稳定性
在最佳实验条件下,ctDNA与BSA混合后立即进行测定.发现1h内,RLS强度随时间增大.1h后,RLS强度趋于稳定不变.所以实验中将混匀后的待测液放置1h后进行测定.2.3.4 标准曲线与检出限
在以上确定的最佳实验条件下,按照实验方法,研究了BSA的质量浓度与增强的RLS信号(ΔI)之间的关系,并绘制了标准曲线,如图5所示.结果表明,BSA在0.05~1.3μg/mL有良好的线性关系,线性回归方程为ΔI= -1.92+82.7ρ,线性相关系数为0.9990,检出限为11.0ng/mL,表明该方法具有很高的灵敏度.
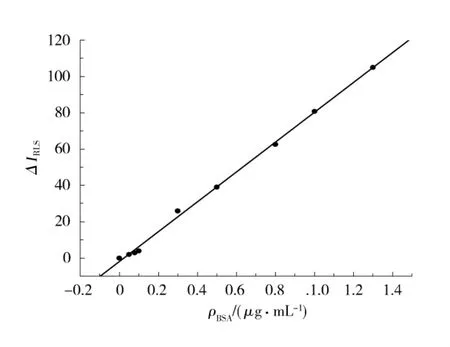
图5 不同BSA质量浓度与增强的RLS信号关系Fig.5 Relationships between BSA concentrations and enhanced RLS intensity
2.3.5 干扰测定
考察了常见的金属离子和氨基酸对测定1.0μg/mL BSA的干扰情况,结果列于表1.从表1数据可以看出,DL-苏氨酸和L-谷氨酸干扰较大.即使如此,它们的允许浓度也高于在生物体内的浓度.其他氨基酸和金属离子的干扰较小.所以,RLS方法用于BSA的分析测定,其他共存物质的干扰很小,表明该方法具有很好的选择性.
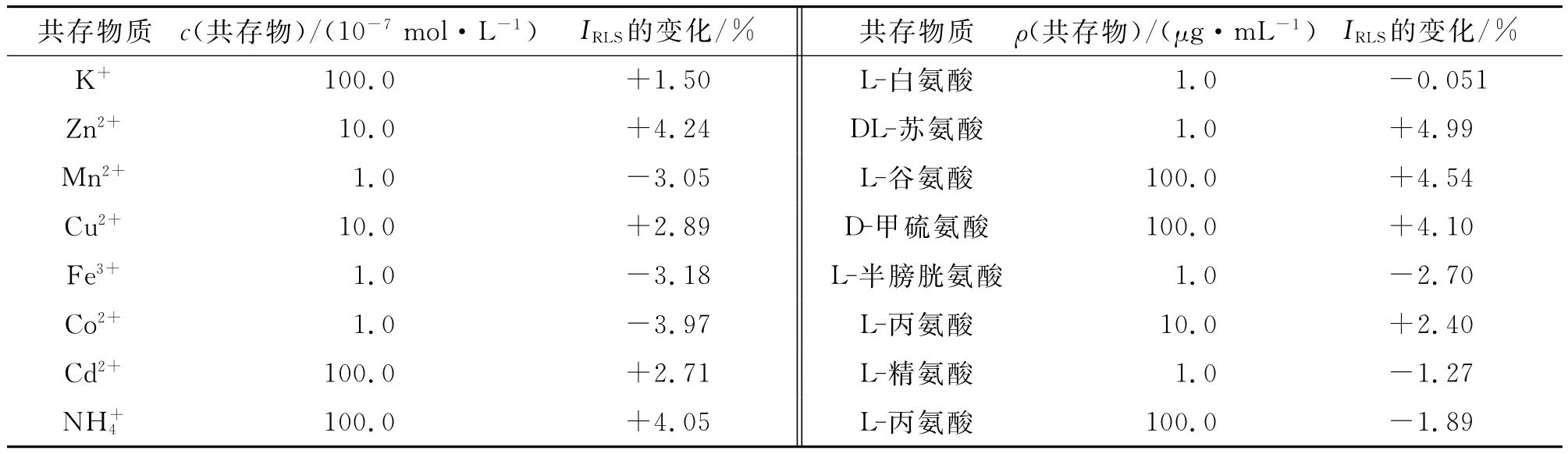
表1 共存物质的干扰Tab.1 Tolerance of foreign substances
2.3.6 不同蛋白质的响应差别
在最佳实验条件下,测定了1.0μg/mL的不同蛋白质的RLS信号,并与相同实验条件下BSA的RLS值进行比较,结果列于表2.由表2可知,各蛋白质响应信号的大小基本符合它们相对分子质量大小的顺序,也就是说该分析方法的响应信号主要取决于蛋白质体积的大小,这与共振光散射理论是相符合的.

表2 不同蛋白质的响应值Tab.2 Variation between different proteins
2.3.7 人血清试样中总蛋白含量的测定
用新鲜的人血清样品(由河北农业大学医院提供)经稀释后,同时用RLS方法和考马斯亮蓝法(CBB G-250)进行测定,结果列于表3.从RLS方法分别对2个样品重复3次测量结果的平均回收率和相对标准偏差(RSD)可以看出,RLS分析方法准确可靠,可用于实际样品的测定.

表3 人血清样本中蛋白含量检测Tab.3 Assay of proteins in human serum
3 结论
基于蛋白质与DNA相互作用形成复合物引起共振光散射信号增强的现象,对蛋白质与DNA之间较强的相互作用进行了研究,并通过对牛血清白蛋白(BSA)的定量检测,建立了操作简便、灵敏度高的蛋白质检测分析的新方法,用于人血清实际样品的测定取得好的效果.
[1]BIANCO P R,TRACY R B,KOWALCZYKOWSKI S C.DNA strand exchange proteins:A biochemical and physical comparison[J].Front Biosci,1998,3:570-603.
[2]KWON J A,RHO H M.Transcriptional repression of the Human P53gene by hepatitis B viral core protein(HBc)in human liver cells[J].Biol Chem,2003,384:203-212.
[3]PASQUALINI R,RUOSLAHTI E.Organ targeting in vivo using phage display peptide libraries[J].Nature,1996,380:364-366.
[4]LI J J,HERSKOWITZ I.Isolation of ORC6,a component of the yeast origin recognition complex by a one-hybrid system[J].Science,1993,262:1870-1873.
[5]HOYT P R,DOKTYCZ M J,WARMACK R J.Spin-column isolation of DNA-protein interactions from complex protein mixtures for AFM imaging[J].Ultramicroscopy,2001,86:139-143.
[6]WEN J D,GRAY C W,GRAY D M.SELEX selection of highaffinity oligonucleotides for bacteriophage Ff gene 5protein[J].Biochemistry,2001,40(31):9300-9310.
[7]王甫丽,郝英霞,张红蕾,等.苯酚磺酞类酸性染料与蛋白质包合物的共振散射光谱[J].河北大学学报:自然科学版,2002,22(1):32-35.
[8]LIU Yuying,WANG Pengye,DOU Shuoxing,et al.Ionic effect on combing of single DNA molecules and observation of their force-induced melting by fluorescence microscopy[J].J Chem Phys,2004,121:4302-4309.
[9]王春雨,石建党,朱彦,等.染色质免疫沉淀技术在研究DNA与蛋白质相互作用中的应用[J].遗传,2005,27(50):801-807.
[10]皮新春,邹国林.限制性核酸内切酶与DNA相互作用研究进展[J].氨基酸和生物资源,1997,19(2):44-48.
[11]李正平,李艳坤,王愈聪,等.以六氨合钴(Ⅲ)为探针的DNA共振光散射分析[J].河北大学学报:自然科学版,2004,24(6):611-614.
[12]刘玉颖,王鹏业,窦硕星,等.利用荧光偏振研究二价金属离子对DNA与组蛋白结合的影响[J].科学通报,2006,51(23):2719-2723.
Study on the Combination of DNA with Protein by Resonance Light Scattering Technique and Its Analytical Application
LI Yan-kun
(College of Environment Science and Engineering,North China Electric Power University,Baoding 071003,China)
Proteins bind DNA to form a complex,which is bigger than DNA or proteins,leading to strong enhancement of resonance light scattering(RLS)intensity.Based on this,the complex of proteins with DNA results in strong enhancement of resonance light scattering(RLS)intensity in a Britton-Robinson(BR)buffer(pH 2.21-4.35).The experimental results showed the strong electrostatic binding force between proteins and DNA.Under the optical conditions,the enhanced RLS intensity at 315.0nm was proportional to the concentration of BSA in the range of 0.05-1.3μg/mL.The limit of determination for BSA was obtained at nanogram level.The method doesn't need any special reagents,and a sensitive and convenient new analysis method for microdetermination of proteins is accordingly established.The method has been applied to the assay of proteins in actual human serum sample.
resonance light scattering;proteins;deoxyribonucleic acid;interaction
O 657.3
A
1000-1565(2011)05-0502-06
2010-11-20
河北省自然科学基金资助项目(B2011502061);中央高校基本科研业务费专项资金项目(09QL52)
李艳坤(1977-),女,河北大名人,华北电力大学讲师,博士,主要从事光谱分析研究.
E-mail:lyk800@tom.com
梁俊红)
