TGase酶法交联改善低温花生粕分离蛋白功能特性的研究
2011-12-07任娇艳赵谋明何鹏臣
任娇艳, 胡 晓, 崔 春, 赵谋明, 何鹏臣
(华南理工大学轻工与食品学院,广东广州 510640)
TGase酶法交联改善低温花生粕分离蛋白功能特性的研究
任娇艳, 胡 晓, 崔 春, 赵谋明, 何鹏臣
(华南理工大学轻工与食品学院,广东广州 510640)
利用转谷氨酰胺酶(TGase)对低温花生粕分离蛋白(PPI)进行交联改性,对比不同交联时间(30,90,240 min)对PPI功能特性的影响.结果表明:TGase可促使PPI亚基发生改变并形成高分子聚合物,随着交联程度的上升,PPI溶解性逐渐降低.TGases限制性交联(37℃交联90 min)可明显提高PPI乳状液的稳定性,但交联时间过长将导致其制备的乳状液乳化活性及稳定性显著降低.DSC分析表明,TGase适度交联使PPI变性温度(Td)增加,变性焓值(ΔH)降低,表明TGase交联可使PPI热稳定性提高.
低温花生粕分离蛋白;转谷氨酰胺酶;交联
我国花生产量居世界第一(年总产量约1 500万吨),其主要用途是作为油料作物,用于榨油的花生约占其总产量的50% ~60%[1].我国对花生采用的榨油方式主要有热压榨、冷压榨及溶剂萃取.花生经热压榨后蛋白变性严重,其副产物高温花生粕大多作为饲料使用.低温压榨一般与溶剂萃取联合使用,蛋白质变性程度低,制取的蛋白粉细腻,既可用于食品加工,又可直接生产花生组织蛋白,其缺点是溶剂不易完全除净[2].花生粕饼高值化应用程度低,造成蛋白资源的大量浪费.与国外相比,我国花生深加工产业极为薄弱,如日本的花生产量虽远低于我国,但其有上千家花生食品生产厂,人均花生食品占有量是我国的3~4倍[3].因此,研究花生粕蛋白精深加工与高值化利用具有重要意义.
酶法改性提高花生粕蛋白的功能特性,是充分利用该蛋白资源的重要途径之一.转谷氨酰胺酶(TGase,EC 2.3.2.13)是一种可催化酰基转移反应的酶,TGase催化的酰基转移反应可引起蛋白质分子间或分子内的共价交联,从而改善蛋白质的部分功能特性[4].TGase交联作为蛋白改性的一个重要手段,也可用于改善动植物蛋白的功能特性,在食品领域中有重要应用,但目前国内外关于TGase改性花生蛋白的文献报道较少,且尚缺乏深入的研究.本文以 TGase改性低温压榨花生粕蛋白,探讨TGase交联对花生蛋白功能特性的影响,以期为花生粕蛋白的精深加工与高值化应用提供适当参考.
1 材料与方法
1.1 材料与设备
主要材料:低温脱脂花生粕,山东天申生物蛋白有限公司提供;转谷氨酰胺酶,购自江苏一鸣生物制品有限公司.其他试剂均为分析纯.
主要设备:320-S型数显pH计,瑞士梅特勒-托利多公司;CR22G型高速冷冻离心机,日本日立公司;Alpha1-4 LD plus型冷冻干燥机,德国 Marin Christ公司;600 HPLC system型液相色谱仪,美国Waters公司;APV-1000型高压均质机,丹麦APV公司;Mastersizer2000型粒度分布仪,英国Malvern Instruments Ltd;TA Q100型差示扫描量热仪,美国TA仪器公司.
1.2 实验方法
1.2.1 花生分离蛋白的制备
取一定量的花生粕将其与水按质量比为1∶10混合,用1 mol/L NaOH调节pH值至8.0,常温搅拌提取 1 h,离心 30 min(8 000 r·min-1),取上清液,用1 mol/L HCl调节pH 值至4.5,离心10 min(8 000 r·min-1),取离心沉淀物,加去离子水,用 1 mol/L NaOH调节pH值至7.0使其充分溶解,用去离子水透析24 h,冷冻干燥制得花生分离蛋白(PPI).
1.2.2 TGase交联反应
将PPI配成蛋白质量分数为2%的溶液,调节溶液pH值至7.0,加入TGase(加酶量为0.5 g/100 g 蛋白),在37 ℃分别反应30,90,240 min,反应后冷冻干燥,制得PPI交联样品.
1.2.3 乳状液的制备
用去离子水将蛋白样品配成蛋白质量分数为2%的溶液,调节pH值为7.0,将溶液与玉米油按质量比为4∶1混合,采用APV均质机在30 MPa下均质制成乳状液.
1.2.4 体积排阻色谱
体积排阻色谱(size exclusive chromatography,SEC).采用Waters 600高效液相系统,以Protein-Pak 300SW作为分析柱(分离范围为1万~40万u).此柱使用含0.2 mol/L NaCl的50 mmol/L磷酸缓冲液(pH 7.2)来平衡和洗脱.经膜滤(0.45 μm)后的蛋白溶液(0.01 g/mL)进样于 Protein-Pak 300SW(进样量为20 μL),采用恒流洗脱,流速为1 mL/min,检测波长为280 nm.
1.2.5 邻苯二甲醛法测定自由氨基
邻苯二甲醛(O-phthaldialdehyde,OPA).准确称取OPA 40.0 mg溶解于1.0 mL甲醇中,再加入0.2 g/mL的十二烷基硫酸钠2.5 mL,硼砂(0.1 mol/L)25.0 mL,β-巯基乙醇 100 μL,最后用蒸馏水定容到50 mL.测定时,取4.0 mL OPA试剂于试管中,加入200 μL样品,混合均匀,放入35℃水浴中反应2 min,后于340 nm下测吸光值A340.
1.2.6 溶解性的测定
将0.01 g/mL蛋白质溶液调节至pH值为3.0~10.0,离心 20 min(8 000 r·min-1),上清液中的蛋白质采用Lowry法[5]测定,利用牛血清蛋白(BSA)为参比物做标准曲线,测定500 nm处吸光值.根据样品中蛋白质含量和溶液中蛋白质含量计算溶解度.
1.2.7 粒度分布的测定
取1 g乳状液用1 000 g去离子水稀释,采用粒度分布仪测定乳状液中粒子大小及其分布,根据相关参考文献设置操作参数[6-7],表面积平均粒径d32与体积平均粒径d43的计算公式分别为:

式中,ni是直径为di的脂肪球的数量.
1.2.8 乳析率测定
向制备好的乳状液中添加0.02 g/mL的叠氮钠溶液,使叠氮钠在乳状液中最终质量浓度达2×10-4g/mL,以抑制乳状液中的微生物生长,然后准确吸取10 mL于具塞刻度试管中,常温加盖密封静置,第20天记录乳析层的高度.乳析率即为乳析层的高度与乳状液高度的比值.
1.2.9 差示扫描测量
采用差示扫描量热(DSC)法对蛋白样品的变性情况进行分析.将样品配成蛋白质量浓度为0.2 g/mL的溶液,吸取20 μL样液置于铝盒中,压片密封.氮气的速率设为30 mL/min,在25~120℃进行扫描,扫描速率为5℃/min,并选择空密封铝盒作为参照.所得到的DSC曲线,采用Q100-DSC分析仪进行分析,从而得到蛋白样品的最初变性温度(Tm),变性温度(Td)和变性焓值(ΔH).
2 结果与讨论
2.1 体积排阻色谱分析
花生分离蛋白(PPI)经TGase催化交联不同时间后其组分的SEC图谱如图1.可以看出,与未交联的原始样对比,经TGase催化交联30 min后,PPI高分子量组分(洗脱出峰时间约为4.8 min)含量明显增加,且随着交联时间延长至90 min及240 min,该组分含量不断增加.SEC图谱的变化表明PPI的亚基在TGase的催化作用下形成高分子质量的聚合物,且交联程度随着催化时间的延长而增加.

图1 TGase不同催化时间下PPI交联产物的SEC图谱Fig.1 SEC profiles of cross-linked PPI samples by TGase
2.2 自由氨基含量的变化
OPA法于340 nm测得的吸光值可反映蛋白样品中自由氨基的含量[5].由OPA法测得的样品自由氨基含量如图2.由图2可以看出,随着TGase催化交联时间的延长,PPI样品的吸光值A340呈下降趋势,说明PPI中的自由氨基含量逐步减少.这是因为TGase促使蛋白质交联主要是通过催化蛋白质肽链中谷氨酰胺残基(Gln)的γ-酰胺基和赖氨酸残基(Lys)的ε-氨基之间形成异肽共价键(G—L键)来实现,而蛋白质的自由氨基参与G—L键的形成,故自由氨基含量的降低可反映蛋白样品中G—L键的增加,有相关研究证实TGase在催化谷物类蛋白如大米蛋白、燕麦蛋白时可导致其自由氨基含量的下降[6-7].因此,图2的结果也表明PPI交联程度随着TGase催化时间的延长而提高,这一结果与SEC分析结果相符.

图2 PPI自由氨基含量变化Fig.2 Changes in free amino groups of PPI
2.3 TGase对PPI溶解性的影响
蛋白质的溶解性是蛋白质水化作用的重要体现.TGase交联处理对PPI溶解性的影响如图3,可以看出与PPI原始样相比,随着交联时间的延长,交联程度的增加,PPI交联后的样品溶解性逐渐降低,高分子不溶聚合物的生成以及蛋白结构的变化可能是导致溶解性下降的主要原因.除花生蛋白外,TGase交联处理同样会导致燕麦、芸豆等植物蛋白溶解性的下降[8-9],而 Babiker等[10]研究发现交联后的大豆蛋白在pH值为2.0和pH值为8.0~12.0时其溶解性会有所增加.这种结果上的差异可能是由于不同底物蛋白在其组成与结构上有所不同所导致.

图3 TGase交联对PPI溶解性的影响Fig.3 Effects of TGase treatment on solubility of PPI
2.4 TGase对PPI乳化性的影响
蛋白质的乳化特性可以从其制备的乳状液的粒度分布、乳析率来进行综合评价.TGase交联前后PPI乳状液粒度分布的变化如图4.由图4可以看出,交联时间为0,30,90 min时,乳液粒度均呈单峰分布,尽管随着交联时间的增加峰形略向大粒径方向偏移,但绝大部分乳液颗粒直径均小于10 μm,但当交联时间增加到240 min时,乳液粒度变为双峰分布,且大粒径乳液颗粒(大于10 μm)所占体积约为32%.这可能是由于交联后的蛋白其溶解性的下降导致其在制备乳液的均质过程中无法迅速迁移到油水界面,从而导致乳液颗粒增大[10].乳状液粒径数据如表1.由表1可以看出,TGases处理时间超过90 min后,d32及d43极显著增加,因此TGase处理时间不易过长,否则容易导致乳化活性降低.

图4 不同TGase交联时间对PPI乳状液粒度分布的影响Fig.4 Effects of different TGase treatment on particle size distribution of emulsions made with PPI samples
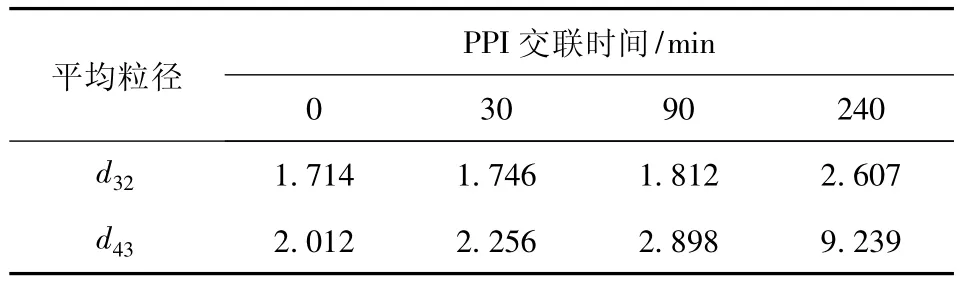
表1 乳状液平均粒径的变化Tab.1 Changes in mean particlesize of emulsions μm
乳析率是反映乳状液稳定性的重要指标.TGase交联前后PPI乳状液乳析率的变化见图5.由图5可以看出,当PPI交联时间从0增至90 min时,样品的乳析率逐渐降低,表明其乳状液稳定性逐步提高,其原因可能是蛋白分子交联后形成了支链结构,分子量增加,蛋白交联物吸附在油脂颗粒表面后可增加界面蛋白膜的厚度及抗形变能力,使被其覆盖后的油滴颗粒不易相互碰撞而聚结[11-12].当PPI交联时间增至240 min时,其乳状液的乳析率反而升高,其原因可能是随着交联程度的进一步增加,蛋白的溶解性急剧下降从而导致其乳化稳定性有所降低.由此可知,适度交联有利于PPI乳化稳定性的提高.
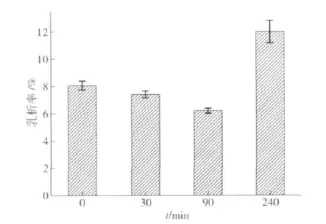
图5 TGase交联对PPI乳状液乳析率的影响Fig.5 Effects of TGase treatment on creaming index of emulsions made with PPI samples
2.5 热特性分析
PPI及其交联物的DSC图谱与分析结果见图6和表2.由图6可知,PPI的热吸收图谱主要有两个变性峰 P1和 P2,分别为其组分花生伴球蛋白(Conarachin)和花生球蛋白(Arachin)的变性峰,其中Arachin的变性温度(P2)比Conarachin(P1)要高.PPI经TGase催化交联90 min和240 min的交联物也均呈现两个变性峰,但其吸热峰值有向高温偏移的趋势.
从表2可以看出,随着交联时间的延长及PPI交联程度的提高,PPI组分Arachin和Conarachin的最初变性温度(Tm)与变性温度(Td)均呈增加趋势,表明TGase交联后PPI蛋白组分的热稳定性有所提高[13],这可能主要归因于TGase催化的交联反应产生了大量的高能异肽共价键从而提高了产物的热稳定性.TGase交联后PPI各组分的变性焓值(ΔH)发生不同程度的下降,表明酶促交联作用在一定程度上导致花生蛋白结构展开[13].总的来看,TGase交联使PPI最初变性温度(Tm)、变性温度(Td)增加,变性焓值(ΔH)降低,表明TGase交联可使PPI热稳定性提高.以往研究也发现TGase可提高大豆分离蛋白和芸豆分离蛋白热稳定性[14-15].

图6 PPI及其交联产物的DSC图谱Fig.6 DSC thermograms of PPI samples with or without TGase treatment
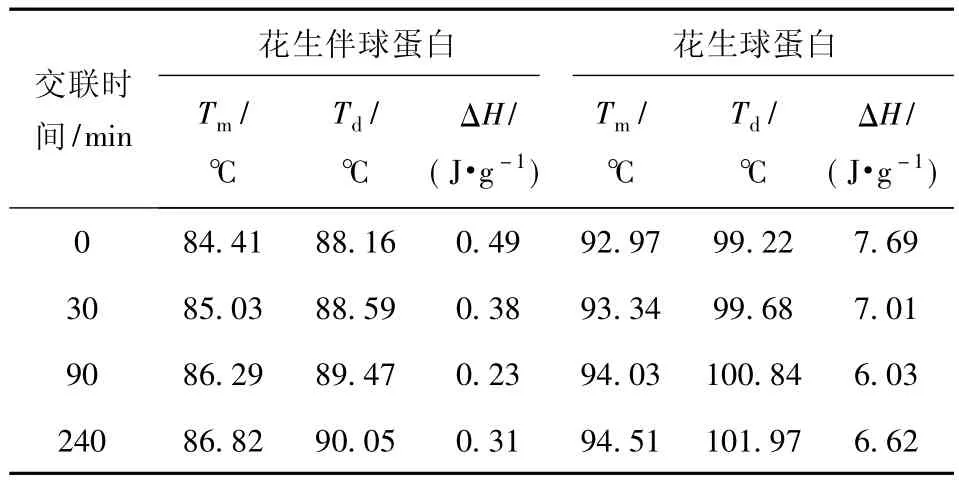
表2 PPI及其交联产物热特性分析Tab.2 DSC characteristics of PPI samples with or without TGase treatment
3 结论
花生分离蛋白经TGase催化交联后可使PPI亚基发生分子间交联而生成高分子量聚合物,且随着交联时间的延长(30,90,240 min),交联程度增加,交联后PPI样品自由氨基含量减少,蛋白样品中异肽共价键(G—L键)增加.随着交联时间的递增,因生成高分子不溶性聚合物而导致PPI溶解性降低;交联时间超过90 min后,乳状液表面积平均粒径(d32)与体积平均粒径(d43)显著增加,因此交联时间不宜过长,否则将导致其乳化活性减小;同样,从乳析率来看,TGases限制性交联(37℃交联90 min)可明显提高PPI乳状液的稳定性,过度交联反而会导致乳化稳定性的下降.此外,TGase交联使PPI变性温度(Td)增加,变性焓值(ΔH)降低,表明TGase交联可使PPI热稳定性提高.
[1]Zhu Y,Rinzema A,Tramper J,et al.Microbial transglutaminase-a review of its production and application in food processing[J].Applied Microbiology and Biotechnology,1995,44(3-4):277-282.
[2]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4 [J].Nature,1970,227(5259):680-685.
[3]Beveridge T,Toma S J,Nakai S.Determination of SH-and SS-groups in some food proteins using Ellman’s reagent[J].Journal of Food Science,1974,39:49-51.
[4]Voutsinas L P,Cheung E,Nakai S.Relationships of hydrophobicity to emulsifying properties of heat denatured proteins[J].Food Science,1983,48:26-32.
[5]Lowry O H,Rosembroug H J,Lewis A,et al.Protein measurement with the folin phenol reagent[J].Journal of Biological Chemistry,1951,19:265-275.
[6]Chen J S,Dickinson E.Protein/surfactant interfacial interactions PartⅠ.Flocculation of emulsions containing mixed protein+surfactant[J].Colloids and Surfaces A,1995,100:255-265.
[7]Schokker E P,Dalgeish D G.The shear-induced destabilization of oil-in-water emulsions using caseinate as emulsifier[J].Colloids and Surfaces A,1998,145:51-69.
[8]Siu N C,Ma C Y,Mock W Y,et al.Functional properties of oat globulin modified by a calcium-independent microbial transglutaminase[J].Journal of Agricultural and Food Chemistry,2002,50:2666-2672.
[9]Tang C H,Sun X,Yin S W,et al.Transglutaminase-induced cross-linking of vicilin-rich kidney protein isolate:Influence on the functional properties and in vitro digestibility[J].Food Research International,2008,41:941-947.
[10]Babiker E E.Effect of transglutaminase treatment on the functional properties of native and chymotrypsin-digested soy proteins[J].Food Chemistry,2000,70:139-145.
[11]Krause J P,Dudek S,Schwenke K D.Changes in interfacial behaviour,emulsifying and foaming properties of faba bean legumin after modiflcation with dimethylsuberimidate[J].Nahrung,2000,44:403-406.
[12]Poon S,Clarke A E,Schultz C J.Effect of denaturants on the emulsifying activity of proteins[J].Journal of Agricultural and Food Chemistry,2001,49:281-286.
[13]Tomas A,Paquet D,Courthaudon J L.Effect of fat and protein contents on droplet size and surface protein coverage in dairy emulsions[J].Journal of Dairy Science,1994,77(2):413-417.
[14]Aluko R E,Yada R Y.Effect of a microbial calcium-independent transglutaminase on functional properties of a partially purified cowpea(Vigna unguiculata)globulin[J].Journal of the Science of Food and Agriculture,1999,79:286-290.
[15]Nonaka M,Toiguchi S,Sakamoto H,et al.Changes caused by microbial transglutaminase on physical properties of thermally induced soy protein gels[J].Food Hydrocolloids,1994(8):1-8.
(责任编辑:叶红波)
Effect of TGase Cross-linking on Functional Properties of Peanut Protein Isolate
REN Jiao-yan, HU Xiao, CUI Chun, ZHAO Mou-ming, HE Peng-chen
(College of Light Industry and Food Sciences,South China University of Technology,Guangzhou 510640,China)
Transglutaminase(TGase)was used to modify peanut protein isolate(PPI)and the effect of different incubation time(30min,90min and 240min)on the functional properties of PPI was studied.The results showed that TGase cross-linking induced the change of PPI subunits and the formation of highmolecular-weight polymers.when the incubation time of TGase cross-linking was increased,the decrease in solubility of PPI was observed.It was found that limited TGase cross-linking(37℃,90 min)could obviously improve the emulsion stability of PPI but overtreatment could result in the decrease of emulsion activity and stability.The increase of Td and the decrease of ΔH showed by DSC analysis further proved that TGase cross-linking could increase the thermal stability of PPI.
transglutaminase;peanut protein isolate;cross-linking
TS229
A
1671-1513(2011)05-0016-05
2011-07-08
国家创新大学生计划项目(081056131);广东省高等学校高层次人才资助项目(粤教师函(2010)79号).
任娇艳,女,讲师,博士,主要从事食品生物技术方面的研究.
