紫玉米色素的抗氧化活性研究
2011-11-17肖春玲张少颖
肖春玲 张少颖 孙 英
(山西师范大学工程学院,临汾 041004)
紫玉米色素的抗氧化活性研究
肖春玲 张少颖 孙 英
(山西师范大学工程学院,临汾 041004)
试验采用 85∶15的 80%乙醇与 0.2 mol/L的柠檬酸溶液提取紫玉米色素,对其色素的光谱性质做了研究;通过建立 DPPH·自由基、羟基自由基、超氧阴离子自由基、还原力、双氧水及 Fe2+螯合能力体系等试验,测定并对比了紫玉米和抗坏血酸的抗氧化能力。结果表明:该色素为紫玉米色素,其具有较强的体外抗氧化能力,且清除自由基 (DPPH·和·OH、O2-·)的能力明显优于阳性对照抗坏血酸。其色素粗提物在0.04 mg/mL时,对 DPPH·的清除率达到 89.88%;对·OH的清除率达到 84.87%;在 0.035 mg/mL时,对 O2-·的清除率达到 85.82%。此外,紫玉米色素粗提物的总还原能力、双氧水清除能力略低于阳性对照抗坏血酸,Fe2+螯合能力约是 EDTA的一半,并且其抗氧化能力的大小与紫玉米色素浓度高低相一致。
紫玉米 色素 抗氧化活性
紫玉米属禾本科玉米属,原产于秘鲁,后引进我国[1]。紫玉米色素是从紫玉米籽粒中提取的一种花色苷。花色苷类色素是植物中广泛存在的一类水溶性天然色素,具有许多的生理作用,如清除自由基、抗氧化、抗脂质过氧化等。目前,对紫玉米色素的研究主要集中在提取剂的选取、浸提技术及提取工艺上[2-5],对紫玉米色素的抗氧化活性在国内外少有报道。随着人们保健意识的增强和对食品安全性要求的提高,合成色素的使用越来越受到限制,天然色素的发展日益受到重视。本试验通过对紫玉米色素的可见光谱来验证其性质;并通过 DPPH·自由基体系、羟基自由基体系、超氧阴离子自由基体系、双氧水体系等方法对紫玉米色素的抗氧化活性进行测定,旨在为拓展紫玉米色素的应用领域提供理论依据,为天然抗氧化剂的开发提供新的参考资料。
1 材料及仪器
1.1 材料
紫玉米:山西忻州玉米研究所。
1.2 主要仪器
FZ102型微型植物粉碎机:天津市泰斯特仪器有限公司;RE-52旋转蒸发器:上海亚荣生化仪器厂;JDG-0.2型真空冻干机:兰州科近真空冻干技术有限公司;BS100s型电子天平:北京赛多利斯仪器系统有限公司;WFJ7200型可见分光光度计:上海尤尼柯仪器有限公司。
1.3 试剂
1.1 -二苯代苦味酰基自由基:Sigma公司;甲醇、乙二胺四乙酸、过氧化氢、抗坏血酸、三氯化铁、盐酸、乙醇、磷酸二氢钠、磷酸氢二钠、铁氰化钾、水杨酸、三 (羟甲基)氨基甲烷、邻苯三酚、三氯乙酸、硫酸亚铁、碘化钾、硫代硫酸钠、邻二氮菲 (1,10-菲罗啉),均为分析纯。
2 试验方法
2.1 紫玉米色素的提取、制备及性质
选取优质紫玉米粒,用粉碎机将玉米粒粉碎后,参照徐亚民等[6]方法,以 85∶15的 80%乙醇与 0.2 mol/L的柠檬酸溶液在 60℃下提取 2 h,料液比为1∶8(质量与体积比),抽滤,以 100 mL提取液洗涤滤渣,合并 3次滤液,旋转减压蒸发,浓缩,真空冻干得色素粗提物。称取适量的色素粗提物,用 50%的甲醇定容到 50 mL的容量瓶。制备成 0.01、0.015、0.02、0.025、0.03、0.035、0.04 mg/mL的粗提物溶液备用[7]。取适量色素粗提物,用甲醇稀释,用可见分光光度计测其在400~650 nm的吸光度[8],并绘制吸收光谱图。
2.2 紫玉米色素的抗氧化活性的测定
2.2.1 二苯代苦味酰基自由基 (DPPH·)清除能力的测定
准确称取 2.5 mgDPPH·,用无水甲醇溶解并定容于 100 mL容量瓶中,得到 DPPH·质量浓度为25μg/mL的溶液,避光保存 (0~4℃)[9]。
2.2.1.1 不同质量浓度色素对DPPH·的清除能力
取不同质量浓度色素粗提物溶液 0.1 mL,加入3.9 mL质量浓度为 25μg/mL的 DPPH·甲醇溶液,快速混匀后分别于 0、5、10、15、25、35、45、55、65、75 min测定其吸光度 (516 nm),直至吸光度相对稳定。绘制色素清除 DPPH·的动力学曲线[10]。
2.2.1.2 不同质量浓度色素与抗坏血酸对 DPPH·的清除率
精确吸取不同质量浓度的色素粗提物溶液 0.1 mL于试管中,与 3.9 mL 25μg/mL的 DPPH·甲醇溶液混合,摇匀后放置 75 min。用分光光度计测定上述溶液在 516 nm处的吸光度值A1,同时测定 0.1 mL色素粗提物溶液与 3.9 mL甲醇混合均匀后在波长516 nm处的吸光度值 A2,3.9 mL DPPH·甲醇溶液与 0.1 mL蒸馏水混合均匀的吸光值A0。平行测试 3次,计算清除率[11-12]。以抗坏血酸作标准抗氧化剂。DPPH·的清除率 P=[1-(A1-A2)/A0]×100%。
2.2.2 羟基自由基 (·OH)清除能力的测定
吸取色素溶液 2.0 mL于试管中,加入 6 mmol/L的水杨酸溶液 2.0 mL,再加入 6 mmol/L的 FeSO4溶液 2.0 mL,3.5 mL蒸馏水,混匀后加 6 mmol/L H2O22.0 mL,启动 Fenton反应,摇匀后于 510 nm波长下测定吸光度为 A1;取 2.0 mL的无水甲醇代替浓度为6 mmol/L水杨酸,所测得的吸光度即为 A2;取 2.0 mL的无水甲醇代替色素溶液,所测得的吸光度即为A3;根据下式计算各待测物对·OH的清除率 P[13]:P=[(1-(A1-A2)/A3)]×100%。
2.2.3 超氧阴离子自由基 (O2-·)清除能力的测定
加入不同质量浓度的色素溶液 1 mL,作为待测液,然后加入 50 mmol/L的 Tris-HCl缓冲溶液 (pH为 8.2)9 mL及加入 4.2 mL的蒸馏水,混匀后在25℃的水浴中保温 20 min,取出后,立即加入在25℃预热的 0.3 mL的邻苯三酚溶液,迅速摇匀后,准确反应 3 min,于 420 nm波长下测定吸光度为 A2,同时测定添加邻苯三酚前样品的吸光度值为 A1;另外以无水甲醇代替样品测定邻苯三酚的自氧化程度为 A0。平行测试 3次,计算清除率[14]。以抗坏血酸作标准抗氧化剂。对超氧阴离子的清除率 P=[1-(A2-A1)/A0]×100%。
2.2.4 还原力的测定
依次加入 2.5 mL 0.2 mol/L pH 6.6的磷酸盐缓冲溶液、2.5 mL1%的铁氰化钾溶液和 1 mL不同浓度的色素溶液,混匀,50℃水浴 20 min,快速冷却后,加入 1 mL 10%的三氯乙酸溶液,加入 2.5 mL蒸馏水和 1.0 mL 0.1%的三氯化铁溶液,混合均匀,室温静置反应 10 min,在 700 nm处测定吸光度,平行测试 3次,通过吸光值的大小来断定其还原能力,吸光值越大,表示还原能力越强。以抗坏血酸作标准抗氧化剂[15]。
2.2.5 清除双氧水能力的测定
分别取不同浓度的色素液和抗坏血酸各 1.0 mL,加入 0.1 mol/L的双氧水 1.0 mL,37℃保温 2 h后用标准的 0.01 mol/L硫代硫酸钠测定剩余双氧水氧化碘化钾析出碘的量,同时以淀粉溶液为指示剂。用蒸馏水代替样品测得的消耗硫代硫酸钠的平均体积为D1,加入样品后测得的消耗硫代硫酸钠的平均体积为D2,不加双氧水,用蒸馏水代替样品测得的试剂消耗硫代硫酸钠的平均体积为D0,平行测试 3次,计算清除率[14]。双氧水的清除率 P=(D1-D2)/(D1-D0)×100%
2.2.6 Fe2+螯合能力的测定方法
取不同浓度的色素液 1 mL于试管中,分别加入2 mL 0.2%FeSO4溶液,37℃恒温水浴 30 min,然后加入 0.5 mL 0.3%邻二氮菲,在 37℃恒温水浴中反应 10 min。在 510 nm处测定吸光值,设空白对照为A0,色素溶液的吸光值为A1,不加邻二氮菲时色素溶液的吸光值为 A2,平行测试 3次,根据下式计算待测物对 Fe2+的螯合率[13]。螯合率 =[1-(A1-A2)/A0]×100%。同时配制同浓度的 EDTA做阳性对照溶液,按照上述步骤计算对 Fe2+的螯合率。
3 结果与分析
3.1 色素的性质
图 1表示色素的吸收光谱图。图 1表明,在可见光区 525 nm波长处有最大吸收峰,这一吸收峰正属于紫玉米色素类物质的特征吸收 (510~540 nm)。由光谱性质检验,可以初步推断该色素为花青素类物质。

图 1 色素在可见区间的吸收图谱
3.2 紫玉米色素的抗氧化活性的测定
3.2.1 二苯代苦味酰基自由基 (DPPH·)清除能力的测定结果
3.2.1.1 不同质量浓度的紫玉米色素对 DPPH·的清除能力
图 2是不同质量浓度的紫玉米色素清除 DPPH·的动力学曲线。图 2表示在 DPPH·体系中加入不同浓度的样品后,体系的吸光度随时间的延长不断下降;并且加样浓度越大,降幅越大,自由基的清除能力越强。

图 2 紫玉米色素清除DPPH·的动力学曲线
3.2.1.2 紫玉米色素与抗坏血酸对 DPPH·的清除率
图 3表示紫玉米色素与抗坏血酸对DPPH·的清除率。图 3表明,紫玉米色素和抗坏血酸在0.01~0.02 mg/mL范围时,随着浓度的增大,二者对 DP PH·的清除率明显增大,增幅分别为 78.81%和84.34%,当浓度进一步增大时,二者对 DPPH·的清除率虽继续增大,但增幅不明显,仅为 3.9%和17.89%,当质量浓度达到 0.035 mg/mL后,清除率基本不再发生变化。质量浓度达到 0.04 mg/mL时,紫玉米色素的清除率达到 89.88%,比抗坏血酸(81.62%)略高,这表明紫玉米紫色素粗提物对 DP2 PH·自由基具有很强的清除能力。紫玉米色素粗提物、抗坏血酸的 EC50值[14]分别为 0.012 5 mg/mL和0.014 mg/mL。从 EC50值来看,DPPH·清除能力为紫玉米色素粗提物大于抗坏血酸。

图 3 不同浓度的样品溶液对DPPH自由基的清除效果
3.2.2 羟基自由基 (·OH)清除能力的测定结果
图 4表示不同质量浓度的样品溶液对羟基自由基的清除效果。图 4表明,紫玉米色素粗提物表现出很强的清除羟自由基活性。在所测浓度范围内,清除率均高于阳性对照抗坏血酸,且对羟自由基的清除率随着浓度的增加而增加。当紫玉米色素和抗坏血酸的质量浓度均为 0.01 mg/mL时,二者对·OH的清除率分别为 34.85%和 12.15%,当质量浓度增至0.025 mg/mL时,紫玉米色素粗提物的清除率提高到 81.98%,而阳性对照抗坏血酸的清除率为63.16%,增幅分别为 57.49%和 80.76%。当样品质量浓度高于 0.03 mg/mL时,随着样品浓度的增加,紫玉米色素粗提物的清除率几乎不变,而抗坏血酸的清除率仍在不断增高,在质量浓度达到 0.04 mg/mL时,紫玉米色素的清除率达到 84.87%,由此可见,二者对·OH的清除效果与其质量浓度之间存在量效关系,在低于 0.03 mg/mL质量浓度下紫玉米色素对·OH的清除效果优于抗坏血酸。

图 4 不同质量浓度的样品溶液对羟基自由基的清除效果
3.2.3 对超氧阴离子 (O2·-)清除能力的测定结果
图 5表示不同质量浓度的样品溶液对超氧阴离子自由基的清除效果。图 5表明,不同浓度的紫玉米色素粗提物对邻苯三酚的自氧化有一定的抑制作用,对O2·-有一定的清除效果。紫玉米色素对O2·-清除率与浓度呈现一定的量效关系,峰值出现在 0.035 mg/mL左右,清除率为 85.82%,而抗坏血酸的清除率随浓度的增加不断升高,最高清除率为 82.73%,质量浓度达到 0.035 mg/mL时,紫玉米色素的清除率达到 85.82%。因此在紫玉米色素质量浓度小于0.04 mg/mL时,O2·-的清除能力为:紫玉米色素粗提物大于抗坏血酸。

图 5 不同质量浓度的样品溶液对超氧阴离子自由基的清除效果
3.2.4 对三价铁离子的还原力的测定结果
图 6为不同浓度的样品溶液还原力作用曲线。图 6表明,在所测定的浓度范围内,随着浓度的增大,紫玉米色素粗提物的吸光值不断升高,还原能力不断增强,说明样品质量浓度越大,对三价铁离子的还原作用越强,但紫玉米色素粗提物的还原能力始终低于同浓度的抗坏血酸溶液,即紫玉米色素粗提物的抗氧化活性低于同浓度的抗坏血酸溶液。

图 6 不同质量浓度的样品溶液还原力作用曲线
3.2.5 清除双氧水能力的测定
图 7表示紫玉米色素粗提物清除双氧水的能力。可见,不同浓度的紫玉米色素粗提物和抗坏血酸溶液对双氧水均有较强的清除能力。在所测浓度范围内,呈现出量效关系。随着质量浓度的增长,紫玉米色素粗提物对双氧水的清除能力逐渐增强。当紫玉米色素和抗坏血酸的质量浓度均为0.01 mg/mL时,二者对双氧水的清除率分别为 26.53%和37.73%,继续增加样品浓度,清除率平缓上升。当紫玉米色素和抗坏血酸的质量浓度为 0.04 mg/mL时,清除率分别达到了 72.55%和 89.76%。在相同浓度条件下紫玉米色素粗提物对双氧水的清除率均小于抗坏血酸。
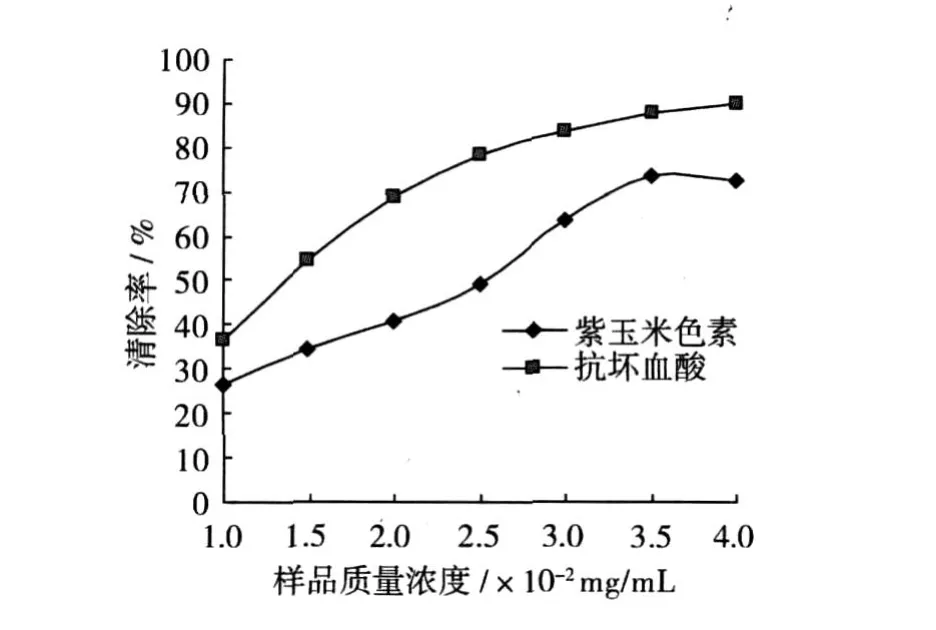
图 7 不同质量浓度的样品溶液对 H2O2的清除效果
3.2.6 Fe2+螯合能力的测定结果
图 8表示紫玉米色素对 Fe2+的螯合能力进行了测定,并以 EDTA为阳性对照。图 8显示,紫玉米色素粗提物对 Fe2+具有一定的螯合能力,随着浓度的升高,螯合 Fe2+能力逐渐增强。但紫玉米色素的螯合能力不及同等质量浓度 EDTA的螯合能力,在相同浓度条件下紫玉米色素对 Fe2+的螯合率大约为EDTA的一半。此外,紫玉米色素和 EDTA的 Fe2+螯合率的上升与浓度的增加呈现一定的量效关系。

图 8 不同质量浓度的样品溶液对 Fe2+的螯合能力
4 结论
4.1 紫玉米色素是花青素类物质。
4.2 紫玉米色素对 DPPH·自由基、羟基自由基、超氧阴离子自由基均有一定的抗氧化性,并且其效果均强于抗坏血酸;但其还原力、双氧水清除能力都略低于抗坏血酸,螯合能力不及同等浓度 EDTA的螯合能力。
4.3 紫玉米色素质量浓度在 0.01~0.02 mg/mL范围时,随着浓度的增大,对 DPPH·的清除率明显增大,当质量浓度达到 0.035 mg/mL后,清除率基本不再发生变化;紫玉米色素的 O2-·清除率的上升与浓度的增加呈现一定的量效关系,清除效果优于抗坏血酸。其色素粗提物在 0.04 mg/mL时,对 DPPH·的清除率达到 89.88%;对 ·OH的清除率达到84.87%;在 0.035 mg/mL时 ,对 O2-·的清除率达到85.82 %;
4.4 紫玉米色素粗提物总还原能力、双氧水清除能力都略低于阳性对照抗坏血酸;对 Fe2+具有一定的螯合能力,随着浓度的升高,螯合 Fe2+能力逐渐增强,但其螯合能力不及同等浓度 EDTA的螯合能力,在相同浓度条件下紫玉米色素对 Fe2+的螯合率大约为 EDTA的一半。
[1]陈丙堂.紫玉米植株茎叶色素的分离、纯化与理化性质研究 [D].泰安:山东农业大学,2009
[2]陈丙堂,李全阳,刘保申.紫玉米植株色素提取工艺及理化性质研究[J].中国粮油学报,2009,24(1):119-124
[3]谭禾平,王桂跃,陆国权.紫玉米花青素的浸提技术研究[J].食品科技,2007,35(10):182-184
[4]肖丽霞,汪芬,张超,等.提取剂对紫玉米花青素提取量的影响[J].农产品加工,2009(6):30
[5]郑灵芝,李素霞,袁勤生.大豆异黄酮抗氧化性质的研究[J].食品与药品,2006,8(2):48-50
[6]徐亚民,赵晓燕,马越,等.紫玉米色素提取工艺研究 [J].食品科技,2007,32(3):171-173
[7]樊金玲,罗磊,武涛,等.沙棘籽原花色素与葡萄籽原花青素抗氧化活性的比较 [J].食品与机械,2007,23(2):26-30
[8]ChangW Choi,SeiC Kim,Soon SHwang.Antioxidant activity and free radical scavenging capacity between Korean medici2 nal plants and flavonoids by assay-guided comparison[J].Plant Science,2002(163):1161-1168
[9]郭文莉,李敏,谢琼,等.葡萄皮色素抗氧化活性的初步研究[J].中国食品添加剂,2007,19(2):116-119
[10]朱艳华,谭军.玉米多肽抗氧化作用的研究 [J].中国粮油学报,2008,23(1):36-43
[11]盛玮,吴灵玮,谢笔钧.黑糯玉米色素的抗氧化活性研究[J].中国粮油学报,2008,23(6):88-87
[12]阎娥,刘建利,原江锋,等.蚕豆壳中原花青素的提取及抗氧化性研究[J].食品工业科技,2009,30(2):65-67
[13]Hyo Ku Lee,YangMun Choi,DongOuk Noh,et al.Antioxi2 dant effect of korean traditional lotus liquor(Yunyupju)[J].International Journal of Food Science and Technology,2005,40:709-715
[14]孙芸,徐宝才,谷文英.葡萄籽原花青素抗氧化作用的研究[J].中国粮油学报,2007,22(6):129-134
[15]吕英华,苏平,那宇,等.桑椹色素体外抗氧化能力研究[J].浙江大学学报,2007,33(1):102-107.
Antioxidaion Activities ofAnthocyanidin in Purple Corn
Xiao Chunling Zhang Shaoying Sun Ying
(Engineering College,ShanxiNo rmalUniversity,Linfen 041004)
80%ethanol and citric acid(0.2 mol/L)at ratio of 85∶15 were used to extract the pigment of pur2 ple corn.The antioxidation activities in different systemswere tested and compared with ascorbic acid by building up systemsofDPPH free radicals,hydroxyl free radicals,superoxide anion free radicals,reducing force,hydrogen peroxide and Fe2+chelating ability.Results:The extracted pigment is anthocyanidin.The pigment has a strong external antiox2 idation activity,and its ability of scavengingDPPH·is far better than ascorbic acid.The pigment at concentration of 0.04 mg/ml shows a scavenging rate forDPPH·up to 89.88%,and for·OH 84.87%;the pigment at concentra2 tion of 0.035 mg/ml shows a scavenging rate forO2-·85.82%.In addition,the general reducing force and scaven2 ging rate for hydrogen peroxide solution of the pigment are a little worse than those of ascorbic acid,and its Fe2+che2 lating ability is about half of EDTA.The antioxidation activity of the pigment is consistentwith its concentration.
purple corn,pigment,antioxidation activity
TS202.3
A
1003-0174(2011)02-0018-05
山西师范大学科研课题组(873041),山西师范大学博士科研启动基金(833089)
2010-01-13
肖春玲,女,1966年出生,教授,硕士,食品科学
