对医疗器械上市后追溯和召回制度的设计
2011-10-30北京市药品监督管理局房山分局王岩
北京市药品监督管理局房山分局 王岩

▲北京市药监局房山分局工作人员在医疗器械输出企业调研产品追踪的方式方法
近年来,医疗器械风险在临床使用中日益增加,监管部门对产品上市后的监控也在不断加强。加强医疗器械生产企业对产品的可追溯性和产品召回等管理,即强化医疗器械采购、生产、检验的质量控制及产品流向全过程的控制。笔者就医疗器械生产企业产品追溯体系的建立进行了调研。调研发现,生产企业产品销售到代理商,经销商分销记录填写不完善,致使无法追溯到临床使用,从而无法完成召回,这些问题亟须解决。笔者就其中企业产品可追溯程度和追溯途径进行了阐述。
1 产品可追溯程度
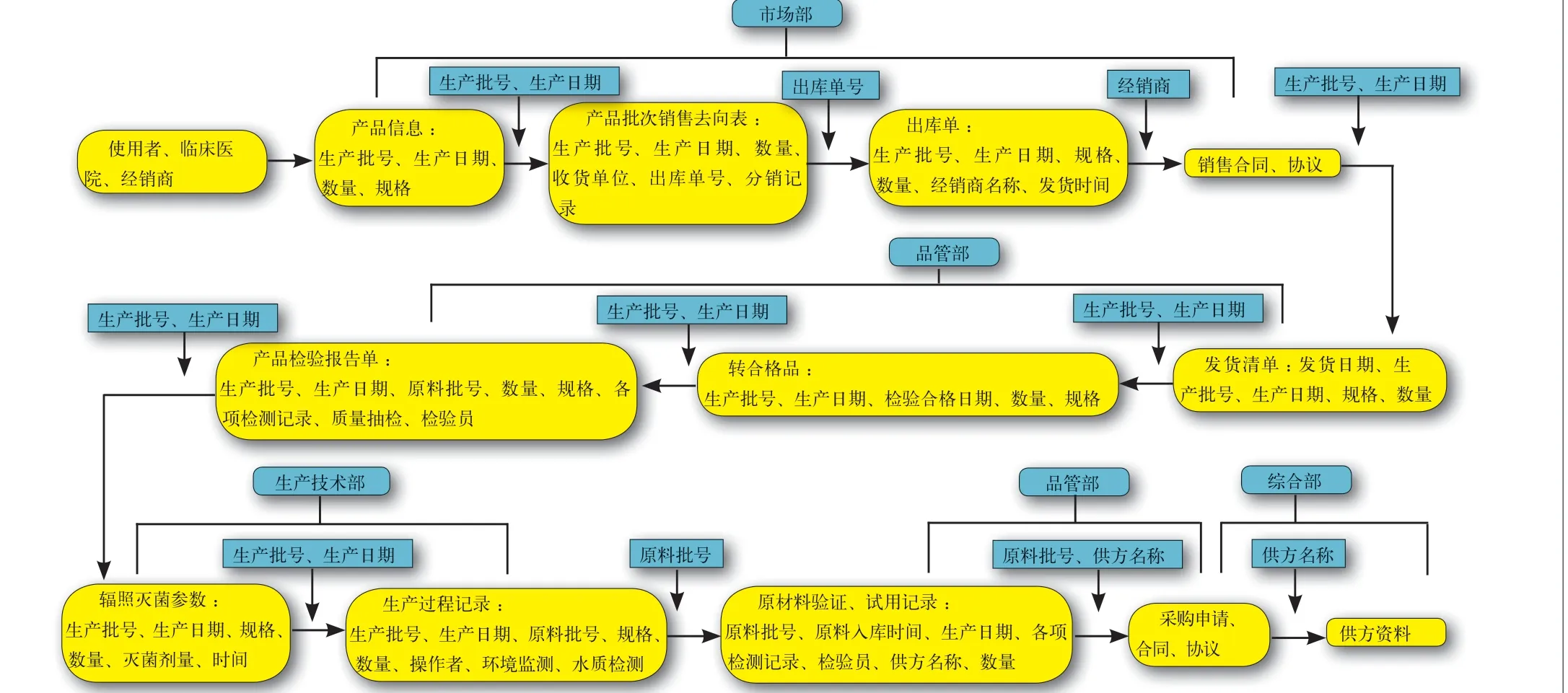
1.1 采购方面 原材料的采购,应该可以追溯到供方,并保留每批原料的采购记录,记录应包括采购申请(申请时间、申请人、批准人、原料名称、数量、规格、采购单位、到货时间)、采购厂家、数量、批号、生产日期、验收记录、供方资料等。
1.2 生产过程 应能追溯到工序操作者和检验员,每批/天的产品都应保留原料领用记录、生产记录和检验记录,原料领用记录应明确批号、名称、数量、领用时间;生产记录应明确原料批号、生产批号、生产日期、数量、规格、关键特殊工序参数记录和各工序的操作者;检验记录应明确原料批号、生产批号、生产日期、数量、规格、各项目检测结果、检验者、审核者;还应留存每批产品生产环境和水质检测记录,明确检测时间、检测者、各项目检测记录。
1.3 销售记录 应可以追溯到经销商和临床医院,企业应保留销售记录,记录包括产品流向表、销售合同、出库单、合同评审、分销记录,记录代理商名称、产品生产批号、生产日期、数量、代理商资质证明等,并按照规定进行顾客满意度调查和临床应用调查。
2 产品可追溯性途径及其信息或标识
2.1 产品标识程序文件 在整个追溯过程中,产品生产批号、生产日期和检验日期等贯穿于产品实现的全过程,是产品整个过程跟踪的唯一标识。因此,建立产品标识控制相关程序文件,避免因标识不清楚而无法实现产品的追溯是重中之重(标识可分为产品标识和状态标识)。见附图1。

▲北京市药监局房山分局工作人员查验产品流通记录
2.2 内部质量程序文件 针对产品流入到市场后的控制,企业就应对已售出产品进行质量跟踪,并在企业内部程序文件中明确一些要求:每年最少向顾客发出一次顾客满意度调查表,全方面地了解产品质量、售后服务、交货期、与同类产品相比较等情况;每年最少发放一次临床应用调查表,调查表主要针对代理商或医院临床科室对产品质量的意见或建议,以及产品规格、尺寸在应用中是否合适及改进等;通过面谈、电话、传真等方式向医院、经销商了解对产品质量、服务等的意见和建议。将收集到的信息填写质量信息反馈单,反馈到相关部门,采取纠正措施和预防措施;产品不直接进入临床的,还可以向经销商发放分销记录,要求经销商认真填写每批产品的具体流向,从而实现产品的追溯。2.3 不良事件发布及控制程序 遇特殊情况,如同类产品发生不良事件时可增加发放临床应用调查表的频次,明确具体要求。产品一旦发生质量问题或可疑不良事件时,启动不良事件报告程序、不良事件处理制度、可追溯性程序和忠告性通知发布和实施控制程序,明确可疑不良事件的报告原则、处理组织机构、报告时限、方法及报告程序等。企业各部门及时收集产品或同行业不良事件,建立了不良事件档案,同时根据每批或每天产品的去向表查到销售到哪些经销商和医院,并根据产品造成伤害事件的可能性、严重程度、影响范围和后果制定召回计划并实施召回。经销商或医院对涉及产品召回流程:经销商或医院确认产品缺陷后,制定召回计划并向监管部门提交报告,通知经销商和使用医院停止销售和使用产品,按计划召回后,向药品监管部门提交召回效果评估报告,按要求对召回产品进行处理。
2.4 重视对产品召回的管理 加强对产品召回的管理,提高召回产品重要性的认识,应本着对消费者负责,对自己负责的态度,不断增强诚信守法意识,落实召回管理办法,保证医疗器械使用的安全有效,进一步减少对消费者的危害。如对于召回有难度的医院,可以派专人去协调解决。
附图1 可追溯性流程图

附图2 经销商或医院对涉及产品召回流程
