骨肌系统影像学2011年度进展报告
2011-10-28徐文坚武乐斌
徐文坚 武乐斌
1 青岛大学医学院附属医院 2山东省医学影像学研究所
随着医学成像技术的飞速发展,骨关节系统影像学在成像技术、成像范围、获得信息的层次(宏观形态与结构、细胞/亚细胞、甚至分子水平)和临床应用等诸方面均有较多进展,其中尤以MR新技术在骨关节系统的基础和应用研究较为集中,包括MR弥散、灌注、波谱、T1ρ和T2mapping、超短TE成像、动态增强、MR关节造影等。CT能谱成像也有初步应用报告。现将一年来的进展情况进行回顾和综述。
1 骨骼影像学研究进展
传统放射学在骨骼影像学研究方面仍然集中于骨骼疾病诊断经验与教训的总结和分析,CT和MRI在本领域则主要体现在新技术的应用方面,其中主要侧重于骨肿瘤的研究。
1.1 骨肿瘤的MR研究
由于常规MRI检查具有良好的组织分辨率及多方位、多序列和多参数成像的优点,可以准确确定恶性肿瘤的范围、内部结构和对骺板、关节、血管、神经和周围组织的浸润,较早地显示髓内病变及早期骨内转移,为恶性骨肿瘤的临床分期、制定治疗方案及预后判定提供准确的依据。国内外诸多研究者分别对骨肿瘤、瘤样病变进行了相关研究,如Kim HS等[1]对软骨粘液样纤维瘤的MRI表现、上官景俊等[2]对骨肿瘤的瘤周表现、Fechtner K等[3]则对单克隆浆细胞瘤的Durie-Salmon分期和改良型Durie-Salmon分期系统进行了对比研究。众多研究者从不同方向对骨肿瘤和瘤样病变进行了详尽研究,丰富了此类病变的MR诊断与鉴别诊断知识。但本年度更多的研究集中在下列MRI新技术的应用方面。
1.1.1 骨肿瘤的MR弥散成像研究
Khoo MM等[4]回顾性分析了DWI在骨关节系统的应用情况,重点分析了骨肿瘤的DWI表现,其中瘤骨是恶性骨肿瘤影像学特征之一,因其富含钙质而少含水分子,DWI上呈极低信号,ADC值几乎接近于零。ADC值与肿瘤组织细胞密度相关。恶性肿瘤生长活跃,肿瘤细胞异常增值,细胞密度高,排列紧密,导致细胞外间隙减小,细胞外水分子扩散运动受限,ADC值减低;同时,完整细胞膜和细胞内间隔的存在也导致细胞内外水分子扩散受限制,其ADC值较正常组织减低,在DWI上肿瘤实性部分(生长活跃部分)呈较高信号。认为应用DWI 及ADC 值,结合常规MR图像,可很好显示恶性骨肿瘤的侵犯范围及其生长活跃部分所占比例,初步判断肿瘤组织成分及恶性程度。国内有研究者[5]使用全身弥散加权成像对恶性骨转移瘤进行了研究,分别评价了其敏感度、特意度和准确率。
1.1.2 骨肿瘤的MR灌注成像研究
对比增强磁共振灌注成像是目前应用最多的MR灌注成像方法,属于动态增强MR的范畴。在对比剂首次进入的过程中,含高浓度对比剂的血液快速取代不含对比剂的血液而渐进地充盈肿瘤的毛细血管床,此时对比剂主要位于血管内,血管外极少,血管内外浓度梯度最大,信号强度的改变主要由于血管内对比剂量的改变引起,因而,评价此时信号强度改变,可以反映肿瘤的血流灌注状态。Chen BB等[6]利用动态增强MR检测椎体骨髓灌注状态,用于评估缓解期急性髓型白血病,作者认为灌注状态可做为评价急性髓型白血病缓解和生存期限的重要指标。国内本方面研究报告较少。
1.1.3 骨肿瘤的MR波谱研究
骨关节系统病变成分各异,引起的磁场不均匀和磁敏感效应导致MRS检查困难。Wang CK等[7]用1.5T MR1H -波谱(MRS)研究了210例直径大于1.5cm的骨和软组织肿瘤,探讨了1H-波谱在骨关节肿瘤诊断中的准确性。检查方法为单体素PRESS法,TE 135ms,研究显示在骨肿瘤实性无硬化区胆碱SNR>3.0时多见于恶性肿瘤,所有病变诊断准确性为73.3%。Laura等对 34例骨肌肿瘤及肿瘤样病变患者进行单体素3T MRS 分析骨肌病变中的胆碱含量,也发现恶性骨肿瘤主要表现为Cho、 Cho/Cr升高,Lip峰下降,Cho峰的升高与肿瘤的恶性程度相关,Cr峰随肿瘤恶性程度的升高有降低趋势,Lip峰出现于大多数高级别的肿瘤中,特别是肿瘤坏死区或邻近坏死的区域。
国内本领域研究报告较少。尚伟等[8]曾在3.0 T上用单体素PRESS序列对椎体正常骨髓进行过1H MRS研究,认为氢质子波谱可以无创性地评估椎体骨髓变化状况。
1.2 骨肿瘤的CT研究
尽管常规二维和三维CT已广泛应用于骨肿瘤的诊断和鉴别诊断,并已取得了较丰富的经验,国内外研究者仍然还有诸多研究报告,在此不多赘述。CT新技术应用方面主要在下列几个方面。
1.2.1 骨肿瘤的CT能谱成像研究
20lO年 RSNA展示了四种CT能谱成像方法:(1)常规单源CT:不同kV条件两次连续扫描;(2)双源CT:两个球管在不同kV条件同时扫描,(3)能谱CT的快速kV切换技术;(4)双层“三明治”探测器CT:通过一次扫描,利用探测器实现光谱分离,其上层探测器吸收低能X线能量光谱,下层探测器吸收高能X线能量光谱。今年展示的双能量成像的临床研究,多数采用双源和能谱CT。常规单源CT双能量成像应用的最大限制在于需要进行高能和低能两次扫描,呼吸运动等易导致两次数据的空间位置不能完全匹配,扫描时间长。
能谱CT能提供扫描区域不同X线能量(Kev)下的CT值,为骨肿瘤成分鉴别提供了可能。2010年RSNA年会上,Tanami Y等报告了利用能谱CT研究了脂肪含量测定在骨转移瘤诊断中的可行性。相信将会有更多此类研究报告。
1.2.2 骨肿瘤的CT灌注成像研究
肿瘤的血管形成在肿瘤的生长与转移中起着重要的作用,对肿瘤的生物学行为和患者的预后亦有重大影响。CT灌注成像有助于了解恶性骨肌肿瘤内部微血管分布不均衡的特征,可定量反映肿瘤新生血管的生理特性,使非创伤方法测量微血管密度成为可能。李惊喜等[9]对20例骨肌肿瘤进行了CT灌注研究,探讨了恶性骨肌肿瘤微血管的分布模式。研究发现BF、BV、MER与肿瘤的MVD成正线性相关,肿瘤的微血管密度高时,其BF、BV、MER均较高。吴春苗等[10]则探讨了CT灌注成像在骨肉瘤疗效评价中的应用,作者认为CT灌注成像可为观察骨肉瘤治疗后改变及判断预后提供更多的客观依据。但本技术也存在一定的局限性:(1)囊性病变,无法测量相关灌注参数,如BF和BV值;(2)肿瘤较小时(横断面<2cm),肿瘤各部分之间微循环差异小,对肿瘤血管的判定帮助不大;(3)少血供的恶性骨肌肿瘤,CT灌注成像不易区分各部分差别;(4)CT灌注存在一定的辐射。
1.3 骨质疏松的影像学进展
随着老龄化时代的到来,骨质疏松越来越成为影响身体健康和生活质量的重要原因。双能X线吸收法(DXA)骨密度测量操作简单、费用较低,已成为临床诊断骨质疏松的重要方法。但DXA测量全身骨密度并不能完全表达骨的微结构,对于DXA诊断为临界值的患者还需要进一步的检查。有诸多研究者尝试用定量CT和MRI进行骨质疏松的定量诊断。
1.3.1 骨质疏松的定量CT研究
骨质疏松的定量CT研究已有较多报告,本年度则更加侧重特殊状态下骨密度的定量CT研究。Budoff MJ等[11]用定量CT测量胸椎的骨矿含量(BMD)并与腰椎的BMD比较,二者具有相关性,作者认为进行心脏检查时可用定量CT对胸椎BMD进行检测,以避免不必要的腰椎BMD检查。
路志凯等[12]则用定量CT分析了2型糖尿病患者腰椎骨密度及其相关因素,作者认为II型糖尿病患者腰椎BMD和OP患病率均与正常人基本相似;随着年龄增长、BMI的减低,此类患者腰椎BMD呈下降趋势;随着绝经年限的延长,女性患者腰椎BMD呈下降趋势。
1.3.2 骨质疏松的常规MRI研究
对于DXA诊断为临界值的患者,MRI能作出更准确的骨质疏松的判断。骨质疏松的MRI信号变化与骨组织成分变化有关,其病理异常包括骨矿物质丢失、骨基质减少、骨髓脂肪成分增加和水分含量降低等改变,由此引起MRI信号的改变。有作者报道[13],15~29岁年龄组的椎体脂肪含量为20.5%,而70~89年龄组椎体脂肪含量增加到49.4%。随着年龄增长骨髓内脂肪含量增加,使弛豫时间降低,T1和T2时间缩短,因此,MRI信号表现为T1WI上骨髓信号增高,T2WI呈中等信号。在T1WI像上由于骨髓脂肪组织的T1弛豫时间很短,可出现明显的高信号,与周围形成良好对比,不仅可以大致区别红骨髓和黄骨髓,还能反映骨髓的解剖细节,显示骨髓内因脂肪和水的比例失调所引起的信号变化,因此T1WI在骨髓检查中最为有效,不过MRI对于显示骨质疏松骨质成分变化的敏感性有一定的限度,骨质疏松的早期阶段骨髓成分变化较轻,尚不足以引起明显的磁共振信号改变。因此常规SE序列磁共振未显示信号异常,并不等于不存在骨质疏松。
1.3.3 骨质疏松的MR动态增强与灌注扫描研究
骨质疏松患者显微镜下单位面积内毛细血管和血窦数目减少,脂肪细胞数量增加,导致脂肪含量增加。国内外对此均有相关研究,证明MR动态及灌注扫描对于骨质疏松的检测具有重要价值。
Griffith JF 等[14]利用MR灌注扫描研究了老年女性骨质疏松骨矿物质丢失情况,认为选择性灌注指标和脂肪含量测定对于判定骨矿物质丢失的快慢非常敏感。Demmler等MR动态增强扫描研究显示骨质疏松腰椎最大对比增强率、动态增强曲线斜率低于正常,表明骨质疏松椎体的血液灌注低于正常,也说明了骨质疏松和血管因素有很大关系。
国内如杨海涛等[15]用MR动态增强扫描观察去势兔骨质疏松腰椎的骨髓灌注变化,显示腰椎骨髓的血液灌注明显下降,免疫组化显示骨质疏松后骨髓组织的MVD明显减少。认为动态增强MRI能提供骨质疏松后骨髓的血供信息,其指标Emax和ES与BMD和组织MVD均有很好的相关性,对于骨质疏松的诊断和治疗有一定的指导意义。
1.3.4 骨质疏松的T2mapping研究
骨质疏松造成骨髓脂肪含量增加,影响骨髓本身的T2值,利用脂肪信号在各弛豫技术(T2*、T2map)过程中引起的信号变化;T2弛豫时间也与骨矿物质密度(BMD)有一定的相关性,弛豫时间的长短可反映骨小梁的多少。因此,T2*、T2mapping可获得更多骨髓及骨小梁微结构的信息,从而使骨质疏松的判别更准确。
Brismar等动物实验研究显示大鼠骨质疏松的T2*值与对照组相比有显著增加,而横向弛豫率R2*值减少,作者认为T2*及T2mapping可很好表达骨质疏松骨小梁的疏松情况。国内吴何嘉等[16]用MR弛豫技术与双能X线吸收法评价大鼠骨质疏松的研究表明,T2*及T2mapping的测量值都能很好表达骨质疏松症中骨小梁的疏松情况。作者认为T2mapping是骨质疏松较佳的判别指标,与DXA结合可更精确地诊断骨质疏松的程度。
1.3.5 骨质疏松的MRS研究
MRS作为一种无创性影像学检查方法,通过测量骨髓中水和脂肪含量,可以了解骨质疏松骨髓的生理、病理变化,为评价骨质疏松的骨质量及预防其引发的骨折提供一个全新的思路。国内外研究在本领域均有不少报告,主要用1H谱研究水脂变化,也有研究者尝试用31P谱进行研究。
Li Xiaojuan等[17]用3T MR1H谱对骨质疏松椎体内脂肪含量进行了定量研究,认为活体高场MRS可对骨质疏松椎体进行定量评价,并可预测骨折的发生。Cao Haihui等在鼠模型中,对骨无机物和基质密度进行定量31P及1H MRS分析,结果显示MRS可用于骨质疏松和代谢性骨病的鉴别诊断。李冠武等[18]用MRS动态评价了骨质疏松模型兔骨髓质量变化规律,认为MRS可早期、无创性地动态评价骨质疏松骨髓质量,为研究骨质疏松骨髓发展变化规律及疗效评估提供了一种新的思路。
1.4 骨髓MR分子探针与示踪成像研究
随着超顺磁性MRI对比剂的研制成功及MRI设备及方法的快速发展,为无创伤性地在活体内动态监测移植细胞的迁移、生存状态等情况提供了可能。目前,超高场强(7.0T以上)MR设备的空间分辨率约为50μm×50μm×50μm,已接近分辨单一细胞的水平。MRI可对移植入体内的干细胞进行动态监测,使其理论上可对移植的细胞进行活体示踪。为使移植细胞能在MRI 上特异性显示,需采用MR示踪剂或分子探针。
通过MR示踪剂标记干细胞,可利用MR观察和测定骨髓内MR信号强度的变化程度、范围和分布,以评价体内干细胞数量、分布和分化,在活体上了解移植后干细胞的分布、迁徙、分化及转归等生物学行为,评估干细胞移植的效果,同时研究MR示踪剂对活体干细胞的活性、能力和生物学行为的影响,为骨髓干细胞移植的临床观察与疗效检测提供可靠的无创性方法[19]。
2 关节影像学研究与进展
关节影像学研究主要集中在关节软骨,是近期研究的焦点之一。研究方法主要集中于MR新技术、新方法,可显示软骨的形态、体积、厚度和局灶性缺损,还可以反应软骨的代谢和生化信息,从而早期发现软骨病变。
2.1 T1ρ成像关节软骨研究
T1ρ成像技术主要评价处于射频脉冲磁场下组织自旋弛豫值。该技术采用自旋锁定脉冲序列,设定系列自旋锁定时间,采集一系列T1ρ加权图然后重建为彩色T1ρ图,并对ROI进行定量分析。T1ρ成像可用于标记软骨蛋白多糖分布,对蛋白多糖丢失具有非常高的敏感性和特异度。蛋白多糖丢失与T1ρ值延长之间存在较强的相关性。该技术目前尚处于临床前期研究阶段,国外仅有少量文献报告。Bolbos等通过对急性前交叉韧带损伤病人的对照研究,显示损伤组半月板及周围膝关节软骨T1ρ值与正常对照组有差异,从而证实损伤可以引起周围半月板及软骨的生化性质改变。Zhao Jian等研究发现,骨关节炎患者关节面下骨髓水肿样病变周围软骨的T1ρ值明显高于对照组。
2.2 T2mapping关节软骨研究
T2mapping技术可以通过T2弛豫时间图进行量化。T2弛豫时间测量是一种检测组织固有特性的无创性方法。T2弛豫时间成像(T2relaxation times imaging)的基本原理是通过采集不同的TE和TR的一系列加权图,然后计算出每个体素的T2值.最后使用图像后处理软件处理并用不同颜色表达形成T2图。影响T2值的因素主要有软骨组织内各向异性(胶原纤维的排列)、胶原浓度以及水含量。国内外有众多研究者对关节软骨进行了系列研究,也成为本领域的热点之一。
Mosher TJ[20],Mamisch TC[21]. Nishii T[22],Judong Pan[23]等分别对负重与非负重状态下关节软骨、软骨修复术后、骨性关节炎关节软骨T2演变与形态学等方面进行了研究,结果显示T2值及T2mapping可较好显示关节软骨的形态、早期病变等。Mosher TJ等[20]多中心骨关节炎研究显示,在定量显示关节软骨损伤的形态和成分方面,T1ρ、T2值具有高度地一致性。也有研究显示对骨关节炎患者,其半月板的T1ρ和T2值不同,T2值的变化比T1ρ值更能反映纤维软骨的改变,T1ρ值变化则更能反映透明软骨的改变,并且T1ρ和T2值的变化与临床症状相关[24]。Marinelli等还应用T2mapping技术对19个患者的95个椎间盘进行了研究,显示T2弛豫时间改变与椎间盘退变的程度以及患者年龄相关。
国内此类研究相对较少,李五根等[25]对41例OA患者的膝关节软骨进行T2*map成像证明MR T2*map成像可用于评价关节软骨生物组织构成的变化,并在早期关节软骨退变的诊断中具有一定的临床应用价值。
2.3 MR增强扫描研究
MR常规增强扫描已常规应用并取得成熟的经验,近来一些特殊的增强技术和方法被应用到基础和临床研究中。
2.3.1 MR延迟增强关节软骨研究
关节软骨MR延迟增强成像是根据有关固定电荷密度在组织中电离子分布的理论进行的磁共振成像。由于组织中固定电荷密度主要由糖胺聚糖分子中的羧基和硫基所决定,因此可通过电荷密度成像反映粘多糖的含量。
Miese FR[26]等应用MR延迟增强技术对类风湿性关节炎掌指关节软骨进行了研究,病变关节软骨延迟时间低于正常软骨,还可清楚显示关节软骨形态。也有研究者对膝关节骨关节炎进行研究,发现无关节间隙狭窄侧的软骨内糖胺聚糖浓度要高于有关节间隙狭窄侧。
国内郑卓肇等[27]使用离体牛软骨测量软骨T1值、T2值及延迟钆增强软骨MR成像指数(T1Gd),证明MR弛豫时间(T2、T1、和T1Gd)均可反映软骨生化成分的早期改变。其中,T2主要反映胶原的变化,T1Gd主要反映糖胺聚糖的含量,而T1则同时受胶原和糖胺聚糖的影响。张国伟等[28]总结了一组30例髌骨软化症延迟增强扫描的表现,显示延迟增强扫描能清楚显示软骨退变各期的表现,对软骨退变的早期诊断有价值。
2.3.2 USPIO-MR增强扫描研究
USPIO为MR特异性对比剂,以前主要用于肝脏病变的检查。Lefevre S等[29]利用兔化脓性关节炎模型进行了USPIO-MR增强扫描研究,结果显示感染的滑膜区在常规T1WI增强扫描上明显强化,在USPIO T2*增强扫描上呈明显低信号,表明含USPIO的巨噬细胞在MR上可精确显示滑膜感染状况,但目前未应用于临床研究。
2.4 软骨3D序列成像研究
3D序列普遍应用于软骨的厚度及体积的测量。3T高分辨率3D MR还可发现软骨及骨关节病早期改变。目前,国内外本技术对大关节软骨的研究较多[30],多集中于髋、膝关节软骨而对手足小关节疾病的研究较少。
2.5 MR关节造影对软骨损伤的研究
MR关节造影是在X线透视或超声引导下关节内注入对比剂(如Gd-DTPA),在不同时间进行MR检查。国内外均有较多研究报告,主要用于肩关节、髋关节盂唇损伤、关节软骨缺损、软骨剥脱、半月板撕裂及术后复查、骨软骨病变或关节内游离体等,有助于关节内病变诊断及软骨损伤的分级[31-32]。
2.6 MR超短TE序列对软骨损伤的研究
超短回波时间(ultrashort echo time,UTE)脉冲序列设计的目的是解决较难激发短T2成分并在其衰减之前快速采集其信号的问题,可选择性突出短T2成分而减少来源于长T2成分的信号。UTE成像可显示关节软骨分为深层的高信号层和表面的低信号层,软骨缺损亦可清晰显示。另外,UTE成像还可区分半月板的红区和白区。
2.7 MR波谱成像研究
2.7.123Na谱MR成像技术对软骨损伤的研究
钠离子在人体内散在分布,在软骨组织中以糖胺聚糖的形式存在,后者是软骨的构建基础。23Na谱MR成像技术的原理是根据钠分布图像间接显示蛋白多糖崩解的区域。23Na原子带有正电荷,因此局部23Na浓度与软骨内固定电荷密度具有直接的关系。正常软骨与关节软骨病变的23Na空间分布存在差异,软骨中糖胺聚糖的丢失也预示着骨性关节炎和椎间盘退变的开始。传统MRI成像不能直接反应糖胺聚糖的浓聚。目前,国外本领域研究主要使用7.0 T MR研究关节软骨,初步研究显示骨性关节炎软骨的糖胺聚糖的降解区域中23Na谱信号强度有明显下降[33-35],为早期骨关节炎提供一种无创的诊断方法(图1)。国内还鲜有报告。
2.7.213C MR波谱成像
常规MR波谱多用1H成像,但在骨关节领域有诸多限制。13C MR波谱成像尚处于初步探索阶段。MacKenzie JD等[36]用超极化13C标记丙酮酸盐进行鼠关节炎的MR波谱分析,结果显示炎症组13C-丙酮酸盐向13C-乳酸盐转化增多,从而可提示感染性关节炎可能。国内尚未见相关研究报告。
2.8 关节CT能谱成像
双能或能谱CT扫描利用物质对不同能量X线衰减特性的不同,从而表现出不同的CT值差异,有助于区分、标识、分离并鉴别不同的物质,从而获得超出形态学成像的更多特殊信息。近年来的体内外研究显示能谱CT可以区分尿酸为主和钙盐为主的泌尿系结石。能谱CT检出痛风患者尿酸盐结晶及膝关节交叉韧带损伤也渐有报告,初步结果显示双能扫描可检测出局部超出标准量4倍以上的尿酸盐沉积,从而可发现早期的关节和骨质破坏,也可通过测量单个痛风石的体积和总痛风石量的变化来监测治疗效果,检出痛风石的敏感性为 100%,特异性为89%[37](图2)。国内也有作者正在进行这方面的研究,但尚未见报道。

图1 [37] 膝关节7.0T MR高分辨率成像a:3D SPGR成像;b:糖胺聚糖化学位移饱和传递成像;c:23Na谱成像。b和c图中的彩色部分代表从0到1.3ppm的MTRasym值和Na的信噪比(SNR),显示软骨修复区域比周围正常组织的信号减低。
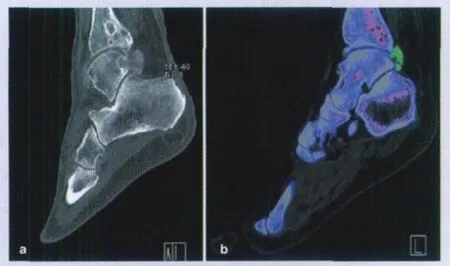
图2 [37] 踝关节双能CT成像a:在运用物质分离算法前,除显示胫骨远端及距骨的骨质侵蚀之外,显示关节内和关节周围软组织内的高密度物质。b:运用物质分离算法后,关节内和关节周围软组织内的高密度物质显示为绿色(表示物质分离算法判定这些体素内含有尿酸),与痛风结节的位置一致。

3 软组织影像学研究与进展
软组织影像学检查主要用于软组织损伤、肿瘤及感染等病变的诊断与鉴别诊断,其中近来尤其侧重于关节周围肌腱和韧带损伤的研究。检查方法除常规CT、MRI成像外,越来越多的新技术、新方法用于临床和科研之中,包括MR关节造影、MR波谱成像、MR超短回波时间成像、CT能谱成像等。3.1 软组织常规MRI与MR关节造影研究
软组织常规MRI与MR关节造影研究目前文献主要针对于关节周围肌腱和韧带的损伤研究,以大关节多见,包括肩关节、肘关节、髋关节、膝关节和踝关节等,国内外均有较多文献报告。
肩袖损伤MRI表现为冈上肌腱、冈下肌腱、小圆肌腱、肩胛下肌腱的完全性或部分性撕裂。国内外有诸多研究报告[38-40]显示MR关节造影评价肩袖损伤优于常规MRI。
肘关节常规MRI可有效评价尺侧副韧带完全性撕裂,但难于发现部分性撕裂。而后者常常需要外科手术治疗,故对其明确诊断很必要。关节造影则容易显示对比剂外渗至尺侧副韧带的附着点远端,其敏感性和特异性分别为95%和85%。完全性撕裂MR关节造影可见对比剂从缺损处向周围软组织渗漏。
股骨头圆韧带损伤见于1/3髋关节损伤的患者,MR关节造影可以评价圆韧带损伤情况。正常者在MR关节造影上表现为从股骨头凹延伸到髋臼窝的低信号带,损伤时表现为圆韧带不连续、不光整和信号异常[41]。
踝关节扭伤约85%合并外侧副韧带损伤,其中距腓前韧带撕裂占66%、距腓前韧带合并跟腓韧带撕裂占20%。严重者,距腓后韧带也可发生损伤。约10%~30%的患者会发展为踝关节不稳定,此类患者常需手术修复。因此,准确诊断韧带撕裂非常重要。常规MRI表现为韧带形态消失、中断或呈波浪状,有时与骨折并存,但其敏感性较差[42]。Chou等曾比较50例踝关节不稳患者的常规MRI和MR关节造影表现,结果显示MR关节造影诊断距腓前韧带和跟腓韧带撕裂的敏感性分别达到100%和90%,而常规MRI检查只有50%。
3.2 软组织MRS研究
软组织MRS研究所用方法不同,目前有报告使用1H MRS、31P MRS和23Na-MRS的研究报告。
马玲等[43]对24名健康志愿者的比目鱼肌和胫骨前肌进行了3T1H MRS检查,测量了其代谢物的弛豫时间值(T1、T2值)。认为代谢物弛豫时间值的测定对于实现骨骼肌1H-MRS的绝对定量研究及扫描参数优化具有重要意义。
31P—MRS主要通过测定磷代谢物的相对浓度和分布来反映组织细胞的能量代谢状态,监测肌肉组织的生物能量的转换利用。因此,磷谱能探测高能磷酸物质和磷脂的含量,对研究活体组织的能量代谢具有不可替代的作用,是研究肌肉病变的重要工具。此类研究主要来自国外的报告,国内报告少见。
23Na谱成像国外也有报告,主要用于关节软骨研究, Juras V等[34]利用7T MR和15通道Na线圈对慢性跟腱病进行了23Na谱成像研究,通过与健康组的对比研究,发现慢性跟腱病患区23Na的信号噪声比(SNR)明显升高。由于23Na的信噪比与糖胺聚糖含量呈正相关,因此可检出慢性跟腱病蛋白多糖的升高,有助于发现和辨认早期跟腱病的生化变化(图3)。国内未见相关报告。
3.3 软组织的MR超短回波时间成像
软组织MR超短回波时间成像目前主要用于肌腱、韧带研究,尤其是肌腱、韧带或关节囊与骨连接处,此附着处肌腱与韧带容易损伤。正常情况下,此区域肌腱、韧带均为短T2值,在常规序列上少或无信号,使得常规MRI无法鉴别上述结构。使用超短回波时间成像序列,可显示将起止点区不同短T2成分组织的信号区分开来,如起止点上的钙化与非钙化、成纤维结缔组织和骨组织等,有利于对解剖结构的认识和对疾病的诊断。
3.4 软组织CT能谱成像
由于肌腱、韧带的密度与周围软组织相似,缺乏足够的密度对比,常规CT不能对其明确区分。有研究表明,由于能谱CT可以提供不同的能量同时同步进行扫描、以及肌腱、韧带成分中胶原分子侧链上的密实羟(基)赖氨酸和羟脯氨酸对不同能量的X线的衰减差异较明显,故能谱CT成像有可能成为显示肌腱、韧带的理想成像手段[44]。
4 骨关节系统术后影像学研究与进展
肌骨系统手术数量每年都在递增,1%~5%的患者术后发生并发症需要临床处理,如骨折、感染、骨溶解、假体松动与磨损或断裂、肿瘤术后复发等。术后检测主要依赖于影像学检查。
4.1 影像学检查方法
影像学检查仍然以X线平片为主,但对内部结构、软组织改变无法清晰显示。关节造影常与关节穿刺抽液同时进行,以显示关节腔内状况及置入物与承载骨之间的关系。超声对骨关节术后评价也有重要价值,尤其是评价软组织有优势,包括判断肌腱和韧带完整性等,还用于关节积液导引穿刺抽吸。
CT可直观显示假体、骨水泥及相邻骨质结构,但对有金属置入物者,其应用受到限制。CT能谱成像配合相应的去伪影技术,有助于去除金属置入物所致伪影,对术后随访和并发症检出具有重要价值[45-46]。
MRI可清楚显示术后软组织肿块、血肿与水肿,并有助于良恶性肿块的鉴别,能显示平片和CT无法显示的结构,如肌腱、韧带、关节软骨、半月板、骨髓等,特别是能检出椎管内肿瘤及术后复发。 L Xiaojuan等[47]对前交叉韧带重建术后膝关节软骨MR T1ρ and T2的研究,有助于发现交叉韧带术后关节软骨的变化。但金属置入物伪影严重影响MRI对骨关节术后的评价。
核素扫描无金属伪影,是观察术后感染的有效方法。目前,常用的放射性核素主要有以下几种:99mTc、MDP、111In 和67Ga。近年来,18F-FDG PET逐渐替代传统的闪烁显像,其在探测感染和炎症方面的潜力引起人们的关注。
4.2 骨关节术后并发症影像学研究
骨关节术后并发症繁多,包括骨折、感染、骨溶解、假体松动与磨损或断裂、肿瘤术后复发等,影像表现多样,区分术后正常与异常表现较困难,原因包括术后器官结构发生改变、偏离正常解剖,假体或植入物与自然结构混杂,加之对手术方式和术后表现认识不足,造成肌骨术后影像诊断的困难。目前,术后并发症研究也越来越引起国内外研究者重视[47-48]。
4.3 骨关节术后去除金属伪影的研究
4.3.1 能谱CT去除金属伪影研究
骨关节术后金属植入物产生的伪影,严重影响对病变的观察,甚至造成漏诊、误诊。常规CT对技术伪影无有效办法去除。能谱CT在单能量成像的基础上应用去伪影技术,可有效降低金属置入物伪影,使金属周围结构的显示清晰度明显提高[45-46]。国内外研究者均在进行详细研究。
4.3.2 MR去除金属伪影研究
MRI金属伪影同样严重影响对骨关节术后的评价,可通过增加带宽、使用快速自旋回波替代常规自旋回波序列,避免使用梯度回波序列,应用STIR序列(Short TI Inversion Recovery)替代T2脂肪抑制序列,降低回波时间,应用大频率编码矩阵,频率编码方向平行于植入物的长轴方向等措施来减轻金属伪影。Cha JG 等[49]应用IDEAL T2WI和IDEAL T1WI增强扫描序列降低了MR金属伪影,有效改善了图像质量,可清楚显示腰椎术后硬膜囊及周围肌肉(图4)。

图4 [49] 不同MR检查序列金属伪影比较(a)常规增强FS-T1WI,(c)FS-T2WI硬膜囊显示不清,(b)增强IDEAL T1WI和(d)IDEAL T2WI序列清楚显示硬膜囊。
对比国内外本年度的影像学进展,在能谱CT的实验研究、关节软骨、骨质疏松的影像学评价、骨髓MR分子探针与示踪成像等方面,国内外基本同步;而对于影像学新技术,尤其是MR新技术在肌腱与韧带、关节疾病、骨肿瘤等方面的研究,国内尚有较大差距。
[1] Kim HS, Jee WH, Ryu KN, et al. MRI of chondromyxoid fibroma[J]. Acta Radiol, 2011, 52: 875-80.
[2] 上官景俊, 徐文坚, 李文, 等。骨肿瘤与瘤样病变周围组织影像表现分析[J]. 中华放射学杂志, 2011,45(5): 463-467.
[3] Fechtner K, Hillengass J, Delorme S, et al. Staging Monoclonal Plasma Cell Disease: Comparison of the Durie-Salmon and the Durie-Salmon PLUS Staging Systems[J]. Radiology, 2010, 257: 195-204.
[4] Khoo MM, Tyler PA, Saifuddin A, et al. Diffusion-weighted imaging (DWI) in musculoskeletal MRI: a critical review[J]. Skeletal Radiol, 2011, 40: 665-681.
[5] 汤宪娥, 赵卫东. 全身弥散加权成像对恶性肿瘤骨转移诊断试验的系统评价[J]. 中国医学影像技术, 2010, 26(11): 2160-2163.
[6] Chen BB, Hsu CY, Yu CW. Dynamic Contrast-enhanced MR Imaging Measurement of Vertebral Bone Marrow Perfusion May Be Indicator of Outcome of Acute Myeloid Leukemia Patients in Remission[J]. Radiology, 2011, 258: 821-831.
[7] Wang CK, Li CW, Hsieh TJ, et al. In vivo1H MRS for musculoskeletal lesion characterization: which factors affect diagnostic accuracy? [J] NMR Biomed, 2011, 25. [Epub ahead of print]
[8] 尚伟, 余卫, 林强, 等. 椎体骨髓状况的磁共振波谱评估[J]. 实用放射学杂志, 2010, 26(1): 63-66.
[9] 李惊喜, 王宇, 王林森, 等. CT灌注对恶性骨肌肿瘤微血管分布模式的研究[J]. 实用放射学杂志, 2010, 26(11): 1627-1630.
[10] 吴春苗, 靳激扬, 施鑫, 等. CT灌注成像在骨肉瘤疗效评价中的应用[J]. 中国医学影像技术, 2011, 27(6): 1272-1275.
[11] Budoff MJ, Hamirani YS, Gao YL, et al. Measurement of Thoracic Bone Mineral Density with Quantitative CT[J]. Radiology, 2010, 257: 434-440.
[12] 路志凯, 李健丁, 王冠民, 等. CT定量分析2型糖尿病患者腰椎骨密度及其相关因素[J]. 中国医学影像技术, 2011, 27(2): 384-387.
[13] Li X, Kuo D, Schafer AL, et al. Quantification of vertebral bone marrow fat content using 3Tesla MR spectroscopy: reproducibility, vertebral variation, and applications in osteoporosis[J]. J Magn Reson Imaging, 2011, 33: 974-979.
[14] Griffith JF, Yeung DK, Leung JC, et al. Prediction of bone loss in elderly female subjects by MR perfusion imaging and spectroscopy[J]. Eur Radiol, 2011, 2: 1160-1169.
[15] 杨海涛, 王仁法, 宋少辉, 等. 动态增强MRI评价去势兔骨质疏松腰椎骨髓灌注:与BMD和MVD对照研究[J]. 临床放射学杂志, 2010, 29(1): 118-123.
[16] 吴何嘉, 刘斯润, 弓健, 等. MR弛豫技术与双能X线吸收法评价大鼠骨质疏松的比较研究[J]. 中华放射学杂志, 2010, 44(1): 96-100.
[17] Li XJ, Kuo D, Anne BS, et al, Quanti cation of Vertebral Bone Marrow Fat Content Using 3Tesla MR Spectroscopy: Reproducibility, Vertebral Variation, and Applications in Osteoporosis[J]. JOURNAL OF MAGNETIC RESONANCE IMAGING, 2011, 33: 974–979.
[18] 李冠武, 汤光宇, 刘勇, 等. MRS动态评价骨质疏松模型兔骨髓质量变化规律[J]. 实用放射学杂志, 2011, 27(4): 624-627.
[19] Straathof R, Strijkers GJ, Nicolay K. Target-Specific Paramagnetic and Super-paramagnetic Micelles for Molecular MR Imaging[J]. Methods Mol Biol, 2011, 771: 691-715.
[20] Mosher TJ, Zhang Z, Reddy R,et al. Knee Articular Cartilage Damage in Osteoarthritis: Analysis of MR Image Biomarker Reproducibility in ACRIN-PA 4001 Multicenter Trial[J]. Radiology, 2011, 258: 832-842.
[21] Mamisch TC, Trattnig S, Quirbach S, et al. Quantitative T2Mapping of Knee Cartilage: Differentiation of Healthy Control Cartilage and Cartilage Repair Tissue in the Knee with Unloading—Initial Results[J]. Radiology, 2010, 254: 818-826.
[22] Nishii T, Shiomi T, Tanaka H, et al, Loaded Cartilage T2Mapping in Patients with Hip Dysplasia[J]. Radiology, 2010, 256: 955-965.
[23] Pan JD, Pialat J-B, Joseph T, et al, Knee Cartilage T2Characteristics and Evolution in Relation to Morphologic Abnormalities Detected at 3-T MR Imaging: A Longitudinal Study of the Normal Control Cohort from the Osteoarthritis Initiative[J]. Radiology, 2011, 261: 507-515.
[24] Cotofana S, Eckstein F, Wirth W, et al. In vivo measures of cartilage deformation: patterns in healthy and osteoarthritic female knees using 3T MR imaging[J]. Eur Radiol, 2011, 21: 1127-1135.
[25] 李五根, 龚洪翰, 曾献军, 等, 磁共振T2*map成像在膝关节骨性关节炎中的应用价值[J]. 实用放射学杂志, 2010,26(5): 711.
[26] Miese FR, MD, Ostendorf B, Wittsack HJ, et al. Metacarpophalangeal Joints in Rheumatoid Arthritis: Delayed Gadolinium-enhanced MR Imaging of Cartilage—A Feasibility Study[J]. Radiology, 2010, 257: 441-447.
[27] 郑卓肇, 李选, 刘颖, 等.弛豫时间与软骨生化成分的相关性研究[J].中国医学影像学杂志, 2011, 18(4):336-341.
[28] 张国伟, 张光辉, 赵善娜, 等. 髌骨软化症在MR延迟增强扫描中的表现[J]. 临床放射学杂志, 2010, 29(4):498-500.
[29] Lefevre S, Ruimy D, Jehl F, et al. Septic Arthritis: Monitoring with USPIO-enhanced Macrophage MR Imaging[J]. Radiology, 2011, 258: 722- 728.
[30] 谢海柱. 3T磁共振3D-FS-SPGR序列对膝关节软骨损伤的诊断价值[J]. 医学影像学杂, 2011, 1: 269-273.
[31] Blankenbaker DG, Ullrick SR, Kijowski R, et al, MR Arthrography of the Hip: Comparison of IDEAL-SPGR Volume Sequence with Standard MR Sequences in the Detection and Grading of Cartilage Lesions[J]. Radiology, 2011, 261: 863-871.
[32] 田春艳, 郑卓肇, 李选, 等. 上方盂唇前后向撕裂的肩关节MR造影评价[J]. 中华放射学杂志, 2010, 44(6):630-634.
[33] Schmitt B, Zb ň , Stelzeneder D, et al. Cartilage Quality Assessment by Using Glycosaminoglycan Chemical Exchange Saturation Transfer and23Na MR Imaging at 7T[J]. Radiology, 2011, 260: 257-264.
[34] Juras V, Zb ň , Pressl C, et al. Sodium MR Imaging of Achilles Tendinopathy at 7T: Preliminary Results[J]. Radiology, Published online November 4, 2011.
[35] Trattnig S, Welsch GH, Juras V, et al.23Na MR Imaging at 7T after Knee Matrix–associated Autologous Chondrocyte Transplantation Preliminary Results[J]. Radiology, 2010, 257: 175-184.
[36] MacKenzie J D, Yen Y-F, Mayer D, et al. Detection of Inflammatory Arthritis by Using Hyperpolarized13C-Pyruvate with MR Imaging and Spectroscopy[J]. Radiology, 2011, 259: 414.
[37] Glazebrook KN., Guimar es L S., Murphy N S, et al. Identification of Intra-articular and Periarticular Uric Acid Crystals with Dual-Energy CT: Initial Evaluation[J]. Radiology, 2011, 261: 516-524.
[38] Halma JJ, Eshuis R, Krebbers YM, et al. Interdisciplinary interobserver agreement and accuracy of MR imaging of the shoulder with arthroscopic correlation[J]. Arch Orthop Trauma Surg, 2011,13. [Epub ahead of print]
[39] Steurer-Dober I, Rufibach K, Hodler J, et al. Do Patients with Structural Abnormalities of the Shoulder Experience Pain after MR Arthrography of the Shoulder? [J] Radiology, 2010, 256: 870-878.
[40] 田春艳, 郑卓肇, 李选, 等. 肱二头肌长头腱撕裂的肩关节MRI评价[J]. 中华放射学杂志, 2010, 44(1): 70-73.
[41] Blankenbaker DG, De Smet AA. Hip injuries in athletes[J]. Radiol Cli North Am, 2010, 48: 1155-1178.
[42] Anastasi G, Cutroneo G, Bruschetta D, et al. Three-dimensiona volume rendering of the ankle based on magnetic resonance image enables the generation of images comparable to real anatomy[J].Anat, 2009, 215: 592-599.
[43] 马玲, 潘碧涛, 孟悛非, 等. 小腿骨骼肌代谢物的1H—MR波谱绝对定量研究[J]. 中华放射学杂志, 2010, 44(9): 963-968.
[44] 俞冠民, 李惠民. 足踝部肌腱的多层CT低剂量三维成像研究[J]. 中华放射学杂志, 2011, 45: 270-273.
[45] Bamberg F, Dierks A, Nikolaou K, et al. Metal artifact reduction by dua energy computed tomography using monoenergetic extrapolation[J Eur Radiol, 2011, 21(7): 1424-1429.
[46] 李晓莉, 冯卫华, 董诚, 等. CT能谱成像技术减除金属置入物伪影的定量实验研究[J]. 中华放射学杂志, 2011, 45(8): 736-739.
[47] Li XJ, Kuo D, Theologis A, et al. Cartilage in Anterior Cruciat Ligament–Reconstructed Knees: MR Imaging T1ρ and T2—Initia Experience with 1-year Follow-up[J]. Radiology, 2011, 258: 505514.
[48] Studler U, White LM, Naraghi AM, et al. Anterior Cruciate Ligamen Reconstruction by Using Bioabsorbable Femoral Cross Pins MR Imaging Findings at Follow-up and Comparison with Clinica Findings[J]. Radiology, 2010, 255: 108-116.
[49] Cha JG, Jin W, Lee MH, et al. Reducing metallic artifacts i postoperative spinal imaging: usefulness of IDEAL contrast-enhance T1- and T2-weighted MR imaging--phantom and clinical studies[J Radiology, 2011, 259: 885-893.
