奥美沙坦酯对慢性心力衰竭小鼠肾脏损伤的保护作用*
2011-10-24卢晓梅金玉楠于艳秋张海鹏
卢晓梅, 金玉楠, 于艳秋, 张海鹏
(中国医科大学基础医学院病理生理学教研室,辽宁 沈阳 110001)
奥美沙坦酯对慢性心力衰竭小鼠肾脏损伤的保护作用*
卢晓梅, 金玉楠, 于艳秋△, 张海鹏
(中国医科大学基础医学院病理生理学教研室,辽宁 沈阳 110001)
目的探讨奥美沙坦酯对慢性心力衰竭小鼠肾脏损伤的影响。方法健康C57小鼠分为假手术组(sham组)、慢性心力衰竭组(CHF组)和奥美沙坦酯治疗组(OLM+CHF组)。以冠状动脉左前降支结扎法建立慢性心力衰竭小鼠模型,其中奥美沙坦酯治疗组以10 mg/kg剂量每天胃饲。12周时观察各组小鼠心率、血压、心功能状况、血肌酐、血尿素氮、血浆和肾脏血管紧张素Ⅱ水平;real-time PCR法检测肾脏肾素、血管紧张素1型受体(AT1R)和血管紧张素原(AGT)的表达情况,PAS染色观察肾组织结构变化。结果与shan组相比,CHF组和OLM+CHF组左室舒张末期内径(LVDd)和左室收缩末期内径(LVDs)显著增加(P<0.05),短轴缩短率(FS)和射血分数(EF)显著降低(P<0.05)。与sham组相比,CHF组收缩压、血肌酐和血尿素氮含量显著增高,OLM+CHF组以上指标较CHF组均显著降低(P<0.05)。与sham组相比,CHF组血浆和肾脏血管紧张素Ⅱ水平增高,肾素、AT1R和AGT表达增高(P<0.05),OLM+CHF组肾脏血管紧张素Ⅱ水平、肾素、AT1R和AGT表达较CHF组均显著降低(P<0.05)。CHF组PAS染色可见肾小球系膜区扩张,肾小管间质PAS阳性染色物明显增多。OLM+CHF组肾小球系膜区和肾小管间质PAS染色阳性物质与CHF组相比明显减少。结论慢性心力衰竭可使肾内肾素血管紧张素系统激活并导致肾脏损伤,奥美沙坦酯通过抑制血管紧张素Ⅱ起到肾脏保护作用。
奥美沙坦酯; 慢性心力衰竭; 肾损伤
慢性心力衰竭(chronic heart failure,CHF)病人出现肾功能不全即心肾综合征的问题,逐渐引起人们的注意[1]。广义的心肾综合征是指心脏和肾脏中的一个器官对另一个器官的共同损害。狭义的心肾综合征特指慢性心力衰竭引起进行性肾脏损害并导致肾功能不全,通常认为是慢性心力衰竭终末期的表现[2]。近年来,随着老龄化社会的逐步形成和人民生活水平的提高,慢性心血管病的发病率明显升高,内外科治疗的进展使许多病人在疾病的急性期得到了有效的治疗,病情发展到终末期的病人也明显增加,因而常存在肾功能不全,出现心肾综合征表现。心肾综合征的发病机制比较复杂,研究发现肾素血管紧张素系统(renin-angiotensin system,RAS)过度激活是一个重要的发病因素[3],RAS系统激活的产物血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)可以通过血流动力学效应和非血流动力学效应参与肾脏的损伤,其非血流动力学效应如促进氧化应激,导致细胞外基质沉积等作用主要是由脏器局部产生的Ang Ⅱ介导的[4]。体内外研究表明,奥美沙坦酯(olmesartan medoxomil, OLM)可以阻断任何来源的Ang Ⅱ所致的相应生理作用[5]。因而本研究应用冠状动脉左前降支结扎术建立CHF模型,并给予奥美沙坦酯干预,观察CHF小鼠肾脏RAS系统激活情况以及奥美沙坦酯对肾脏损伤的保护作用。
材 料 和 方 法
1主要试剂和仪器
奥美沙坦酯购于上海三共制药有限公司;Ang Ⅱ放免试剂盒购自北京北方生物技术研究所;RNA提取试剂盒;cDNA合成试剂盒购自大连宝日医生物技术有限公司;real-time PCR反应试剂盒购自Applied Biosystems;引物序列合成由上海生工生物工程技术服务有限公司完成;全自动生化分析仪由日立生产。
2动物模型的建立及分组
12周龄成年雄性C57小鼠36只,体重(25±3)g,由中国医科大学实验动物中心提供。动物随机分为3组:假手术组(sham组,n=11);慢性心力衰竭组(CHF组,n=14)和奥美沙坦酯治疗组(OLM+CHF组,n=11)。各组小鼠按50 mg/kg腹腔注射苯巴比妥钠麻醉,人工呼吸机辅助呼吸。迅速打开左前胸并暴露心脏。用7/0尼龙丝线在左心耳下方2 mm处结扎冠状动脉左前降支,显微镜下确认,将心脏复位后挤压出胸腔内气体并迅速缝合关闭胸腔。Sham组穿线而不结扎动脉,余步骤同CHF、OLM+CHF组。Sham组、CHF组每天给予正常饲料和饮水,OLM+CHF组术后给予正常饲料和饮水的同时开始给予奥美沙坦酯10 mg·kg-1·d-1灌胃。3组小鼠术后12周检测各项指标。
3心率、血压的测定和心脏超声检查
动物处死前1 d,使用智能无创血压计进行清醒状态下小鼠尾动脉间接测压,分别测定各组收缩压(systolic blood pressure, SBP) 和心率(heart rate, HR),每只动物连续测5次计算平均值。术前及术后12周应用美国惠普HP5500超声仪及15 MHz高频探头行经胸心脏超声检查。小鼠半量麻醉,保持自主呼吸,于胸骨旁乳头肌水平短轴切面采集左心室二维图像及主动脉血流情况。同时获得二维引导下10个心动周期的M型超声心动图记录。测量室间隔厚度(interventricular septal thickness,IVS)、左室舒张末期内径(left ventricular end-diastolic dimension,LVDd)、左室收缩末期内径(left ventricular end-systolic dimension,LVDs)、短轴缩短率(fractional shortening,FS)和射血分数(ejection fraction,EF)。
4血肌酐、血尿素氮、血浆和肾脏血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)水平测定
实验结束小鼠腹腔麻醉后心脏取血,一部分离心分离血清,酶法测定小鼠尿素氮(blood urea nitrogen,BUN)和血肌酐(serum creatinine,Scr)浓度。一部分制备血浆保存备用;另取50 mg肾脏标本,在冰浴中匀浆,匀浆液中加入酶抑制剂后离心取上清液,血浆和肾组织匀浆按照Ang Ⅱ放免试剂盒说明检测AngⅡ含量。
5Real-timePCR法检测肾素、AT1R和血管紧张素原表达
取各组肾脏组织,按照试剂盒要求提取总RNA,并将RNA反转录成cDNA, 设计相应的引物(引物序列见表1),应用SYBR green PCR master mix,在ABI Prism 7900T 序列检测系统检测分析,反应条件为20 μL反应体系,按94 ℃ 30 s,然后94 ℃ 5 s, 55 ℃ 5 s,72 ℃ 15 s 扩增40个循环,分析溶解曲线,计算各个样本的相对浓度。
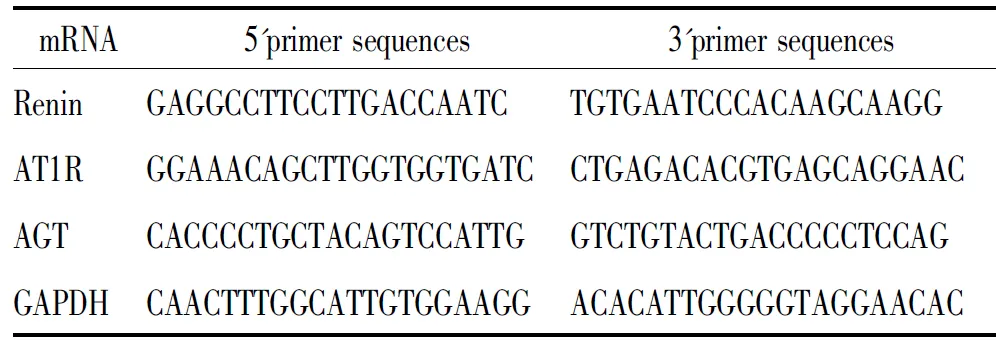
表1 肾素、AT1R、AGT和GAPDH PCR 引物序列
AT1R:angiotensin type 1 receptor; AGT:angiotensinogen.
6PAS染色检测肾组织病理学改变
实验完成后取肾组织,吸干表面水分并立即置于福尔马林溶液中固定,石蜡包埋,切成3 μm切片,PAS染色后光镜下观察肾小球、肾间质和肾血管的结构改变。
7统计学处理
结 果
1死亡率及心功能评价
Sham组术后12周均存活且一般情况佳;CHF组死亡3只,死亡率为21.4%(3/14),死因为严重的心力衰竭,其余小鼠均不同程度出现呼吸急促、喘鸣、进食和活动减少等情况;OLM+CHF组小鼠也有轻微的进食、活动减少等情况出现。CHF和OLM+CHF组小鼠解剖可见左室腔扩大,肝脏和肺脏淤血肿大,有胸腔积液和腹腔积液。与sham组比较,CHF和OLM+CHF组LVDd和LVDs显著增加(P<0.05),EF和FS显著降低(P<0.05)。与sham组相比,CHF组收缩压显著增高(P<0.05),OLM+CHF组较CHF组显著降低(P<0.05),见表2。

表2 各组小鼠心率、血压及心脏超声指标
#P<0.05vssham group;*P<0.05vsCHF group.
2血肌酐、血尿素氮、血浆和肾脏血管紧张素Ⅱ水平
与sham组相比,CHF组小鼠BUN和Scr明显升高,OLM+CHF组小鼠BUN和Scr水平较CHF组有显著改善(P<0.05)。与sham组相比,CHF组血浆和肾脏血管紧张素Ⅱ水平增高,OLM+CHF组较CHF组肾脏血管紧张素Ⅱ水平显著降低,血浆水平显著增高(P<0.05),见表3。
表3血清肌酐、尿素氮、血浆和肾脏血管紧张素Ⅱ水平测定


GroupBUN(mmol/L)Scr(μmol/L)PlasmaangiotensinⅡ(pmol/L)KidneyangiotensinⅡ(fmol/g)Sham6.6±0.946.3±7.861.3±22.128.4±13.9CHF24.9±5.4#92.0±12.7#93.2±18.2#169.3±19.8#OLM+CHF19.7±4.2*69.6±4.3*214.6±38.6*98.8±10.5*
#P<0.05vssham group;*P<0.05vsCHF group.
3PAS染色病理学观察结果
PAS染色见正常小鼠肾小球及肾小管结构清晰,肾小管上皮细胞排列整齐,基底膜完整,间质中未见炎症细胞浸润。CHF组可见肾小球系膜区扩张,肾小管管腔扩张,基底膜不规则增厚,肾小管间质PAS染色阳性物明显增多。OLM+CHF组小鼠肾脏病变均有不同程度改善,肾小球系膜区和肾小管间质PAS染色阳性物质明显减少,见图1。
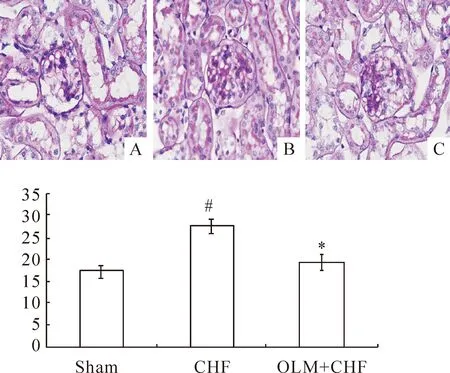
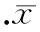
图1各组PAS染色结果
4肾素、AT1R和AGT表达结果
与sham组相比,CHF组肾素、AT1R和AGT表达增高(P<0.05),OLM+CHF组肾素、AT1R和AGT表达较CHF组均显著降低(P<0.05),见表4。
表4不同组别肾脏组织中renin、AT1R和AGTmRNA表达

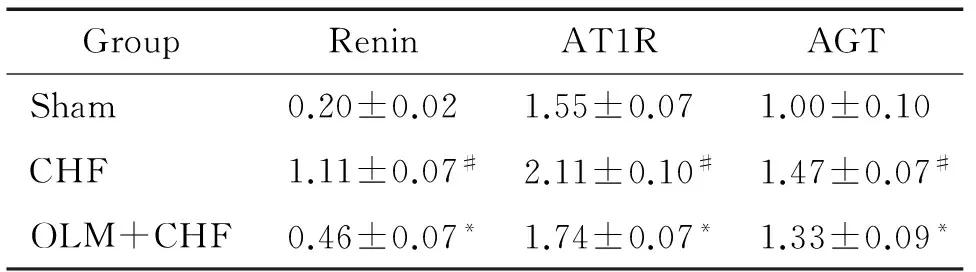
GroupReninAT1RAGTSham0.20±0.021.55±0.071.00±0.10CHF1.11±0.07#2.11±0.10#1.47±0.07#OLM+CHF0.46±0.07*1.74±0.07*1.33±0.09*
#P<0.05vssham group;*P<0.05vsCHF group.
讨 论
在心功能不全时,肾脏血流灌注减少和RAS活化等因素可导致肾功能的进行性下降[6]。传统认为肾素-血管紧张素系统在全身起着重要的作用,如调节醛固酮的释放,调节体液平衡等[7]。然而近年来发现组织局部RAS系统激活可介导AngⅡ有关细胞生长、心肌及血管增生肥厚、心室及血管重构、肾脏纤维化等长期效应[8]。研究发现,肾脏局部RAS过度激活与许多肾脏疾病包括肾病和肾动脉硬化等有关。 RAS过度激活的主要效应包括氧自由基的生成、 NF-κB的激活以及纤维母细胞增殖、炎症、细胞外基质过度沉积等[9]。RAS过度激活后产生的AngⅡ可作用于肾小球系膜细胞和足细胞,导致肾小球硬化和肾功能损害[10]。我们的研究结果表明,模型组LVDd和LVDs显著增加,FS和EF显著降低,表示心功能显著降低,而PAS 染色结果和血肌酐和血尿素氮含量增高说明模型组出现了肾小球硬化和肾功能不全表现,同时体内RAS系统激活,血浆和肾脏血管紧张素Ⅱ水平增高,肾脏肾素、AT1R和AGT表达增高,与以往研究结果相吻合。
AngⅡ受体有4种亚型,但其生理效应多由AT1R介导。研究显示AT1R 广泛分布于肾组织的各种细胞, AT1R在AngⅡ作用下可导致肾血管收缩,肾血流量下降及肾小球内压力增加;刺激系膜细胞外基质产生并抑制其降解;刺激纤溶酶原激活物抑制剂-1及其它一些生长因子的产生[11]。 而AT2R 主要分布于肾小球入球小动脉和系膜细胞等处,可使入球小动脉扩张,并可抑制系膜细胞生长并刺激其凋亡,同时AT2R在肾脏能刺激产生NO,所以这2种受体的生理作用几乎是相互拮抗的[12]。 我们研究应用的奥美沙坦酯是一种前体药物,经胃肠道吸收水解为奥美沙坦。奥美沙坦为选择性AT1R拮抗剂,通过选择性阻断血管紧张素Ⅱ与AT1R结合而阻断血管紧张素Ⅱ的作用。我们的结果显示治疗组肾功能损伤相对减轻,可见奥美沙坦酯通过与AT1R的结合抑制了肾内RAS系统的过度激活,从而阻断了血管紧张素Ⅱ对肾脏的损伤作用,我们还发现OLM组血浆血管紧张素Ⅱ显著增高,循环中增高的血管紧张素Ⅱ可能会与AT2R结合,从而发挥保护作用。
综上所述,慢性心力衰竭可使肾内肾素血管紧张素系统激活,并导致肾小球硬化和肾脏损伤,奥美沙坦酯通过抑制血管紧张素Ⅱ起到肾脏保护作用。
[1] Longhini C, Molino C, Fabbian F.Cardiorenal syndrome: still not a defined entity[J].Clin Exp Nephrol, 2010,14(1):12-21.
[2] Ronco C.Cardiorenal syndromes: definition and classification[J].Contrib Nephrol, 2010,164:33-38.
[3] Weir MR.Effects of renin-angiotensin system inhibition on end-organ protection: can we do better? [J] Clin Ther, 2007,29(9):1803-1824.
[4] Bader M, Ganten D.Update on tissue renin-angiotensin systems[J].J Mol Med, 2008,86(6):615-621.
[5] Koike H, Sada T, Mizuno M.Invitroandinvivopharmacology of olmesartan medoxomil, an angiotensin Ⅱ type AT1 receptor antagonist[J]. J Hypertens Suppl, 2001,19(1):S3-S14.
[6] 陈牧雷.慢性心功能不全与肾功能[J].中国医刊, 2008,43(6):64-66.
[7] 王立军,马 虹.血管紧张素转换酶2 研究进展[J].中国病理生理杂志, 2005,21(9):1858-1863.
[8] Raizada V, Skipper B, Luo W, et al. Intracardiac and intrarenal renin-angiotensin systems: mechanisms of cardiovascular and renal effects[J]. J Investig Med, 2007,55(7):341-359.
[9] 贺 明,陆利民,姚 泰.肾素-血管紧张素系统在调节肾脏活动和慢性肾功能不全中的作用[J].生理科学进展, 2004,35(2):188-192.
[10]周 毅,欧阳辉. 肾内血管紧张素系统在高血压性肾损害中的作用[J]. 中国病理生理杂志, 2001, 17(8): 752-754.
[11]Volpe M, Savoia C,De Paolis P,et al.The renin-angiotensin system as a risk factor and therapeutic target for cardiovascular and renal disease[J].J Am Soc Nephrol, 2002,13(Suppl 3): S173-S178.
[12]Berk BC.Angiotensin type 2 receptor (AT2R): a challenging twin[J].Sci STKE, 2003, 2003(181):PE16.
Protectiveeffectofolmesartanmedoxomilonrenalinjuryinmicewithchronicheartfailure
LU Xiao-mei, JIN Yu-nan, YU Yan-qiu, ZHANG Hai-peng
(DepartmentofPathophysiology,CollegeofBasicMedicalSciences,ChinaMedicalUniversity,Shenyang110001,China.E-mail:yqyu@mail.cmu.edu.cn)
AIM: To investigate the protective effect of olmesartan medoxomil on renal injury in mice with chronic heart failure (CHF).METHODSC57 mice were divided into sham operation group (sham group), chronic heart failure group (CHF group) and olmesartan medoxomil treatment group (OLM+CHF group). The experimental CHF model was established by ligation of left anterior descending branch of coronary artery. The mice in OLM+CHF group were fed with olmesartan medoxomil daily at the dose of 10 mg/kg. After 12 weeks, the heart rate, blood pressure, cardiac functions, serum creatinine and blood urea nitrogen levels, the angiotensin Ⅱ levels in plasma and renal tissues were measured. The expression levels of renal rennin, angiotensin type 1 receptor(AT1R) and angiotensinogen (AGT) were determined by real-time PCR. The pathological changes of the kidneys were observed under microscope with PAS staining.RESULTSCompared with sham group, left ventricular end-diastolic dimension(LVDd) and left ventricular end-systolic dimension(LVDs) were significantly increased (P<0.05), while fractional shortening(FS) and ejection fraction(EF) were significantly decreased in the mice of CHF and OLM+CHF groups (P<0.05). Compared with sham group, systolic blood pressure, the levels of serum creatinine and blood urea nitrogen, and the PAS staining positive area of the kidneys were significantly increased in CHF group (P<0.05), while in OLM+CHF group these changes were significantly lower than those in CHF group (P<0.05). Compared with sham group, the levels of angiotensin Ⅱ in plasma and kidney, the expression of renin, AT1R and AGT were increased in CHF group (P<0.05). In OLM+CHF group, the angiotensin Ⅱ level in the kidneys and the expression of renin, AT1R and AGT were significantly lower than those in CHF group (P<0.05).CONCLUSIONChronic heart failure activates the intrarenal renin-angiotensin system, leading to glomerular sclerosis and renal injury. Olmesartan medoxomil protects kidneys by inhibiting the effects of angiotensin Ⅱ.
Olmesartan medoxomil; Chronic heart failure; Renal injury
R363
A
10.3969/j.issn.1000-4718.2011.01.028
1000-4718(2011)01-0145-04
2010-05-19
2010-11-02
辽宁省教育厅高等学校科研资助项目(No. 20060946);辽宁省科技厅药物源头创新研究资助项目(No. 2006226031-211)
△通讯作者 Tel:024-23256666-5362; E-mail: yqyu@mail.cmu.edu.cn
