维甲酸对高氧暴露新生大鼠肺组织角化细胞生长因子及其受体表达的影响*
2011-10-24张亚维陈贻骥徐雅丽
张亚维, 陈贻骥, 徐雅丽
(重庆医科大学附属儿童医院新生儿疾病诊治中心,重庆 400014)
维甲酸对高氧暴露新生大鼠肺组织角化细胞生长因子及其受体表达的影响*
张亚维, 陈贻骥△, 徐雅丽
(重庆医科大学附属儿童医院新生儿疾病诊治中心,重庆 400014)
目的探讨高氧暴露新生大鼠肺组织结构的变化和角化细胞生长因子(KGF)及其受体(KGFR)的表达情况及维甲酸(RA)对其的影响。方法将出生24 h内SD大鼠90只随机分为3组,Ⅰ组:空气+生理盐水(NS);Ⅱ组:高氧+NS;Ⅲ组:高氧+RA。Ⅱ、Ⅲ组持续暴露于85% O2中,Ⅰ组置于空气中;Ⅲ组每天腹腔注射RA,Ⅰ、Ⅱ组每天腹腔注射NS。分别于生后3、7、14 d取肺标本,用HE染色法观察肺组织结构变化及辐射状肺泡计数(RAC);RT-PCR检测KGF和KGFR mRNA表达强度和免疫组织化学法检测KGF蛋白表达水平。结果(1)生后第14 d,Ⅱ、Ⅲ组较Ⅰ组RAC值显著减少(P<0.05),但Ⅲ组较Ⅱ组明显增高(P<0.05)。(2)与Ⅰ组相比,Ⅱ组3 d时,KGF mRNA表达明显增强(P<0.05);其后开始下降,7 d仍高于Ⅰ组(P<0.05);14 d时较Ⅰ组有所降低(P<0.05);Ⅲ组各时点表达量均高于同期Ⅱ组(P<0.05)。3 d时,各组KGFR mRNA表达量无明显差异;7 d、14 d时,Ⅱ、Ⅲ组表达量明显低于Ⅰ组(均P<0.05),且Ⅱ组和Ⅲ组之间无显著差异(P>0.05)。(3)KGF阳性细胞主要分布在部分肺泡壁及肺泡周围血管内皮细胞和间质细胞。KGF蛋白表达强度与其mRNA表达变化相似。结论RA可促进肺组织KGF表达,改善高氧所致肺发育受阻。对未成熟肺高氧损伤有一定的保护作用。
高氧; 维甲酸; 肺损伤; 角蛋白细胞生长因子; 大鼠
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是新生儿,特别是早产儿高氧、机械通气治疗最常见的并发症,严重影响存活儿的生长发育和生存质量。肺损伤后修复过程受肺泡Ⅱ型上皮细胞(alveolar epithelial type 2 cell,AEC Ⅱ)增殖及转化成AEC Ⅰ的能力的控制[1]。研究发现,在此修复和重建过程中,角化细胞生长因子(keratinocyte growth factor,KGF)-角化细胞生长因子受体(keratinocyte growth factor receptor,KGFR)信号通路和维甲酸(retinoic acid,RA)都发挥着重要作用。有体外实验证实,RA的调节作用可能与KGF-KGFR信号通路有关,但活体动物模型研究较少。因此,本研究采用新生大鼠为对象,建立85%O2长期暴露肺损伤模型,探讨RA对KGF、KGFR表达的影响,旨在进一步探讨高氧肺损伤的发病机制及其可能的防治途径。
材 料 和 方 法
1主要试剂
维甲酸购自山东良福制药有限公司;CYS. 1型便携式数字测氧仪购自上海嘉定电子仪器厂;Trizol RNA 提取试剂盒购自北京百泰克生物技术有限公司;RT试剂盒购自大连宝生物工程有限公司;Mix购自北京康为世纪生物技术有限公司;KGF、KGFR、β-actin引物由北京三博远志生物技术有限公司合成;兔抗大鼠KGF多克隆抗体购自北京博奥森生物技术有限公司,工作浓度1∶200;免疫组化抗兔SP试剂盒和DAB试剂盒均购自北京康为世纪生物技术有限公司。
2动物和分组
2.1动物 生长条件相同的足月新生SD大鼠90只,体重为6 g左右,不限性别。由重庆医科大学动物中心提供。于生后24 h内将实验动物随机分为3组:Ⅰ组:空气+生理盐水(normal saline,NS);Ⅱ组:高氧+NS;Ⅲ组:高氧+RA,各组再分为3 d、7 d、14 d等亚组,每组10只。
2.2动物模型制备 参照相关文献[2]自制氧箱(55 cm×35 cm×30 cm),Ⅱ组和Ⅲ组置于氧箱内,使氧浓度维持在850 mL/L,以测氧仪控制氧体积分数,用钙石灰以吸附CO2,温度25-26 ℃,湿度60%-70%,每天开箱1 h,清洁氧箱,更换敷料,添加饲料及饮水,称重,与对照组互换母鼠以避免母鼠因氧中毒而护理能力降低;Ⅰ组置于同一室内空气中(氧浓度21%)。Ⅲ组从第1 d起每天腹腔注射RA 500 μg/kg,连续14 d;Ⅰ、Ⅱ组注射等体积NS。
2.3标本收集 生后3 d、7 d及14 d分别从各组中随机抽取8只,腹腔注射100 g/L水合氯醛(3 mL/kg)麻醉。于心脏搏动最强处穿刺,用NS充分灌注直至肺成白色。迅速切取右肺,用生理盐水洗净残血,吸干水分,放于冻存管中液氮速冻后存于-80℃冰箱,以备RT-PCR之用。取左肺,用4%多聚甲醛固定24 h,石蜡包埋, 5 μm切片,苏木精-伊红染色(HE染色),光镜下检查肺组织病理变化,同时行免疫组化检测肺组织KGF表达。
3方法
3.1辐射状肺泡计数(radial alveolar counts,RAC) RAC是指从终末细支气管中心至最近纤维隔引垂直线,该直线上的肺泡数。选取各组生后第14 d大鼠肺组织石蜡切片行HE染色,光镜下观察组织病理改变,并在100倍光镜下以双盲的方式行RAC,每张切片计数5次,取平均值。
3.2RT-PCR检测KGF、KGFR mRNA水平 KGF上游引物 5′-GAG CGA CAC ACG AGA AGT TAT GAC-3′,下游引物 5′-CAT TTA GCT GAT GCA GAG GTG TTG-3′,产物长度320 bp。KGFR上游引物 5′-GCA TGG TTG ACA GTT CTG CCA G-3′,下游引物 5′-GCT TCA GCC ATG ACT ACT TG C-3′,产物长度437 bp。 β-actin上游引物 5′-CAC CCG CGA GTA CAA CCT TC-3′,下游引物 5′-CCC ATA CCC ACC ATC ACA CC-3′,产物长度206 bp。PCR反应条件:94 ℃预变性2 min,94 ℃ 30 s,57 ℃ 30 s,72 ℃ 1 min,共30个循环,72 ℃延伸5 min。产物经1.5%琼脂糖凝胶电泳分离,紫外灯下观察并拍照,每组实验至少重复3次,条带采用Syngen公司的Gene Tools图像分析软件进行分析,比较KGF和KGFR与β-actin扩增条带灰度比(AKGF/Aβ-actin、AKGFR/Aβ-actin)。
3.3免疫组化检测肺组织KGF表达 石蜡包埋后的组织标本连续切片5 μm,常规脱蜡脱水;置10 mmoL/L柠檬酸缓冲液(pH 6.0)中加热修复抗原,冷却至室温,PBS冲洗5 min,3次;3%H2O2室温孵育10 min,PBS冲洗5 min,3次;滴加正常山羊血清封闭非特异性抗原,37 ℃、30 min,倾去;滴加1∶200稀释的兔抗大鼠KGF多克隆抗体,4 ℃过夜,PBS冲洗5 min,3次;滴加生物素标记山羊抗兔IgG抗体,37 ℃、30 min,PBS冲洗5 min,3次。滴加辣根过氧化物酶标记的链酶卵白素工作液,37 ℃、30 min,PBS冲洗5 min,3次;DAB显色1 min,苏木素复染后中性树脂封片。用PBS代替Ⅰ抗作阴性对照,KGF以细胞质出现棕黄色为阳性表达,每张切片在高倍镜下随机选取5个视野,采用Image Pro Plus 5.1图像分析系统计算平均累积吸光度值(IA),取平均值,检测KGF的表达情况。
4统计学处理

结 果
1肺组织病理学改变
Ⅰ组在生后3、7和14 d肺部组织未见明显病理变化。Ⅱ、Ⅲ组3d时肺间质增厚,可见有小血管充血扩张,炎症细胞浸润;7 d时,肺泡上皮细胞增生、肿胀,间质内细胞增多;14 d时肺泡增大,间质增厚更加明显,肺组织结构显示肺泡结构简单化和囊泡化,肺泡形成明显滞后。而Ⅲ组与Ⅱ组相比,病理改变明显减轻,肺泡毛细血管丰富,肺泡直径较小,数量增加,间隔增厚不明显,见图1。
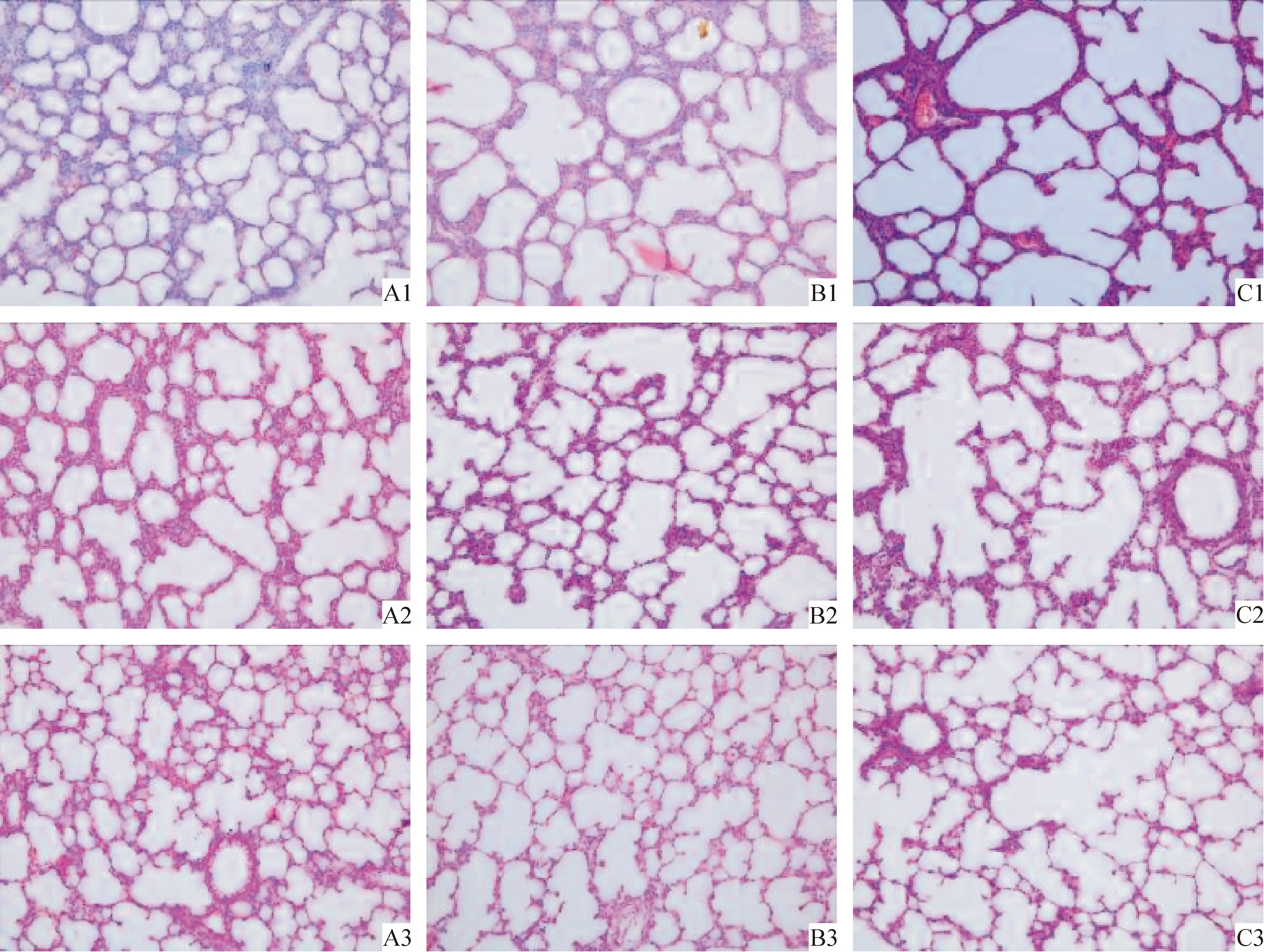
Figure 1. Lung histological changes in different groups. A:3 d; B::7 d; C:14 d. 1:group Ⅰ;2:group Ⅲ;3:group Ⅱ(HE,×200).
图1各组肺组织病理变化
2肺RAC结果
RAC值反映终末呼吸单位含肺泡数的多少,可用以评价肺泡化水平。生后第14 d,Ⅰ-Ⅲ组RAC值分别为(10.68±0.10)个、(6.61±0.18)个、(8.58±0.23)个。Ⅱ、Ⅲ组较Ⅰ组RAC值显著减少(P<0.05),但Ⅲ组较Ⅱ组明显增高(P<0.05)。
3KGF、KGFRmRNA表达强度
3.1高氧、RA对新生大鼠KGF mRNA表达的影响 与Ⅰ组相比,Ⅱ组3 d时,KGF mRNA表达明显增强(P<0.05);其后开始下降,7 d仍较Ⅰ组增加(P<0.05);14 d时有所降低(P<0.05);Ⅲ组各时点表达量均高于同期Ⅱ组,其差异显著(P<0.05),见表1、图2。
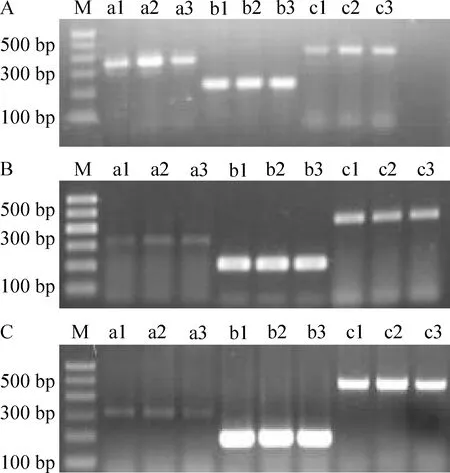
Figure 2. Electropherogram of RT-PCR products on the 3rd(A),7th(B) and 14th(C) days in different groups. M: marker; a: KGF; b: β-actin; c: KGFR; 1:group Ⅰ;2:group Ⅲ;3:group Ⅱ.
图2各组3、7和14dKGF、KGFR的RT-PCR电泳图
表1各组不同时点肺组织KGFmRNA表达水平变化

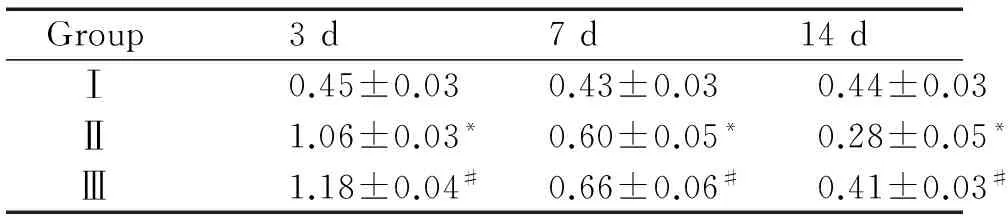
Group3d7d14dⅠ0.45±0.030.43±0.030.44±0.03Ⅱ1.06±0.03*0.60±0.05*0.28±0.05*Ⅲ1.18±0.04#0.66±0.06#0.41±0.03#
*P<0.05vsthe corresponding group Ⅰ;#P<0.05vsthe corresponding group Ⅱ. Group Ⅰ:air+normal saline(NS); group Ⅱ:85% O2+NS; group Ⅲ:85%O2+retinoic acid.
3.2高氧、RA对新生大鼠KGFR mRNA表达的影响 3 d时,各组KGFR mRNA表达量无明显差异;7 d、14 d时,Ⅱ、Ⅲ组表达量明显低于Ⅰ组(均P<0.05),且 Ⅱ 组和 Ⅱ 组之间无显著差异(P>0.05),见表2、图2。
4肺组织KGF蛋白表达的变化
KGF阳性细胞显色部位在胞浆,呈棕黄色。阳性细胞主要分布在部分肺泡壁及肺泡周围血管内皮细胞和间质细胞。与Ⅰ组相比,Ⅱ组3 d时,KGF蛋白表达明显增强(P<0.05);其后开始下降,7 d仍较Ⅰ组增加(P<0.05);14 d时较Ⅰ组有所降低(P<0.05);Ⅲ组各时点表达量均高于同期Ⅱ组,其差异显著(P<0.05),见表3、图3。
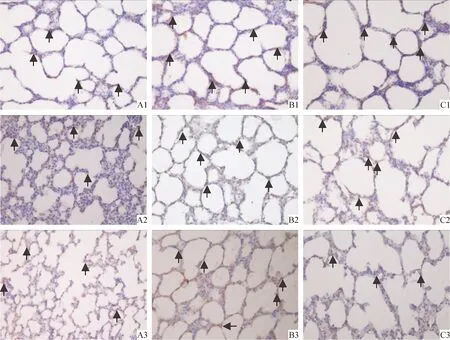
Figure 3. Lung KGF immunohistochemical results in different groups. A:3 d; B:7 d; C:14 d. 1:group Ⅰ;2:group Ⅲ;3:group Ⅱ(SP,×400).
图3各组肺组织KGF表达
表2各组不同时点肺组织KGFRmRNA表达水平变化

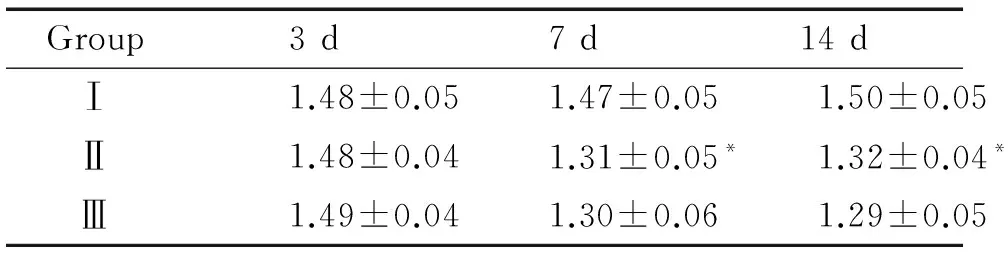
Group3d7d14dⅠ1.48±0.051.47±0.051.50±0.05Ⅱ1.48±0.041.31±0.05*1.32±0.04*Ⅲ1.49±0.041.30±0.061.29±0.05
*P<0.05vsthe corresponding group Ⅰ.
表3各组不同时点肺组织KGF蛋白表达水平变化
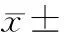
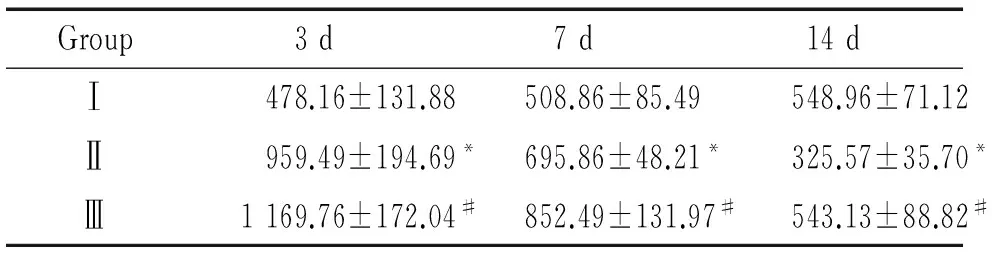
Group3d7d14dⅠ478.16±131.88508.86±85.49548.96±71.12Ⅱ959.49±194.69*695.86±48.21*325.57±35.70*Ⅲ1169.76±172.04#852.49±131.97#543.13±88.82#
*P<0.05vsthe corresponding Ⅰ group;#P<0.05vsthe corresponding Ⅱ group.
讨 论
随着新生儿抢救技术的发展和肺表面活性物质的普及应用,新生儿呼吸窘迫综合征的病死率明显下降,但是BPD的发病率却逐年增加。BPD病因和发病机制十分复杂,为多因素所致[3]。近年认为,高氧导致肺发育受阻可能是主要原因[3]。正常肺功能的维持有赖于完整的肺泡上皮屏障,肺泡上皮主要由AEC Ⅰ和AEC Ⅱ组成。正常情况下,只有极少量的AEC Ⅱ增殖分化为AEC Ⅰ。高氧肺损伤时,由于大量AEC Ⅰ被破坏,需要相对能耐受高氧的AEC Ⅱ增殖分化为AEC Ⅰ以修复受损的肺泡结构,因此AEC Ⅱ的增殖、移行以及向AEC Ⅰ的分化在高氧肺损伤修复过程中发挥关键性作用[4]。
1RA对高氧肺损伤的影响
RA是维生素A的活性代谢产物,在体内可改变多种物质的生物学活性,在肺发育、成熟与损失后修复发挥重要作用[5,6],如:RA缺乏可引起肺成熟受阻导致BPD[7],而补充外源性RA可促进肺泡隔的生成,促进肺成熟;啮齿类自发性分隔期间,给RA后可诱导隔的形成;用地塞米松后抑制肺泡化进程,同时应用RA可预防这种抑制作用;补充RA可降低BPD的发病率、减轻严重性。本实验结果显示,高氧组较空气组RAC值明显减少,提示高氧暴露明显抑制肺泡形成,阻碍了肺发育;而RA组RAC值较高氧组明显增加,提示维甲酸治疗可增加肺泡数目,部分逆转这种由高氧引发的肺发育受阻。
2RA对KGF、KGFR表达的影响及其抗损伤作用机制
据文献报道,KGF是成纤维细胞生长因子家族成员之一,KGF mRNA由间质细胞产生并翻译成蛋白,而KGF则是通过旁分泌作用于表达有其受体的上皮细胞,主要调控上皮细胞生长分化与增殖[8]。KGF在免疫组化中出现的这种与其mRNA表达部位不一致现象可能是由于其被分泌后即与上皮表面表达的受体通过包含有蛋白聚糖的硫酸乙酰肝素结合形成的[9],这与本实验免疫组化所观察到的结果一致。KGF在炎症反应和损伤修复中起重要作用,高氧及其它多种肺损伤模型研究表明,KGF通过直接的上皮细胞、内皮细胞保护和T-细胞介导损伤保护等多种保护作用,减轻或避免肺组织损伤,提高存活率[10,11]。
近年来,KGF对高氧肺损伤的保护作用受到较广泛关注。Barazzone等[12]在研究KGF对高氧诱导的急性肺损伤的保护作用时,发现KGF可阻止高氧诱导p53、bax和bcl-x基因mRNA表达,也能抑制血纤维蛋白溶解酶原激活剂的抑制剂-1(PAI-1)mRNA和相关蛋白质表达,从而抑制高氧肺损伤大鼠肺泡纤维化活性。研究表明,KGF能明显抑制高氧诱导的AEC Ⅱ凋亡,促进AEC Ⅱ增殖、迁移和分化,从而提高实验动物和细胞对高氧的耐受性[10,13]。RA逆转肺发育阻滞及抑制肺损伤的具体机制不清。有研究发现RA主要参与对AECⅡ的增殖及转化的调控。有文献报道,在RA缺乏的血浆中培养的成纤维细胞中,KGF表达降低。而添加RA后,KGF表达水平随之升高[14]。从RA和KGF相似的促进AECⅡ增殖和分化作用,作者推测RA可能通过调控KGF及其受体表达而发挥高氧肺损伤的保护作用。
本研究结果显示,与Ⅰ组相比,Ⅱ组3 d时,肺组织KGF表达量明显增加;其后开始下降,7 d仍高于Ⅰ组;14 d时较Ⅰ组降低,提示机体存在一定的自我保护性机制以拮抗高氧所产生的损害,但是这种内源性KGF作用是有限的。Ⅲ组各时点表达量均高于同期Ⅱ组,提示高氧肺损伤过程中给予RA治疗增加肺组织KGF表达,这可能是RA发挥保护性作用的重要机制之一。本研究还发现,RA对肺组织KGFR表达无影响。
综上所述,RA能够减轻高氧肺损伤病理改变,缓解肺泡发育阻滞,上调高氧暴露肺组织KGF表达,对高氧肺损伤有一定保护和预防作用。高氧肺损伤发生机制复杂,RA对高氧下KGF进行调控的机制有待进一步探讨。进一步的研究将对临床治疗高氧肺损伤和BPD提供实验依据和更广阔的思路。
[1] Besnard V, Nabeyrat E,Henrion-Caude A, et al.Protective role retinoic acid from antiproliferative action of TNF-α on lung epithelial cells[J].Am J Physiol Lung Cell Mol Physiol,2002, 282(4): L863-L871.
[2] 刘国胜,刘海英,邱瑞琴,等. 表皮生长因子对新生大鼠高氧损伤肺组织EGFE及EGF mRNA 表达的影响[J]. 中国病理生理杂志, 2007, 23(7): 1306-1310.
[3] Bancalari E. Bronchopulmonary dysplasia:old problem, new presentation[J]. J Pediatr(RioJ), 2006, 82(1): 2-3.
[4] Charafeddine L, D’Angio CT, Richards JL, et al. Hyperoxia increases keratinocyte growth factor mRNA expression in neonatal rabbit lung[J].Am J Physiol, 1999, 276(1): L105-L113.
[5] Veness-Meehan KA, Bottone FG, Stiles AD. Effects of retinoic acid on airspace development and lung collagen in hyperoxia-exposed newborn rats[J]. Pediatr Res, 2000, 48(4): 434-444.
[6] Nabeytat E, Corroyer S, Epaud R, et al. Retinoic acid-induced proliferation of lung alveolar epithelial cells is linked to p21CIP1 downregulation[J]. Am J Physiol Lung Cell Mol Physiol, 2000, 278(1): L42-L50.
[7] CardoSo WV, Mitsialis SA, Brody JS, et al.Retinoic acid alters the expression of pattern- related genes in the developing rat lung[J]. Dev Dyn, 1996, 207(1): 47-59.
[8] Lebeche D, Malpel S, Cardoso WV, et al. Fibroblast growth factor interaction in the developing lung[J]. Mech Dev, 1999, 86(1-2): 125-136.
[9] Post M, Souza P, Liu J, et al. Keratinocyte growth factor and its receptor are involved in regulating early lung branching[J]. Development, 1996, 122(10): 3107-3115.
[10]Ware LB, Matthay MA.Keratinocyte and hepatocyte growth factors in the lung:roles in lung development, inflammation, and repair[J]. Am J Physiol Lung Cel1 Mol Physiol, 2002, 282(5): L924-L940.
[11]Padela S, Yi M, Cabacungan J, et al. A critical role for fibroblast growth factor-7 during early alveolar formation in the neonatal rat[J]. Pediatr Res, 2008, 63(3): 232-238.
[12]Barazzone C, Donati YR, Rochat AF, et al. Keratinocyte growth factor protects alveolar epithelium and endothelium from oxygen-induced injury in mice[J]. Am J Pathol,1999, 154(5): 1479-1487.
[13]Lu YB, Pan ZZ, Devaux Y, et al.P21-activated protein kinase 4(PAK4) interacts with the keratinocyte growth factor receptor and participates in keratinocyte growth factor-mediated inhibition of oxidant-induced cell death[J]. J Biol Chem, 2003, 278(12): 10374-10380.
[14]Mackenzie LC, Gao ZR. Keratinocyte growth factor expression in human gingival fibroblasts and stimulation ofinvitrogene expression by retinoic acid[J]. J Periodontol, 2001, 72(4): 445-453.
Effectofretinoicacidonexpressionofkeratinocytegrowthfactorandkeratinocytegrowthfactorreceptorininjuredlungtissuesofneonatalratsexposedtohyperoxia
ZHANG Ya-wei, CHEN Yi-ji, XU Ya-li
(NeonatalDiagnosisandTreatmentCentre,Children’sHospitalofChongqingMedicalUniversity,Chongqing400014,China.E-mail:chenyiji55@yahoo.com.cn)
AIM: To observe the influence of retinoic acid (RA) on the lung damage, and the expression of keratinocyte growth factor (KGF) and keratinocyte growth factor receptor (KGFR) in neonatal rats exposed to hyperoxia.METHODSNinety full-term neonatal Sprague Dawley (SD) rats were randomly divided into 3 groups within 24 h after birth. Group Ⅰ: air+ normal saline (NS) group; group Ⅱ: hyperoxia (85%O2)+NS group; group Ⅲ: hyperoxia (85%O2)+ RA group. RA was injected to the animals in group Ⅲ intraperitoneally (500 μg/kg) everyday after birth, while NS was given with group Ⅰ and Ⅱ daily at the same time as group Ⅲ. On day 3, 7 and 14 after birth, 8 rats in each group were killed. Lung radial alveolar counts (RAC) were examined. The mRNA levels of KGF and KGFR were detected by reverse transcription polymerase chain reaction (RT-PCR). The protein expression of KGF in the lung tissues was measured by immunohistochemical method.RESULTS(1) Compared with group Ⅰ, RACs in group Ⅱ and Ⅲ were significantly decreased (P<0.05) after 14 days, but those in group Ⅲ were significantly higher than those in group Ⅱ (P<0.05). (2) The mRNA expression of KGF was significantly increased after 3 days of hyperoxia as compared to the air-breathing control rats (P<0.05) and then descend after that. The expression was still higher on day 7 (P<0.05) than that in group Ⅰ and decreased significantly after 14 days of hyperoxia exposure (P<0.05). On the 3rd, 7th and 14th day, the mRNA expression of KGF in groupⅢ all obviously increased as compared to that at the corresponding time points in groupⅡ (P<0.05). No significantly difference of the mRNA expression of KGFR among the 3 groups on the 3rd day (P>0.05) was observed. Compared with group Ⅰ, the mRNA level of KGFR decreased significantly after hyperoxia on the 7th and 14th day (P<0.05). RA had no effect on the mRNA expression of KGFR. (3) The expression of KGF protein detected by immunohistochemistry was seen primarily in some alveolus, microvascular endothelia cells and interstitial cells. The protein levels of KGF were similar to those of KGF mRNA expression in all 3 groups.CONCLUSIONRA may facilitate the expression of KGF in the lung, ameliorate the impaired lung development resulting from hyperoxia, and play a protective role in lung development against hyperoxia-induced inhibition.
Hyperoxia; Retinoic acid; Lung injury; Keratinocyte growth factor; Rats
R722
A
10.3969/j.issn.1000-4718.2011.01.005
1000-4718(2011)01-0027-06
2010-08-02
2010-10-18
重庆市卫生局科研资助项目(No.渝卫科教[2005]31-05-2-81)
△通讯作者 Tel: 023-63632135; E-mail: chenyiji55@yahoo.com.cn
