赤潮毒素大田软海绵酸表面等离子共振免疫检测方法研究*
2011-10-21周向东陈惠滨詹舒越王晓萍欧惠超罗昭锋
周向东,陈惠滨,詹舒越,王晓萍* ,欧惠超,罗昭锋
(1.浙江大学现代光学仪器国家重点实验室,杭州 310027;2.集美大学信息工程学院,福建 厦门 361021;3.中国科技大学合肥微尺度国家实验室,合肥 230027)
由于环境污染导致的海水富营养化以及赤潮,会破坏海洋的正常生态结构。赤潮导致海洋生物死亡产生毒素,并污染海洋中养殖的虾、贝类等,通过食物链的传递,造成人类食物中毒[1]。
目前海洋赤潮毒素的检测方法主要有生物分析法、化学仪器分析法和免疫检测法。以小鼠实验为典型的生物分析法[2],虽然简单易行,但因生物个体差异,导致测量结果偏差大,且灵敏度非常低,特异性差。高效液相色谱法[3-4]可以准确分离各种组分,实现海洋藻毒素定性和定量分析,但是大多数毒素如PSP(Paralytic Shellfish Poisoning,)、DSP(Diarrhetic Shellfish Poisoning,腹泻性贝类毒素)等必须经荧光衍生后才能检测,衍生后的荧光产物均很不稳定,容易造成测量偏差。因此国内外逐步将色谱质谱联用技术[5]应用于多种海洋生物毒素的分析,但色谱分析法因为仪器昂贵,需要专业操作人员等原因限制了方法的普及和应用。利用多克隆或单克隆抗体检测的酶联免疫分析法[6-8]具有高特异性和选择性,分析过程无需繁琐的样品前处理步骤,具有商品化的试剂盒为该方法的进一步广泛应用提供了可能性。但其检测过程需要酶标记抗体及依赖于酶催化反应的比色检测,导致成本增加,耗时长达数小时,且检测过程仍需依赖实验室环境,难以适应现场分析检测的实时性要求。
本文以在我国渤海、长江口、福建沿海、珠江口、香港和台湾等海域广泛分布[9]的腹泻性贝类毒素中的大田软海绵酸(Okadaic Acid,OA)为分析检测对象,将免疫分析方法与表面等离子共振检测技术相结合,建立一种免标记、响应速度快、灵敏度高、低成本的可以应用于海洋赤潮毒素分析的快速SPR免疫检测分析方法。提出并设计了一种小型化、可适用于现场应用的SPR免疫检测分析系统,制备了可识别OA的特异性免疫传感芯片,通过实验分析并评价了该检测系统的性能指标。
1 检测原理与实验装置
表面等离子共振是光在玻璃与金属薄膜界面发生全反射时产生的倏逝波引发金属表面的自由电子产生表面等离子(Surface Plasmon,SP),并在表面等离子与倏逝波频率和波数相同的情况下产生的一种共振现象,由此导致反射光的能量急剧下降,反射光谱上出现共振峰。当传感芯片表面固定一层生物分子识别膜,将待测样品流过芯片表面,若样品中有能够与芯片表面的生物分子相互作用的分子,会引起金膜表面折射率变化,最终导致SPR共振峰变化,从而可获得被分析物的浓度、亲和力、动力学常数和特异性等信息[10]。
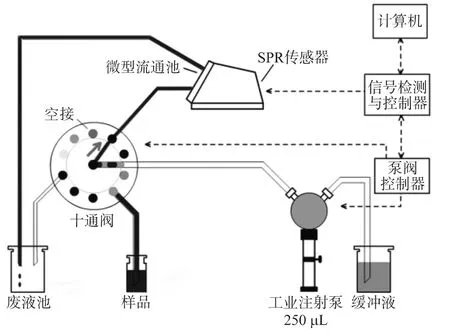
自行研制开发的表面等离子共振免疫检测分析系统结构如图1所示。传感器选用Kretschmann结构的TSPR1A170100 SpreetaTM传感器,其折射率分辨率为5×10-6RIU,具有体积小、功耗低、性价比高等特点;十通阀(美国Valco Inc.)用于切换选择缓冲液、待检样品和再生液等;工业注射泵(Sapphire EngineeringTMInc.)依据程序将各种溶液注射流经表面功能化的SPR传感器表面,传感器输出的SPR光谱经信号检测与控制电路采集后,传送到计算机进行分析处理。在软件的控制下,系统可实现自动进样、测量、再生、清洗等功能。
2 材料与方法
2.1 材料
NHS(N-hydroxysuccinimide,N-羟基琥珀酰亚胺);EDC(1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride,水溶性碳化二亚胺);TeCP(tetrachlophenoxide,四氯苯酚);盐酸乙醇胺(1 mol/L ethanolamine hydrochloride,pH=8.5,Alfa Aesar Inc.):纯度>98%;SDS(sodium dodecyl sulfate,十二烷基硫酸钠)溶液:质量分数为10%;OA-mAb(OA单克隆抗体,清华大学生命科学学院);OA标准品(Sigma Inc.):纯度>95%;OA-BSA(OA牛血清蛋白偶联物溶液,Sigma Inc.);PBS(phosphate buffered saline,磷酸盐缓冲液):将8.0 g NaCl、2.9 g Na2HPO4、0.2 g KH2PO4、0.2 g KCl溶于800 mL蒸馏水中,调整溶液pH值至7.4,补充液体使溶液体积为1 L,分装、高压蒸汽灭菌后室温保存;再生液:100 mmol/L的NaOH溶液与质量分数为0.05%的SDS溶液混合。
2.2 测试方法及生物芯片制备
由于OA是小分子,为提高检测灵敏度通常采用间接检测法即抑制法进行测量。其过程为:将OA抗原偶联在SPR传感器芯片(金膜)表面;将适量的OA-mAb与含有OA分子的被测溶液混合,抗原抗体结合达到平衡态,此时混合液有一定量多余的OA-mAb;将该混合液作为SPR仪器的被测样品注入并流经传感器金膜表面,此时混合液中多余的OA-mAb与修饰在传感器金膜表面的OA抗原结合,SPR输出信号发生变化,根据SPR输出信号的大小,可以得到混合液中多余OA-mAb的量,从而可以计算出被测溶液中的OA分子浓度。
为使SPR传感器对特定待测分子具有特异性,需要对传感器芯片(金膜)表面进行修饰。对于OA传感芯片的制备,是利用OA-BSA偶联物的巯基与传感器金膜表面共价偶联,形成一层自组装的单分子检测层。具体的步骤如下:
①用H2SO4∶H2O2(98%浓硫酸∶30%双氧水=7∶3)清洗传感器金膜表面12 h。
②取OA-BSA溶液20 μL滴于芯片表面反应8 h,使OA-BSA通过巯基固定于芯片表面。
③回收芯片表面的OA-BSA溶液,冲洗芯片表面,氮气吹干,2 mg/mL BSA+1%TeCP 溶液 20 μL滴于芯片表面,反应5 h。在TeCP作用下,BSA的蛋白二硫键被打开,封闭未吸附OA-BSA的金膜表面,以减少结合过程的非特异性吸附。
④冲洗芯片表面,氮气吹干。NHS/EDC混合溶液20 μL滴于芯片表面反应5 h,交联活化芯片,使得芯片表面的独立蛋白BSA之间的羧基与氨基交联在一起,提高结合的稳定性。
⑤冲洗芯片表面,氮气吹干。盐酸乙醇胺20 μL滴于芯片表面反应12 h,封闭芯片表面多余的羧基,减少羧基对抗体蛋白的非特异性吸附。
2.3 测试过程
2.3.1 测试条件优化
分别以100 mmol/L NaOH与100 mmol/L NaOH+0.05%SDS混合溶液为再生液,以稀释200倍的OA-mAb溶液作为检测样品,25 μL/min速度进样,进样量50 μL,考察芯片再生后,基线的恢复能力。
将OA 单克隆抗体用 PBS 按 1 ∶100、1 ∶200、1∶300比例稀释后,分别作为检测样品,以25 μL/min速度进样,进样量50 μL,测试三种不同稀释比抗体溶液的SPR响应值,选择合理的稀释倍数。
2.3.2 检测方法性能测试
以 1 ∶200 OA-mAb 溶液为测试样品,25 μL/min速度进样,每次进样50 μL并再生,连续进样12次,测试芯片稳定性。
用PBS缓冲液、OA标准品和1∶200 OA-mAb溶液,配制出 OA 含量分别为 2.5、5、10、20、40、80、160、320、640、1280 ng/mL OA 的混合溶液,由高浓度到低浓度依次检测,每个浓度重复3次,获取OA标准曲线。
3 结果与讨论
3.1 测试条件选定
抗体稀释200倍,两种不同再生液条件下的SPR谱图如图 2、图 3所示,分别以 100 mmol/L NaOH、100 mmol/L NaOH+0.05%SDS 混合溶液为再生液,SPR结合前与恢复后的基线并不对齐,存在大约48RU、77RU的结合量差值,表明所选择的再生液并不能使传感器表面的抗原和抗体结合物完全分离。而由100 mmol/L NaOH+0.05%SDS混合溶液、100 mmol/L NaOH两种再生溶液先后再生两次可以使基线回复到起始水平,如图1所示,因此设定再生条件先由100 mmol/L NaOH+0.05%SDS混合溶液再生,后由100 mmol/L NaOH再次再生一次。

图2 抗体稀释200倍,再生液为NaOH的SPR谱图
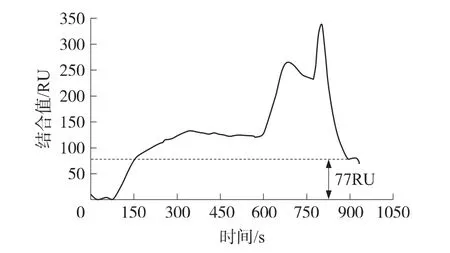
图3 抗体稀释200倍,再生液为NaOH+SDS的SPR谱图
OA-mAb稀释100、200、300倍的SPR谱图如图4所示,由图可见,在相同的进样速度和进样量条件下,抗体稀释100倍的溶液结合量最大,达135RU;而抗体稀释300倍的溶液结合量最小,仅为80RU。虽然抗体稀释100倍溶液结合值较大,但抑制浓度随之增大,最终导致检测限变大,且抗体消耗量也大,会增加分析成本;而抗体稀释300倍的溶液结合值低,竞争抑制曲线动态响应范围小,会导致定量浓度范围变窄。因此选择抗体稀释200倍较为恰当,其响应值为123RU,能在检测限、样品消耗量及信号动态响应范围之间取得一个合理的平衡。
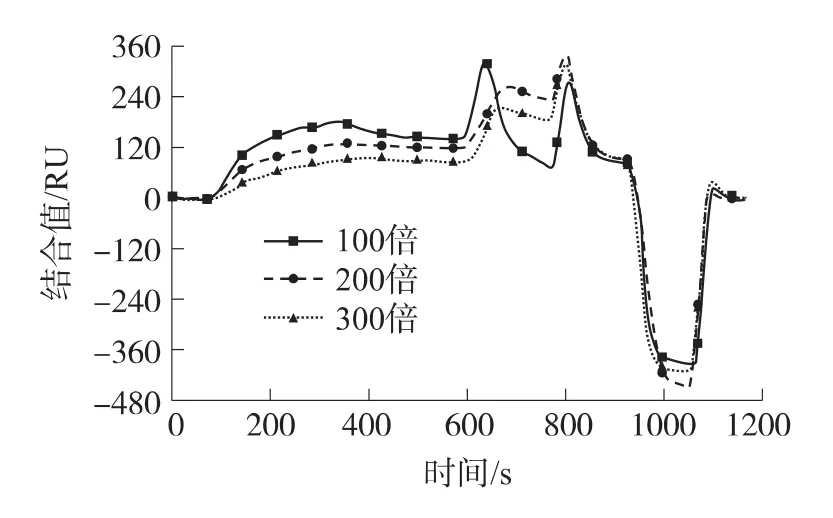
图4 单次完整的测量过程,
3.2 稳定性
分析重复性实验的12次测量结果,求得12次响应信号的均值约为123.6RU,标准偏差为2.34RU,RSD值为1.51%,响应信号的最大偏差在8RU之内。结果表明传感器芯片表面偶联的抗原结合牢固,抗体稀释倍数和再生条件选择合理。在该条件下,测试方法具有良好的重复性。
3.3 抑制标准曲线
分析不同浓度OA溶液的SPR测量结果,以SPR传感器的响应结合值为纵坐标,OA浓度值的对数为横坐标,得到OA标准曲线如图5所示。结合值最低和最高浓度端分别由于饱和结合及抑制溶液中抗体浓度低而趋向于平稳,中间部分呈线性递减的过程,很好的符合抑制模式的抗原抗体生物测量过程。用Sigmoidal非线性关系拟合,得方程Y=A2+(A1-A2)/(1+(x/x0)p),A1=113.0,A2=33.3,x0=182.7,p=2.4,拟合曲线的相关系数R2=0.993。
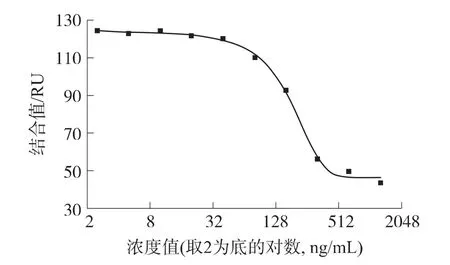
图5 OA的标准曲线
FDA的《标准分析方法与步骤依据指南》[11]中定义的检测限为DL=3.3σ/S,其中σ为重复性测量的标准偏差,S为标准曲线的斜率。由标准曲线测量点可得S=0.398RU·mL/ng,σ=2.34RU,进而可以计算出该方法的检测限为19.4 ng/mL,半抑制浓度 IC50(Half-maximal Inhibitory Concentration)为177 ng/mL。由标准曲线及检测限可确定其定量范围为40 ng/mL~640 ng/mL。
由图4可知,一次完整的SPR检测过程包括结合、解离、再生及恢复四个过程,耗时约为15 min左右。在实际应用过程种,根据单次测量的响应值,由标准曲线可得到相应的OA浓度值。相比化学仪器分析法及酶联免疫法,其快速定量过程是一大优势,可满足现场实时检测的需求。
4 结论与展望
本文结合表面等离子共振技术与免疫检测技术,以大田软海绵酸为例,以点带面,研究和建立了一种新型赤潮毒素的检测方法。并基于所设计的表面等离子免疫检测分析系统,分析评价了该方法的主要性能指标。研究表明,所建立的检测方法,可以满足国际上对于海水赤潮灾害毒素警戒标准的检测要求。所采用免疫检测技术具有特异性,可直接分析海水中OA,省去了大量繁琐的样品前处理过程,缩短了样品分析时间(单次样品的分析时间仅为15 min);所设计的传感器经再生后可重复使用上百次,且无需任何标记即可实现OA实时检测,从而大大节省分析测试的成本。实验结果表明,该系统实现OA检测的检测限未能明显优于其他的检测方法。但通过样品富集[12]或抗体信号增强[13]等方法可以大大改善系统的检测限,且所研究建立的新方法很好地克服了传统分析方法操作繁琐,检测时间长,成本高或需要标记等不足。因此,本文建立的新方法为海水水质的在线分析检测提供了新的选择方案。
[1]曾呈奎,相建海.赤潮藻及其毒素生物监测新技术[M].济南:山东科学技术出版社,1998.416-427.
[2]Horvitz W,Latimer G W.Official Methods of Analysis of AOAC International[R].Gaithersburg:AOAC Gaithersburg,2005.
[3]Diener M,Erler K,Hiller S,et al.Determination of Paralytic Shellfish Poisoning(PSP)Toxins in Dietary Supplements by Application of A New HPLC/FD Method[J].European Food Research and Technology,2006,224(2):147-151.
[4]黄爱君,黄海燕,刘建军.麻痹性和腹泻性贝类毒素的检测方法研究进展[J].环境与健康杂志,2010,1:84-86.
[5]陈静,周倩如,郭小琳,等.固相萃取—高效液相色谱串联离子阱质谱法测定水中微囊藻毒素[J].中国卫生检验杂志,2009,8:1720-1724.
[6]Chu F S,Hsu K H,Huang X,et al.Screening of Paralytic Shellfish Posioning Toxins in Naturally Occurring Samples with Three Different Direct Competitive Enzyme-Linked Immunosorbent Assays[J].Journal of Agricultural and Food Chemistry,1996,44(12):4043-4047.
[7]刘仁沿,梁玉波,张芳,等.中国沿海贝类腹泻性贝毒的酶联免疫分析方法[J].大连海事大学学报:自然科学版,2008,34(002):33-36.
[8]赵前程,来鹏,秦成,等.ELISA与小白鼠生物法检测腹泻性贝类毒素的研究[J].食品科技,2009,011:287-292.
[9]赵晓芳,计融.国内外腹泻性贝类毒素管理控制措施的比对分析[J].中国热带医学,2006,6(2):350-354.
[10]谢永红,王耀玲,程小丽,等.SPR生物传感器在急性白血病髓系抗原CD33检测中的应用[J].传感技术学报,2011,24(1):1-4.
[11]Center for Drug Evaluation and Research,Center for Biologicals E-valuation and Research,Food and Drug Administration.Guidance for Industry:Analytical Procedures and Methods Validation—Chemistry,Manufacturing,and Controls Documentation Draft Guidance[S].Rockville:Department of Health and Human Services,2000.9-11.
[12]Liu X,Sun Y,Song D,et al.Sensitivity-Enhancement of Wavelength-Modulation Surface Plasmon Resonance Biosensor for Human Complement Factor 4[J].Analytical biochemistry,2004,333(1):99-104.
[13]Xu LG,Peng C,Xu CL,et al.Development of the ELISA for Detection of Microcystin by Using Magnetic Nanometer Particle Enrichment Antibody[J].Toxicology Letters,2008,180:S120-S120.
