番茄红素菌体粉的安全毒理学评价
2011-10-09胡伟莲戴德慧石巧娟郭红刚萨晓婴
李 巍,胡伟莲,戴德慧,石巧娟,郭红刚,楼 琦,萨晓婴,*
(1.浙江省医学院科学院省实验动物中心,浙江杭州310013;2.浙江科技学院生化学院,浙江杭州310023)
番茄红素菌体粉的安全毒理学评价
李 巍1,胡伟莲2,戴德慧2,石巧娟1,郭红刚1,楼 琦1,萨晓婴1,*
(1.浙江省医学院科学院省实验动物中心,浙江杭州310013;2.浙江科技学院生化学院,浙江杭州310023)
以三孢布拉氏霉为菌种,对其发酵制备的番茄红素菌体粉的经口急性毒性、遗传毒性及短期毒性等进行了研究。结果表明:番茄红素菌体粉经口最大耐受量(MTD)大于18g·kg-1,毒性分级为无毒级;Ames实验、小鼠骨髓细胞染色体畸变实验、小鼠精子畸形实验均表明番茄红素菌体粉无明显遗传毒性;30d短期喂养各组小鼠无异常症状,无死亡,其对小鼠的体重增长、血常规、血生化、脏器系数均无显著的影响。揭示了番茄红素菌体粉有较好的安全性,为番茄红素菌体粉直接应用成保健食品等提供理论依据。
三孢布拉氏霉,番茄红素,菌体粉,毒理
番茄红素是类胡萝卜素家族中最重要的代表之一。长期以来,由于番茄红素分子两端没有芷香环结构,没有维生素A的生理活性,而一直未被重视。近年来的研究表明,在抗氧化方面,番茄红素比其它胡萝卜素具有更为优越的性能,如对单线态氧的清除能力,番茄红素是维生素E的100倍,是β-胡萝卜素的2倍多[1]。在提高机体免疫力,调控、抑制癌细胞增殖方面,番茄红素也具有很好的疗效[2-4],近年来已广泛应用到保健品、医药等领域。番茄红素主要的生产方法有化学合成法、天然提取法及发酵法,其中利用三孢布拉氏霉菌发酵生产展现了较好的工业化应用前景[5]。番茄红素菌体粉是以三孢布拉氏霉菌为菌种,经发酵后,将发酵液直接干制后得到的富含番茄红素的产品,由于没有提取纯化过程,整个生产过程中无废弃物排放,无有机溶剂残留及提取损失,同时避免了高纯度番茄红素在贮藏、销售过程中因不稳定而带来的损失。将番茄红素菌体粉直接应用于保健食品,可以节约生产成本,提高生产效率。本研究对番茄红素菌体粉的经口急性毒性实验、遗传毒性实验及小鼠30d短期喂养实验等进行了研究,为番茄红素菌体粉直接应用为保健食品等提供理论依据。
1 材料与方法
1.1 实验材料
番茄红素菌体粉 以三孢布拉氏霉为菌种,发酵液干制所得,-20℃保藏,番茄红素含量为1.87%;组氨酸营养缺陷型鼠伤寒沙门氏菌(Salmonella typhinurium) TA97、TA98、TA100、TA102,经鉴定各项遗传特性均符合实验要求,菌株增菌、基因型鉴定及各种实验用培养基均按保健食品安全性毒理学评价规范标准操作;ICR清洁级小鼠 来自浙江省实验动物中心,生产许可证号SCXK(浙)2008-0033,所有小鼠均喂养于屏障环境(空气洁净度万级,换气次数10~20次/h,温度20~26℃,日温差≤3℃,相对湿度40%~70%),小鼠饲喂60Co灭菌的营养配合饲料,饮用超滤水,笼器具、垫料等均经121℃高压灭菌,消毒20min;S9 用经多氯联苯诱导的大鼠肝匀浆(S9)并加相应的辅助因子(6-磷酸葡萄糖、辅酶Ⅱ)配制成体外代谢活化系统;高密度脂蛋白胆固醇试剂盒(HDL-C)、甘油三酯试剂盒、胆固醇试剂盒 上海复星长征医学科学有限公司。
表1 急性毒性小鼠体重增长记录(±s,g)
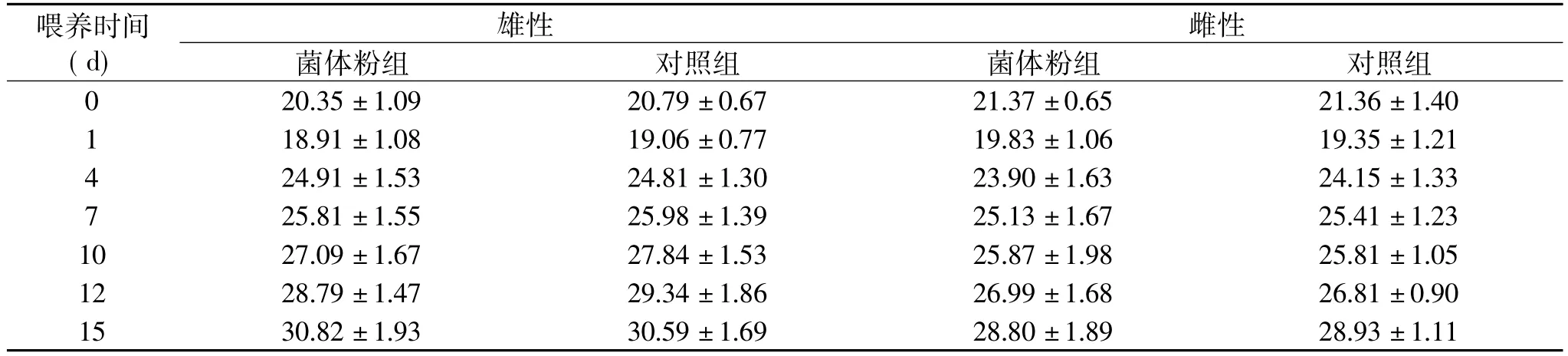
表1 急性毒性小鼠体重增长记录(±s,g)
注:给药组给药后体重与正常对照组比较无显著差异(P>0.05);表5~表8同。
喂养时间(d)雄性雌性菌体粉组 对照组 菌体粉组 对照组0 20.35±1.09 20.79±0.67 21.37±0.65 21.36±1.40 1 18.91±1.08 19.06±0.77 19.83±1.06 19.35±1.21 4 24.91±1.53 24.81±1.30 23.90±1.63 24.15±1.33 7 25.81±1.55 25.98±1.39 25.13±1.67 25.41±1.23 10 27.09±1.67 27.84±1.53 25.87±1.98 25.81±1.05 12 28.79±1.47 29.34±1.86 26.99±1.68 26.81±0.90 15 30.82±1.93 30.59±1.69 28.80±1.89 28.93±1.11
1.2 实验方法
1.2.1 急性毒性实验[6]将番茄红素菌体粉置于植物油中,配制成最大浓度的悬浮液,浓度为0.3g·mL-1,备用。选用18~24g ICR小鼠20只,雌雄各半,灌胃前16h禁食,称重后受试物按间隔6h分两次灌胃给予,灌胃容量为30mL·kg-1,累计总剂量为18g·kg-1,末次灌胃后2h恢复进食。连续观察14d,并记录动物中毒的表现和死亡情况。
1.2.2 Ames实验[7-8]番茄红素菌体粉样品经XAD-Ⅱ树脂柱过滤洗脱预处理后,浓度分别调整为200、500、1000、2500、5000μg/皿五个剂量,同时设立自发回变、溶剂对照及阳性对照组。用蒸馏水处理组为自发回变组;用二甲基亚砜为溶剂对照组;在不加S9的实验中,用敌克松或NaN3溶液作阳性对照;在加S9的实验中,用2-氨基芴(2,7-diaminofluorene)作阳性对照。采用平板掺入法,每组均做 3个平行皿。37℃培养48h,计数每皿回复突变菌落数。实验在相同条件下进行活化(加S9)和非活化(不加S9)实验,并重复2次。
1.2.3 小鼠骨髓细胞染色体畸变实验[9-10]25~30g ICR小鼠50只,雌雄各半。随机分为5组,每组10只。溶剂对照组给予植物油,阳性对照组给予环磷酰胺(CP)40mg·kg-1,低、中、高三个剂量组分别给予2.5、5.0、10.0g·kg-1番茄红素菌体粉样品(用植物油配至所需浓度)。各组连续灌胃给药3次,每次间隔24h,在末次给受试物后24h取材,处死动物前2h按4mg·kg-1体重腹腔注入秋水仙素。小鼠颈椎脱臼处死,取股骨骨髓细胞制片。每只动物分析100个中期相细胞。
1.2.4 小鼠精子畸形实验[11-12]雄性 ICR小鼠25只,体重28~35g,随机分为5组,每组5只。三个剂量组分别灌胃给予番茄红素菌体粉样品2.5、5.0、10.0g·kg-1,另设植物油对照组和环磷酰胺(CP)阳性对照组(50mg·kg-1)灌胃给予受试物。连续灌胃给药5d,至首次给受试物后的第35d取出两侧副睾精子制片。每组记数5只动物,每只动物计数1000个结构完整的精子,计算畸变精子发生率(以百分率计)。
1.2.5 30d短期喂养实验 18~24g ICR小鼠80只,雌雄各半。随机分成4组,每组20只。高、中、低剂量三个剂量组给药量分别为1.3、2.6、5.2g·kg-1。另设对照组一个,每天灌胃等剂量的植物油。实验期间每天观察小鼠一般状态、体征、摄食量、饮水及粪便状况。每7d测一次体重,连续观察30d。给药期满30d,禁食12h后,摘眼球取血,检查血液学指标及血液生化学指标。取动物肝、肾、脾、胃、睾丸或卵巢等脏器称重,根据体重计算器官重量系数,用10%甲醛固定后制备石蜡切片,HE染色观察病理变化。
2 结果与分析
2.1 小鼠急性经口毒性实验
小鼠给药后外观毛色光亮,无兴奋、不安、窜动、跳跃、竖毛、流泪、流涎、凸眼、扭体反应现象;给药后摄食、取水、大小便等均无明显异常。观察期间无动物死亡,体重增长记录见表1。给药14d后,颈椎脱臼处死小鼠,进行心、肝、脾、肺、肾、子宫、睾丸、胃、肠等重要脏器病理检查,均未见出血、充血、水肿、渗出、溃疡、穿孔、胸腔、腹腔、心包膜无积液等明显的病理变化。该结果表明,番茄红素菌体粉雌雄两性小鼠经口的MTD均大于18g·kg-1。根据急性毒性分级,番茄红素菌体粉属无毒级。
2.2 Ames实验
从表2可以看出,番茄红素菌体粉Ames实验,各菌株在各剂量组无论代谢活化与否,细菌回变数均小于阴性对照组细菌回变数的2倍,且无剂量-效应关系,皆为阴性实验结果。而阳性对照组回变菌落数均明显高于阴性对照组2倍以上,表明该番茄红素菌体粉无诱导微生物基因突变的能力。
2.3 小鼠骨髓细胞染色体畸变实验
由表3可以看出,番茄红素菌体粉各剂量组与阴性对照组比较,差异均无统计学意义(P>0.05),与阳性对照组(CP组)比较差异极显著(P<0.01),且各实验结果染色体畸变率无剂量反应关系,表明番茄红素菌体粉无致小鼠骨髓细胞染色体畸变的作用。
2.4 小鼠精子畸形实验
表2 番茄红素菌体粉Ames实验结果(±s)

表2 番茄红素菌体粉Ames实验结果(±s)
注:*与对照组比差异显著(P<0.05),**与对照组比差异极显著(P<0.01);表3、表4同。
组别 剂量(μg/皿)TA97 TA98 TA100 TA102-S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9空白对照 0 118±11.5 115±12.9 29±2.5 31±5.0 134±10.0 162±10.3 193±5.7 207±8.6溶剂对照 DMSO 121±9.5 132±9.6 33±3.5 32±3.6 148±12.5 173±7.9 196±5.5 216±14.5 5000 126±10.0 129±14.3 27±3.7 30±4.8 126±9.6 123±11.0 247±9.8 258±9.0 2500 135±10.5 140±16.0 31±4.5 31±4.4 151±11.5 183±12.1 221±11.0 252±12.2菌体粉 1000 120±11.1 122±15.5 27±4.4 29±3.6 133±9.4 166±12.3 210±8.2 239±12.7 500 141±9.0 145±14.1 30±4.5 33±5.5 163±11.2 183±13.7 219±11.2 238±16.0 200 133±14.5 117±12.4 33±3.0 34±4.2 119±10.5 153±28.2 225±12.3 233±9.2地可松 50 2778±164.5**1312±110.7**929±85.6**NaN3 1.5 2843±128.7**2-AF 10 1980±135.3**6223±105.1**3134±115.3**293±10.6

表3 小鼠染色体畸变实验结果

表4 番茄红素菌体粉精子畸形实验结果
表5 番茄红素菌体粉对小鼠体重的影响(±s,g)

表5 番茄红素菌体粉对小鼠体重的影响(±s,g)
组别喂养时间(周)给药前1234对照组 19.99±2.04 26.56±2.39 29.58±2.71 31.45±2.80 32.11±2.84菌体粉(g·kg-1)1.3 20.54±2.39 26.1±2.69 27.94±3.13 29.53±3.22 30.75±3.29 2.6 20.26±1.99 25.81±1.58 27.68±2.05 29.11±2.42 30.01±2.61 5.2 20.75±2.44 26.40±2.36 28.33±2.52 29.76±2.93 30.81±3.18
由表4可知,番茄红素菌体粉各剂量组与阴性对照组比较,差异均无统计学意义(P>0.05),与阳性对照组(CP组)比较差异极显著(P<0.01),表明在本实验条件下,番茄红素菌体粉对小鼠精子无畸变作用。
2.5 30d饲喂实验结果
2.5.1 番茄红素菌体粉对小鼠的一般毒性反应
高、中、低三个剂量给药组及植物油溶剂对照组小鼠在30d实验期内实验动物均活动正常,毛色光泽,进食饮水正常,大、小便无异常改变,无死亡。
2.5.2 番茄红素菌体粉对小鼠体重变化的影响 番茄红素菌体粉对小鼠体重的影响结果见表5,各组动物体重均增加。
由表5可知,高、中、低三个剂量给药组体重增长正常,各组与对照组结果比较,未见显著性差异(P>0.05)。
2.5.3 番茄红素菌体粉对小鼠脏器系数的影响 由表6可知,番茄红素菌体粉给药30d后,各剂量组与对照组结果比较,脏器系数未见显著性差异((P>0.05)。
2.5.4 番茄红素菌体粉对小鼠血常规指标的影响 番茄红素菌体粉对小鼠血常规指标的影响结果见表7。
由表7可知,各剂量组小鼠白细胞数量(WBC)、嗜中性白细胞百分比(NE%)、淋巴细胞百分比(LY%)、单核细胞百分比(MO%)、嗜酸性粒细胞百分比(EO%)、嗜碱性粒细胞(BA%)、红细胞数量(RBC)、血红蛋白浓度(Hb)、红细胞压积(HCT%)、平均红细胞压积(MCV)、平均红细胞血红蛋白含量(MCH)、平均红细胞血红蛋白浓度(MCHC)、红细胞分布宽度(RDW%)血小板数量(PLT)、平均血小板容量(MPV)等指标与对照组比较差异均无显著性(P>0.05)。
表6 番茄红素菌体粉对小鼠脏器系数的影响(±s)
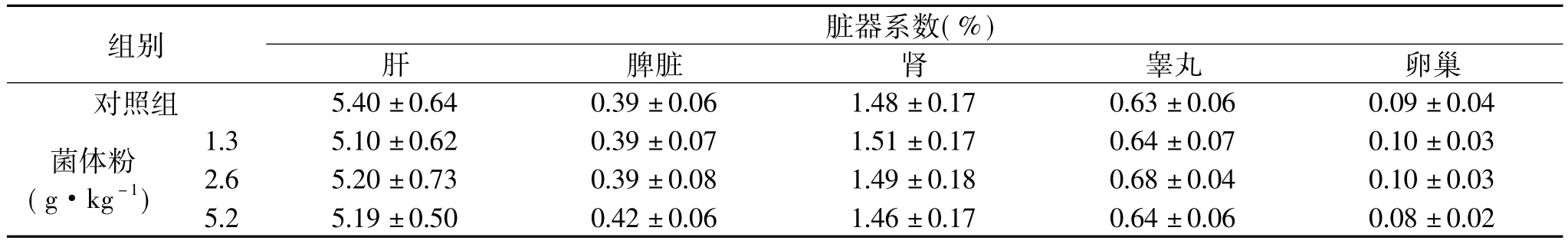
表6 番茄红素菌体粉对小鼠脏器系数的影响(±s)
组别脏器系数(%)肝脾脏 肾 睾丸 卵巢对照组 5.40±0.64 0.39±0.06 1.48±0.17 0.63±0.06 0.09±0.04菌体粉(g·kg-1)1.3 5.10±0.62 0.39±0.07 1.51±0.17 0.64±0.07 0.10±0.03 2.6 5.20±0.73 0.39±0.08 1.49±0.18 0.68±0.04 0.10±0.03 5.2 5.19±0.50 0.42±0.06 1.46±0.17 0.64±0.060.08±0.02
表7 番茄红素菌体粉对小鼠血常规的影响(±s)

表7 番茄红素菌体粉对小鼠血常规的影响(±s)
组别测定指标WBC(K·μL-1) RBC(M·μL-1) HB(g·dL-1) HCT(%) MCV(fL)对照组 8.17±2.60 10.31±2.45 14.02±3.71 55.66±14.51 54.43±9.83菌体粉(g·kg-1)1.3 6.80±2.77 10.40±1.45 14.48±2.11 55.11±9.95 53.05±6.70 2.6 7.04±1.58 9.95±2.60 14.31±2.21 54.29±15.85 55.39±9.69 5.2 7.66±3.80 9.15±2.88 12.78±4.43 50.10±20.35 53.40±7.87组别 测定指标MPV(fL) MCH(Pg) NE(%) LY(%) EO(%)对照组 4.91±0.23 13.46±1.50 25.60±7.31 63.19±8.491.48±3.35菌体粉(g·kg-1)1.3 5.03±0.26 13.93±0.74 25.04±9.01 63.88±10.80 0.46±0.52 2.6 4.99±0.35 14.02±0.90 26.45±5.49 62.72±8.23 1.41±3.02 5.2 5.02±0.21 13.78±0.85 21.49±8.99 67.88±11.13 0.79±1.21组别 测定指标MO(%) BA(%) MCHC(Pg) RDW(%) PLT(K·μL-1)对照组 9.60±4.86 0.14±0.14 25.19±3.46 16.18±0.69 758.95±227.19菌体粉(g·kg-1)1.3 10.54±3.81 0.08±0.07 26.48±2.02 16.53±0.84 871.32±212.55 2.6 9.01±3.01 0.42±1.07 25.99±2.77 16.79±1.47 841.67±215.72 5.2 9.60±4.57 0.24±0.42 26.09±2.31 16.50±0.96 788.23±280.69
表8 番茄红素菌体粉对小鼠血生化的影响(±s)

表8 番茄红素菌体粉对小鼠血生化的影响(±s)
测定指标TG(mmol·L-1) CHO(mmol·L-1) GOT(U·L-1) GPT(U·L-1) CRE(mmol·L-1)组别对照组 146.61±12.27 2.49±0.73 88.40±7.13 46.75±10.74 75.75±11.54菌体粉(g·kg-1)1.3 147.22±9.89 2.73±0.74 86.95±9.94 45.25±8.38 74.75±7.06 2.6 147.79±13.82 2.68±0.59 85.75±13.72 49.85±5.49 76.10±8.13 5.2 149.03±10.34 2.84±0.69 85.90±10.34 50.40±11.42 71.05±15.65组别 测定指标BUN(mmol·L-1) GLU(mmol·L-1) TP(g·L-1) ALB(g·L-1)对照组7.35±1.23 10.15±2.51 61.61±6.80 30.94±4.09菌体粉(g·kg-1)1.3 7.22±1.02 10.40±2.29 59.70±6.68 31.11±2.55 2.6 7.47±0.93 10.43±1.65 59.63±4.66 31.47±4.81 5.2 7.21±1.05 10.71±1.21 60.66±4.50 29.89±3.05
2.5.5 番茄红素菌体粉对小鼠血生化指标的影响由表8可知,各剂量组小鼠谷丙转氨酶(GPT)、谷草转氨酶(GOT)、总蛋白(TP)、白蛋白(ALB)、尿素氮(BUN)、肌酐(CRE)、总胆固醇(CHO)、甘油三脂(TG)、葡萄糖(GLU)等血生化指标和对照组比较差异均无显著性(P>0.05)。
2.5.6 30d喂养小鼠的病理组织学检查 各组心、肝、肾、脾、胃、睾丸及卵巢等器官大小、形态、色泽、质感等均未见异常;各主要脏器无明显变性、坏死,光泽正常;各器官HE染色观察未见异常。
3 讨论
天然番茄红素纯品主要从植物(番茄、番木瓜等)以及微生物菌体细胞(三孢布拉氏霉、藻类、红酵母等)中提取纯化而得,一般认为天然番茄红素是无毒、安全的。王凤鸣等[13]通过小鼠急性毒性实验、Ames实验、小鼠骨髓嗜多染红细胞微核实验、小鼠精子畸形实验、大鼠30d喂养实验,对番茄红素的毒理学性质进行了系统研究。结果表明:番茄红素雌、雄小鼠LD50均大于200g·kg-1,属无毒物质;Ames实验、微核实验和精子畸形实验结果均为阴性;大鼠30d喂养实验结果显示,该样品30d喂养对大鼠各项观察指标未见毒性作用;病理组织学检查实验组被检脏器也未见有意义的病理改变。李淑琴[14]等的研究也表明了番茄红素为无毒级物质,无致突变作用。Christian[15]等考察了番茄红素对大鼠和兔的胚胎毒性和致畸作用,均未发现番茄红素对母鼠、母兔以及胎鼠、胎兔有直接的或潜在的毒害作用。Jonker等[16]通过大鼠90d喂养亚慢性毒性实验表明,番茄红素对大鼠神经行为、运动能力、血液学、体重、食物消耗量、临床化学、尿液、脏器系数、病理学、病理组织学等方面与对照组相比没有明显的改变,可以认为番茄红素作为药品和保健食品使用是安全可靠的。
由于番茄红素具有长链共轭双键结构,化学性质极不稳定,极易发生氧化降解,导致番茄红素提取纯化工艺复杂,损失较大,成本居高不下;同时在提取过程中菌丝体内除番茄红素之外的β-胡萝卜素、γ-胡萝卜素等其它类胡萝卜也均未得到有效利用。据报道,不同类胡萝卜素混合使用比单一类胡萝卜素生理功能更强。若将三孢布拉氏霉菌发酵后的菌体经低温真空干燥制成番茄红素菌体粉直接应用为保健食品,不仅可以省去番茄红素提取纯化过程,节约成本提高效率,同时可对发酵产物进行综合利用,减少发酵工厂的废弃物的排放及有机溶剂的使用。此外,在我们前期实验过程中还发现番茄红素菌体粉与番茄红素纯品相比,其稳定性要大大增加,保藏时间更长。因此,番茄红素菌体粉直接作为保健食品具有更广泛的应用前景。但微生物发酵是一个复杂的过程,除微生物菌体本身的特性外,还受培养基成分及浓度、pH、温度等多种因素的影响,环境条件的改变都可能产生不同的代谢产物。三孢布拉氏霉番茄红素菌体粉是否对机体有害目前在国内外仍未见研究报道。因此,在番茄红素菌体粉开发应用之前,对其安全毒理学评价具有十分重要的意义。本研究通过对急性毒性实验、Ames实验、小鼠精子畸变实验、小鼠骨髓细胞染色体畸变实验以及30d短期喂养实验的结果表明,番茄红素菌体粉具有较好的安全性,为番茄红素菌体粉的开发应用奠定了基础。
[1]Grassmann J.Terpenoids as plant antioxidants[J].Vitam Horm,2005,72:505-535.
[2]Darby S,Whitley E,Doll R,et al.Diet,smoking and lung cancer:a case-control study of 1000 cases and 1500 controls in south-west England[J].Br J Cancer,2001,84:728-735.
[3]De Stefani E,Boffetta P,Oreggia F.Plant foods and risk of laryngeal cancer:a case-control study in Uruguay[J].Int J Cancer,2000,87:129-132.
[4]Balestrieri ML,Prisco RDE,Nicolaus YB,et al.Lycopene in association with α-tocopherol or tomato lipophilic extracts enhances acyl- platelet- activating factorbiosynthesis in endothelial cells during oxidative stress[J].Free Radic Biol Med,2004,36(8):1058-1067.
[5]马永强.三孢布拉霉生产番茄红素发酵条件的研究[J].食品研究与开发,2007,28(4):54-57.
[6]于文利,赵亚平,薛正,等.两种抗氧化剂协同增效及其抗衰老的研究[J].中国油脂,2000,227(1):l48-150.
[7]戴秋萍,王兰芳,郭薇薇,等.番茄红素对果蝇寿命的影响及其分子机制[J].营养学报,2008,30(4):392-396.
[8]杨坤.微胶囊化番茄红素的研究[D],江南大学,2005.
[9]于文利,舒伯,赵亚平,等.番茄红素生理功能的动物实验评价[J].无锡轻工大学学报,2005(1):99-101.
[10]Zsuzsanna Fazekas,Dayuan Gao,Rao N Saladi,et al.Protective effects of lycopene against ultraviolet B-induced photodamage[J].Nutrition and Cancer,2003,47(2):181-187.
[11]廖彩霞.番茄红素的生理学功能研究现状[J].浙江中西医结合,2004,14(9):592.
[12]熊正英,刘军.番茄红素的生物学功能及其与运动能力的关系[J].山东体育学院学报,2003,19(2):33-35.
[13]王凤鸣,程东,韩晓英,等.番茄红素的毒性研究[J].医学动物防制,2004(8):467-469.
[14]李淑琴,陈俊文,边林秀,等.番茄红素软胶囊急性毒性及致突变性研究[J].中国药物与临床,2005(9):719.
[15]M S Christian,Stefan Schulte,Jürgen Hellwig.Developmental(embryo-fetal toxicity/teratogenicity)toxicity studies of synthetic crystalline lycopene in rats and rabbits[J].Food and Chemical Toxicology,2003,41(6):773-783.
[16]D Jonkera,C F Kupera,N Fraileb,et al.Ninety-day oral toxicity study of lycopene from Blakeslea trispora in rats[J].Regulatory Toxicology and Pharmacology,2003,37(3):396-406.
Study on safety toxicology evaluation of mycelium powder rich in lycopene
LI Wei1,HU Wei-liang2,DAI De-hui2,SHI Qiao-juan1,GUO Hong-gang1,LOU Qi1,SA Xiao-ying1,*
(1.Zhejiang Academy of Medical Sciences,Zhejiang Center of Laboratory Animals,Hangzhou 310013,China;2.Department of Biology and Chemical Engineering,Zhejiang University of Science and Technology,Hangzhou 310023,China)
The acute toxic test,genetic toxicity test and 30d feeding test of mycelium powder rich in lycopene prepared by fermentation of Blakeslea trispora were studied.The maximum tolerated dose(MTD)of mycelium powder in mice was over 18g·kg-1,which indicated it was non-toxic.No positive was found on Ames test,mice bone marrow cells chromosome aberration test and mice sperm shape abnormality test.On 30d feeding test,there was no abnormal symptoms and death in all the mice,and the indicators of weight,routine analysis of blood,blood biochemistry,organ coefficient and histopathological examination showed no significant differences compared with control group(P>0.05).The results showed that mycelium powder was safe for oral administration with no obvious toxic side effects,and it provided an experimental and theoretical basis for the research and development of mycelium powder rich in lycopene as a health foods.
Blakeslea trispora;lycopene;mycelium powder;toxicology
TS201.4
A
1002-0306(2011)04-0357-05
2010-09-03 *通讯联系人
李巍(1980-),女,研究实习员,硕士,研究方向:药理学。
浙江省科技计划资助项目(2009C32072)。
