HPLC法对细辛含药血清中AAⅠ的含量测定
2011-10-09黄必胜周祯祥黄保希
黄必胜,周祯祥,黄保希
1 仪器与试剂
1.1 仪器
戴安高效液相色谱仪:P680型输液泵、在线脱水机、手动进样器、TCC-100柱温箱、PDA-100二极管阵列检测器、chromeleon色谱工作站,戴安公司。
1.2 试剂
马兜铃酸A(AAⅠ):中国药品生物制品检定所(批号:110746-200305);甲醇(色谱纯):上海振兴化工一厂;冰乙酸(分析纯):天津市科密欧化学试剂开发中心;重蒸馏水、细辛含药血清和空白含药血清:由课题组提供。
2 方法与结果
2.1 色谱条件
色谱柱:D i a m o n T M O D S-C 1 8(2 5 0 mm×4.6 mm,5 μm);流动相:甲醇-水-醋酸(72∶27∶1);柱温:室温;检测波长:390 nm;流速:1 mLmin-1。
2.2 AAⅠ对照品溶液、供试品溶液和空白血清组溶液的制备
精密称取适量AAⅠ对照品8 mg,置于10 mL的容量瓶中,加甲醇溶解并稀释至刻度,摇匀,0.45 μm微孔滤膜过滤,取续滤液,制得AAⅠ对照品溶液,避光保存备用。精密量取细辛含药血清和空白血清各15 mg分别置于25 mL的容量瓶中,加甲醇溶解并稀释至刻度,摇匀,0.45 μm微孔滤膜过滤,取续滤液,制得供试品溶液和空白对照组溶液,避光保存备用。
2.3 系统适用性实验
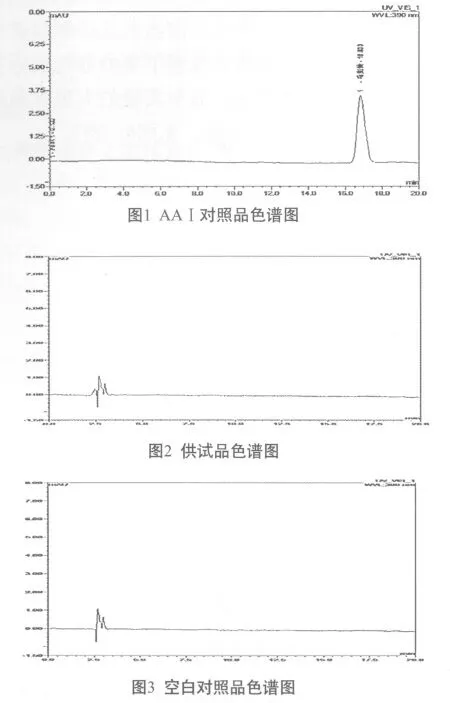
取AAⅠ对照品溶液、供试品溶液及空白对照品溶液各20 μL,注入高效液相色谱仪按以上色谱条件测定,记录色谱图,结果见图1~3。由图1~3可知,AAⅠ的保留时间为16.833 min。
2.4 标准曲线的制备与线性考察
精密吸取AAⅠ对照品储备溶液0.06 mL,0.12 mL,0.3 mL,0.6 mL,3 mL,6 mL,分别置于10 mL的容量瓶中,加甲醇至刻度,摇匀,进样为20 μL,记录峰面积,以AAⅠ对照品溶液浓度为横坐标,峰面积为纵坐标,绘制标准曲线(见表1,图4)。结果表明,AAⅠ峰面积在0.2~0.6 mgL-1浓度范围内呈良好的线性关系,最低检测限为0.2 μgmL-1。回归方程为Y=7262.8X+2.4(r=0.9988,n=5)。

表1 AAⅠ对照品标准曲线测定峰面积
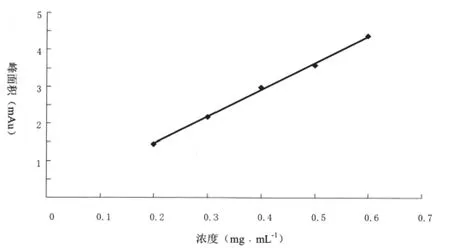
图4 AAⅠ对照品标准曲线
2.5 精密度考察
精密吸取AAⅠ对照品溶液20 μL,进样5次,得峰面积值的RSD=2.68%(n=5),结果表明仪器与色谱条件具有良好的精密度。结果见表2。
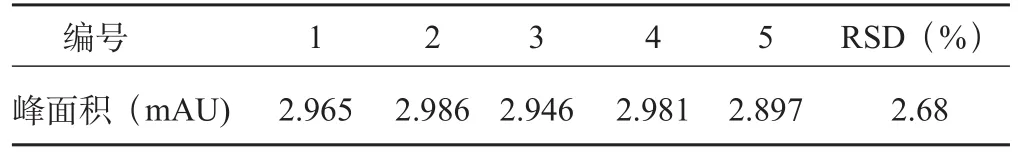
表2 精密度考察(n=5)
2.6 稳定性考察
取供试品溶液,在配制后0 h,4 h,8 h,12 h,16 h和24 h于同一色谱条件下分别进样20 μL,所得峰面积值的RSD=2.38%(n=6),表明供试品溶液在24 h内基本稳定。结果见表3。

表3 稳定性考察(n=6)
2.7 加样回收率考察
精密吸取供试品溶液10 mL平行6份,分成3组,每组2份,分别加入AAⅠ对照品溶液0.5 mL,1 mL及2 mL,置于10 mL的容量瓶中,加甲醇溶解并稀释至刻度,摇匀,分别进样20 μL,记录色谱图。得出平均加样回收率为100.02%,RSD=2.74%(n=6)。结果见表4。
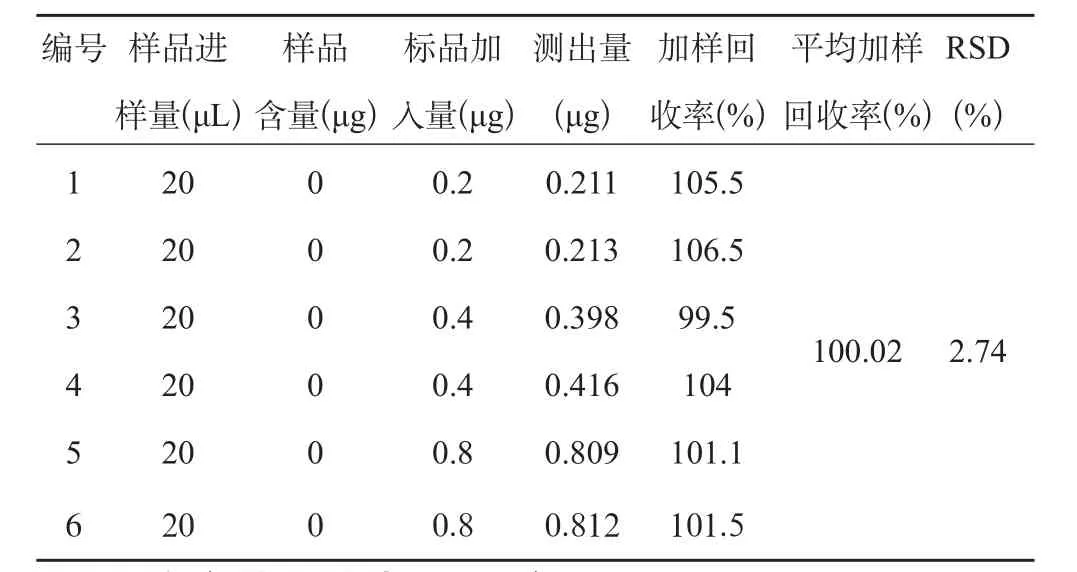
表4 加样回收率考察(n=6)
2.8 细辛含药血清中AAⅠ含量测定
分别取供试品溶液20 μL注入高效液相色谱仪分析,记录峰面积,以外标法计算AAⅠ的含量,结果供试品中AAⅠ的含量低于最低检测限,故忽略不计其具体含量(表10)。
表5 细辛含药血清中AAⅠ含量测定(n=6)
3 讨论与体会
马兜铃酸(aristolochic acid,AA)可引起肾脏损害的临床报道和毒理研究已经引起全世界的广泛关注和高度重视。2000年5月,美国药品与食品管理局(FDA)公布了含有AA的植物品种名单[1],其中涉及17种中药材,马兜铃科细辛属细辛被列在名单之中。
AA可引起慢性肾脏损害,国外学者称之为“中草药肾病”(Chinese herbs nephropathy,CHN)[2]。国内学者认为[3~6],AA是引起CHN的主要毒性物质,而含AA的仅限于马兜铃属的少数药物,并非所有中药都会引起肾损害。因此,国内学者提出“马兜铃酸肾病”(aristolochic acid nephropathy,AAN)这一概念,得到了国内外学者的普遍认同。
AA类物质是3,4-次甲二氧基-10硝基-1菲类衍生物,是马兜铃科马兜铃属植物所含的共有成分。AA主含AAⅠ,马兜铃酸B(AAⅡ)和马兜铃内酞胺Ⅰ(ALⅠ)等,是目前公认的毒性成分,其中AAⅠ含量最高[8]。据报道[7],AAⅠ对肾小管上皮细胞超微结构的影响具有一定的特征性,突出表现为细胞核的损伤。在急性AAN患者的肾活检组织以及众多AAN动物模型中发现,肾小管上皮细胞在发生急性损伤、坏死的同时并没有出现增殖现象。提示AAⅠ及其代谢产物在直接损伤细胞的同时,还抑制了细胞的增殖能力。李氏等[9]研究发现,AAⅠ可致猪肾小管上皮细胞系LLC-PK1细胞DNA损伤,使细胞周期阻滞在G2/M期,认为这可能是AA肾损伤后肾小管上皮细胞再生修复能力差的机制之一。以上研究均表明,AAⅠ是AA造成肾损伤的主要毒性物质。
相关文献报道[10~11],AAⅠ在细辛药材特别是在其根及根茎中含量很低,甚至痕量,以至于薄层色谱对其检测不到,而必须用灵敏度高的方法才能检测到。本实验用HPLC法检测细辛含药血清中AAⅠ,结果低于最低检测限,说明细辛含药血清中不含AAⅠ。因此,本研究认为,细辛虽属马兜铃科植物,但在常规使用下,是有效、安全的,不会引起肾毒或肾损伤。
[1] 鲍志东,叶晨,黄欣.马兜铃属植物的肾毒性[J].国外医学中医中药分册,2001,23(5):259.
[2] 孙伟.对中草药肾毒性的理性探讨[J].江苏中医,2001,22(10):1.
[3] 谌贻璞,陈文.马兜铃酸肾病存在四种临床病理类型[J].中华肾脏病杂志,2000,⑹:406.
[4] 康亚国,宋晓群.对中药毒性问题的认识[J].陕西中医学院学报,2001,24(3):51.
[5] 郭功玲,李吉华.对马兜铃酸肾病的新认识[J].上海中医药杂志,2003,37(1):33.
[6] 陈文,谌贻璞.马兜铃酸肾病的诊断与治疗[J].医师进修杂志,2003,26(5):11.
[7] 李恒,刘志红,陈惠萍,等.马兜铃酸I对肾小管上皮细胞超微结构的影响[J].肾脏病与透析肾移植杂志,2001,10(3):242.
[8] WangYins,PanJing-xian,GaoJian-Jun,et al.The antitumor con hlentsfrom stem of Aristolochiamanshuriensis[J]. Beijing MeclUniv,2000,32(1):18.
[9] 李瑛,刘志红,郭啸华,等.马兜铃酸I致肾小管上皮细胞DNA损伤的实验研究[J].肾脏病与透析肾移植杂志,2004,13(1):7.
[10] 徐玫,李景华.细辛不同部位的马兜铃酸A及挥发油含量研究[J].药物研究,2007,16(10):29.
[11] 黄顺旺.北细辛中不含马兜铃酸A的薄层色谱法鉴别[J].安徽医药,2003,7(4):299.
