PCR结合反向膜杂交快速鉴定临床常见念珠菌方法学的建立
2011-09-28李从荣
李 娟,李从荣,李 艳,顾 剑
(武汉大学人民医院检验科,湖北武汉430060)
深部真菌感染往往继发于其他系统性疾病,临床表现不典型,容易与原发病相混淆,诊断比较困难,而治疗时机的延误往往导致高感染率和高死亡率。来自美国休斯顿的一项研究表明,早期抗真菌治疗可极大改善病人预后[1]。
念珠菌属是深部真菌感染中最常见的病原菌,且存在天然耐药现象。本研究以18S rDNA基因和5.8S rDNA基因的保守序列设计真菌通用引物,以内转录间隔区ITS1段设计种特异性探针,利用PCR结合反向膜杂交技术,达到快速检测临床常见致病念珠菌的目的。
1 材料与方法
1.1 材料
1.1.1 试验菌株及生物学试剂 白色念珠菌,热带念珠菌,近平滑念珠菌,都柏林念珠菌,光滑念珠菌,克柔念珠菌,均是来源于卫生部临检中心质控菌株;季也蒙念珠菌;葡萄牙念珠菌;毛霉菌;清酒酵母;新生隐球菌;曲霉菌均由本院微生物室从临床标本中分离。Taq DNA聚合酶,10×PCR buffer,MgCl2,dNTPs;DNA marker,TE缓冲液(pH 8.0);TdT末端脱氧核苷转移酶;尼龙杂交膜;dTTP均由日本TaKaRa公司公司提供。凯普杂交配套试剂:由凯普科技生物公司提供。
1.1.2 引物及探针的设计
①参考Catriona Halliday[2]等人设计的通用引物扩增真菌转录间隔区ITS1。Its1F:19TCCGTAGGGAA CCTGCGG37;its1R:237CGCTGCGYTCTTCATCGATG208。3'端均采用生物素标记。
②根据ITS1基因序列多态性设计探针[3]
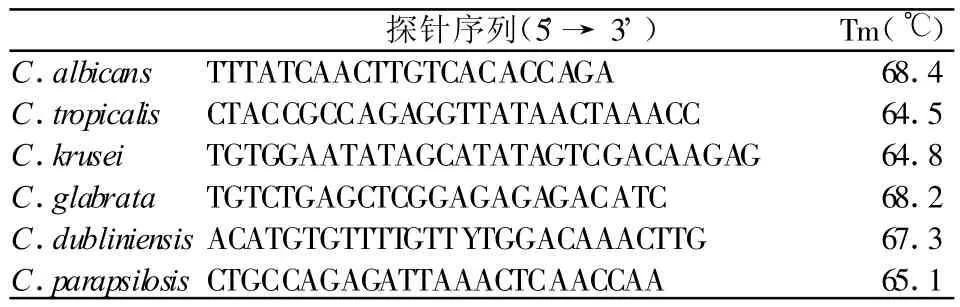
探针序列(5'→3') Tm(℃)C.albicans TTTATCAACTTGTCACACCAGA 68.4 C.tropicalis CTACCGCCAGAGGTTATAACTAAACC 64.5 C.krusei TGTGGAATATAGCATATAGTCGACAAGAG 64.8 C.glabrata TGTCTGAGCTCGGAGAGAGACATC 68.2 C.dubliniensis ACATGTGTTTTGTTYTGGACAAACTTG 67.3 C.parapsilosis CTGCCAGAGATTAAACTCAACCAA 65.1
阳性对照探针:TCCGTAGGGAACCTGCGG
1.2 方法
1.2.1 采用蛋白酶K-SDS法提DNA[4],置于4℃备用。
1.2.2 PCR 反应 10×PCR Buffer 2.5 μ l,2.0 mmol/L dNTP 2.5 μ l,1.5 mmol/L MgCl21.5 μ l,10 pmol/L生物素标记的上、下游通用引物各1 μ l,0.5 U Taq DNA 聚合酶 1.0 μ l,DNA 模板 5 μ l,双蒸水补足至25 μ l。97℃预变性10 min后,进入循环。95℃变性3 min,53℃退火30 s,72℃延伸60 s,35个循环后,72℃延伸7 min。
1.2.3 反向膜杂交 杂交膜的制备:5×dTTP buffer 4 μ l,TdT 4 μ l,dTTP 5 μ l,10 pmol oligo 1 μ l,双蒸水补足至 20 μ l体积,于 37 ℃水浴60 min,后加入 2 μ l 0.5 mmol/L EDTA,70℃s水浴10 min行终止反应。然后将上述反应液点滴于尼龙杂交膜上。在紫外灯下照射2 min,后烘干备用。按此方法制备含阳性对照探针以及目标探针的尼龙膜。
杂交前操作前准备:按照凯普杂交仪使用说明进行操作。
杂交:置PCR产物于PCR仪做解链反应(变性)(95℃5 min,4℃2 min以上),同时向杂交膜上加45℃杂交液500 μ l,孵育2 min以上。开泵吸走残余杂交液 ,将变性PCR 产物20 μ l与500 μ l 45℃杂交液混合,加于杂交膜上,盖板孵育10 min。开泵吸走杂交液,洗膜2次。调整杂交仪温度为25℃,加500 μ l封阻液封闭5 min后吸走封阻液。此时温度应在25±3℃,加入500 μ l酶标液,孵育3.5min后吸走 。调整杂交仪温度为 36℃,加溶液A500 μ l洗膜 3次。之后加入显色剂NBT/BCIP 500 μ l显色 3 min,吸走显色剂后加溶液B500 μ l洗膜3次。漂洗一次。取出杂交膜,阅读结果,蓝紫色圆点为酶学反应阳性点。
2 结果
2.1 引物的通用性和特异性评价

图1 通用引物扩增产物电泳图谱
8株实验菌株均能通过PCR扩增出相应的产物,大小为218 bp,以下几种临床分离株:曲霉菌、毛霉菌、清酒酵母、新生隐球菌均能扩增出相应的产物,大小从200 bp-500 bp不等(见图1)。
2.2 试验菌株杂交结果
反向膜杂交均能将念珠菌鉴定到种(见图2-7),且所有基因型别可以在同一张膜上进行检测(见图8),而正常人类基因组DNA及临床常见的几种真菌杂交结果均为阴性。
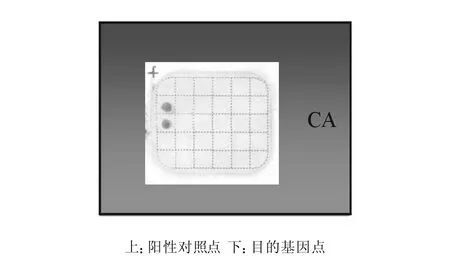
图2 白色念珠菌杂交图谱

图3 热带念珠菌杂交图谱

图4 近平滑念珠菌杂交图谱

图5 都柏林念珠菌杂交图谱
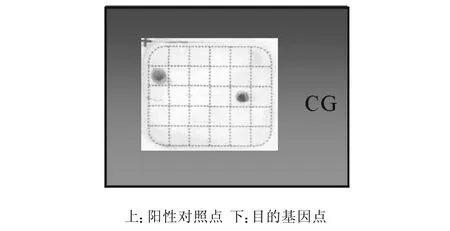
图6 光滑念珠菌杂交图谱

图7 克柔念珠菌杂交图谱
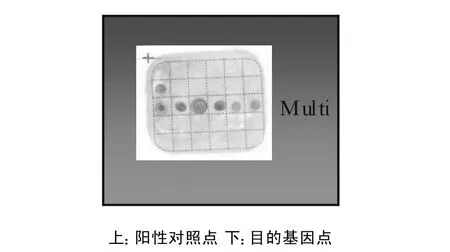
图8 六种念珠菌同时杂交图谱
2.3 鉴定时间的比较
整个检测过程包括杂交膜的制备、临床标本DNA的提取、PCR反应以及盖板杂交,共耗时约5-6个小时,由于杂交膜事先可以制备好,并可在常温干燥环境存放半年左右,故整个检测过程实际上最短在3-4小时内即可完成,而传统的培养方法至少需耗时48小时。
3 讨论
深部真菌病的死亡率往往在40%以上,特别是ICU病房的重症患者,深部真菌感染的死亡率更高,由于其临床表现缺乏特异性,确诊仍依赖于组织中发现真菌成分和相应的阳性培养结果,但这些传统的方法敏感性不高,往往容易失去最佳救治机会,因此,如何提高真菌感染的早期、特异诊断水平是目前临床真菌学领域的研究热点,也是临床检验工作中亟待解决的问题。将病原真菌鉴定到种水平的临床意义主要在于药物选择,因为不同菌种对抗真菌药物的敏感性不同,如克柔念珠菌对氟康唑天然耐药、对两性霉素B不够敏感;光滑念珠菌对氟康唑不够敏感;土曲霉、波氏假霉样真菌、毛孢子菌等对两性霉素B天然耐药;接合菌对除泊沙康唑外的唑类药物均不敏感等[5]。如果鉴定结果发现这些真菌,将可避免临床用药上的偏差。
目前临床上分离的深部真菌仍以念珠菌属为主,霉菌的分离率相对较低,美国马塞诸塞州在2008-2009两年内对79个医学中心监测的真菌血培养阳性的1239例病原菌进行分析发现,白色念珠菌仍居于首位,达到50%,其余依次为光滑念珠菌17.4%,近平滑念珠菌17.4%,热带念珠菌9.8%,克柔念珠菌1.8%[6]。
真菌的 rDNA基因是一种串联重复基因,即18SrDNA-ITS1-5.8SrDNA-ITS2-28SrDNA转录单位,分隔18S、5.8S、28SrDNA基因亚单位的序列称为内转录间隔区(internal transcribed space,ITS),为非编码区。由于ITS区不加入成熟核糖体受到的选择压力较小,进化速率较快,在绝大多数的真核生物中表现出了极为广泛的序列多态性。同时ITS序列长度适中,序列中有足够的信息,可广泛用于属内种间或种内群体的系统学研究[7]。
PCR结合反向膜杂交技术,是用生物素标记通用引物,PCR扩增得到的产物变性后与固定在尼龙膜上的特异性探针进行杂交,探针捕获的生物素和标记碱性磷酸酶的链酶亲合素特异性结合后,酶催化底物显色,在尼龙膜上显出蓝紫色斑点。这样使得特异性得到大大提高,同时SA-AP标记显色系统也使得检测灵敏度得到提高。
本实验结果显示,所选用的探针均能检测出相应的靶序列,每张膜上只有阳性对照点和与靶序列对应的探针点有阳性结果,其他探针点均为阴性。6种念珠菌的PCR产物与膜杂交,在特异性探针位点上均出现杂交斑点,表明此方法可检测几种菌的混合感染。由于尚未设计霉菌、清酒酵母、隐球菌的检测探针,因此,这三种菌的PCR扩增结果为阳性,杂交结果均为为阴性,而正常人类基因组DNA扩增结果及杂交结果均为阴性。结果表明,实验中设计使用的探针未有非特异性的交叉反应,可以对真菌进行种间分型检测,显示了较好的特异性和敏感性。
另外,整个检测过程包括杂交膜的制备共耗时约5-6个小时,由于杂交膜事先可以制备好,并可在常温干燥环境存放半年左右,故整个检测过程实际上最短在3个小时内即可完成,而传统的培养方法需要耗时约48小时,这对于指导临床科学用药,减少因经验性治疗导致的耐药问题亦具有重要的意义。
[1]Garey KW,Rege M,Pai M P,et al.Time to initiation of fluconazole therapy impacts mortality in patients with candidemia:A multi-institutional study[J].Clinical Infectious Diseases,2006,43(1):25.
[2]Catriona Halliday,SharonChen,Anna Lau,et al.Sorrell Reverse Line Blot Hybridization Assay for Identification of Medically Important Fungi from Culture and Clinical Specimens[J].J Clin Microbiol,2007,45:2872.
[3]Ciardo DE,Ciardo DE,Schär A,et al.Internal transcribed spacer sequencing versus biochemical profiling for identification of medically important yeasts[J].Clin Microbiol,2006,44:77.
[4]向华国,熊礼宽,涂植光.几种提取生殖道常见病原菌DNA方法的比较[J].现代检验医学杂志.2006,21(5):54.
[5]李若瑜.应用现代化诊断方法提高我国真菌病诊断水平[J].中华检验医学杂志,2008,31(2):125.
[6]PfallerMA,Castanheira M,Messer SA,et al.Variation in candida spp.distribution and antifungal resistance rates among bloodstream infection isolates by patient age:report from the SENTRY Antimicrobial Surveillance Program(2008-2009).Diagnostic Microbiology and Infectious Disease,2010,68(3):278.
[7]Iwen PC,Hinrichs SH,Rupp ME.Utilization of the internal transcribed spacer regions as molecular targets to detect and identify human fungal pathogens[J].Medical Mycology,2002,40(1):87.
