盐酸曲美他嗪分散片的制备与质量控制
2011-09-28刘海蓉
刘海蓉
(南京大学口腔医学院南京市口腔医院,江苏 南京 210008)
盐酸曲美他嗪分散片的制备与质量控制
刘海蓉
(南京大学口腔医学院南京市口腔医院,江苏 南京 210008)
目的 对盐酸曲美他嗪分散片的制剂工艺和质量控制方法进行研究。方法 根据处方和制备工艺制备盐酸曲美他嗪分散片,采用高效液相色谱法测定其有关物质,紫外分光光度法测定其含量和溶出度。结果 所制盐酸曲美他嗪分散片质量稳定,主要质量参数分散均匀性符合要求。结论 盐酸曲美他嗪分散片的设计合理,质量可控,稳定性好。
盐酸曲美他嗪;分散片;质量控制
盐酸曲美他嗪是法国施维雅公司研制的一种新型抗心肌缺血药物,由日本Kyoto制药公司在日本首先上市,商品名为Vastarel,迄今已在90多个国家广泛使用。盐酸曲美他嗪具有对抗肾上腺素、去甲肾上腺素及加压素的作用,能降低血管阻力,增加冠状动脉及循环血流量,促进心肌代谢及心肌能量的产生,同时也能降低心肌耗氧量,从而改善心肌氧的供需平衡[1]。盐酸曲美他嗪用于心绞痛的预防和治疗,具有临床疗效显著、可与其他药物合用、不良反应小等优点。近年来,随着临床研究的深入开展,盐酸曲美他嗪也逐渐应用在冠状动脉粥样硬化性心脏病、急性心肌梗死等其他心血管疾病的治疗[2-3]。目前国内盐酸曲美他嗪制剂皆为普通片剂或胶囊,但心绞痛常发病突然,患者急性发病时极有可能会发生吞服药物困难。分散片作为新兴剂型,具有崩解迅速、服用方便的特点,可吞服、咀嚼含吮或以水分散成均匀且口感良好的混悬液服用,尤其适合老人及吞服困难者或者特殊环境下的患者服用,可增加患者的顺应性[4]。因此,我院研制了盐酸曲美他嗪分散片。现将其制备和质量控制方法报道如下。
1 仪器与试药
ZRS-4型智能溶出试验仪(天津大学无线电厂);UV-2201型紫外-可见分光光度计(日本岛津公司);TDP型单冲压片机(上海天祥制药机械有限公司);SPD-10A/LC-10AT型高效液相色谱仪(日本岛津公司);Agilent 1100型自动进样器(美国安捷伦公司)。盐酸曲美他嗪对照品(中国药品生物制品检定所,批号为132381-200803);盐酸曲美他嗪(山东科源制药有限公司,批号为080912);微晶纤维素(批号为080717)、磷酸氢钙(批号为080309)均由安徽山河药用辅料股份有限公司生产;交联聚维酮(美国国际特品公司,批号为03400119204);交联羧甲基纤维素钠(美国FMC公司,批号为TN08820465);阿司帕坦(常州法码泰克药用辅料有限公司,批号为07102218);硬脂酸镁(湖州展望药业有限公司,批号为20080107)。
2 方法与结果
2.1 处方与制备
2.1.1 处方
盐酸曲美他嗪20 g,微晶纤维素66 g,磷酸氢钙45 g,交联聚维酮8 g,交联羧甲基纤维素钠6 g,阿司帕坦4 g,硬脂酸镁1 g,2%羟丙基甲基纤维素溶液(以50%乙醇配制)适量,共制成1 000片。
2.1.2 制备工艺
将盐酸曲美他嗪原料过100目筛,其余辅料过80目筛,取处方量的盐酸曲美他嗪与微晶纤维素、磷酸氢钙、阿司帕坦和交联聚维酮充分混合均匀;用2%羟丙基甲基纤维素乙醇(50%)溶液湿法制粒,过内径0.850 mm(24目)筛制得湿颗粒,烘干至水分不高于2%,制得干颗粒;将干颗粒以内径1.190 mm(16目)筛整粒,加入硬脂酸镁和交联羧甲基纤维素钠,混合均匀;根据颗粒含量计算片重,压片,得盐酸曲美他嗪分散片。
2.2 质量控制
2.2.1 有关物质检测(高效液相色谱法)
色谱柱以十八烷基硅烷键合硅胶为填充剂;流动相为用磷酸调 pH至 2.8的0.025 mol/L磷酸二氢铵溶液-甲醇(80∶20);检测波长为232 nm;流速为1.0 mL/min。精密称取本品细粉适量,约相当于盐酸曲美他嗪15 mg,置25 mL量瓶中,加流动相超声溶解并稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液;精密量取续滤液1 mL,置100 mL量瓶中,加流动相稀释至刻度,摇匀,作为对照溶液。取对照溶液10 μL,注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高为记录仪满量程的10% ~20%;再精密量取供试品溶液与对照溶液各10 μL,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。供试品溶液色谱图中如有杂质峰,各杂质峰峰面积的和不得大于对照溶液主峰面积的1.5倍(1.5%)。结果本品有关物质含量为0.32%。
2.2.2 含量测定(紫外-可见分光光度法)[5]
取本品20片,精密称定,研细,精密称取适量(约相当于盐酸曲美他嗪20 mg),置100 mL量瓶中,加0.05 mol/L的硫酸溶液适量,超声使盐酸曲美他嗪溶解,放冷,用0.05 mol/L的硫酸溶液稀释至刻度,摇匀,滤过,精密量取续滤液5 mL,置50 mL量瓶中,用0.05 mol/L的硫酸溶液稀释至刻度,摇匀,照2005年版《中国药典(二部)》附录ⅣA紫外-可见分光光度法在232 nm波长处测定吸光度,按C14H22N2O3·2 HCl的吸收系数()为286计算,即得。结果本品相对百分含量为99.6%。
2.2.3 分散均匀性
按照2005年版《中国药典(二部)》附录ⅠA规定操作,取本品2片,置100 mL水中振摇,水温(20±1)℃,应在3 min内崩解,混悬液应能全部通过2号筛(内径0.850 mm)。结果本品2 min内全部崩解,混悬液完全通过2号筛,表明分散均匀性良好。
2.2.4 溶出度测定
溶剂选择:盐酸曲美他嗪在水中易溶,故选用水为溶出介质。
测定波长选择:本品的溶出溶液在0.05 mol/L硫酸溶液中、(232±2)nm波长处具有明显的吸收特征,而处方量空白辅料同法测定则在232 nm波长附近无吸收,故选择232 nm为测定波长。
线性关系考察:取盐酸曲美他嗪20 mg,精密称定,用0.05mol/L的硫酸溶液配制成质量浓度分别为 4.0,8.0,12.0,16.0,20.0,24.0 μg/mL的溶液,在232 nm波长处测定吸光度,以吸光度(A)对溶液质量浓度(C)进行线性回归,得回归方程 A=0.027 8 C+0.017 2,r=0.999 9(n=6)。结果表明,盐酸曲美他嗪质量浓度在4.0 ~24.0 μg/mL 范围内与吸光度线性关系良好。
回收率试验:分别精密称取不同量的盐酸曲美他嗪和空白辅料,混匀,用0.1 mol/L硫酸溶液配制成分别含主药50%,80%,100%的溶液,每个质量浓度配制3份,作为供试品溶液。另取盐酸曲美他嗪对照品适量,用0.1 mol/L的硫酸溶液配制成每1 mL约含盐酸曲美他嗪20 μg的溶液,作为对照品溶液。取上述溶液,照紫外-可见分光光度法在232 nm波长处分别测定吸光度。结果平均回收率为99.8%,RSD=0.75%(n=9),表明方法回收率良好。
溶出曲线测定:取本品和市售普通片,照溶出度测定法,分别于 3,6,10,15,20,30 min 时取样,测定溶出曲线。结果所制盐酸曲美他嗪分散片溶出速率以及最终溶出度均优于市售普通片(图1)。
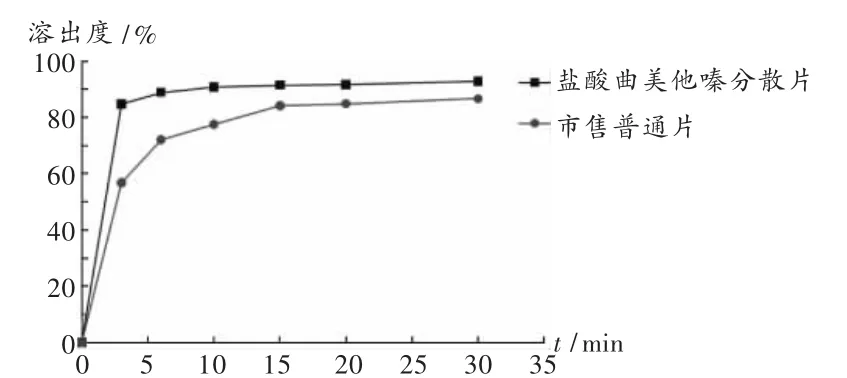
图1 盐酸曲美他嗪分散片和市售普通片的溶出曲线
溶出度测定:取本品,照2005年版《中国药典(二部)》附录ⅩC第一法溶出度测定法,以水500 mL为溶出介质,转速为75 r/min,操作15 min,取溶液适量,滤过,精密量取续滤液5 mL,置10 mL量瓶中,用0.1 mol/L的硫酸溶液稀释至刻度,摇匀,照2005年版《中国药典(二部)附录ⅣA紫外-可见分光光度法在232 nm波长处测定吸光度,按C14H22N2O3·2HCl的吸收系数()为286计算每片的溶出量,限度为标示量的75%。结果本品溶出度为(91.7±2.2)%(n=6)。
2.3 稳定性考察
分别将市售包装的样品于温度40℃、相对湿度75%的恒温恒湿条件下加速试验6个月,样品于留样室(温度25℃、相对湿度60%)自然放置24个月,检查主要质量指标。结果见表1。
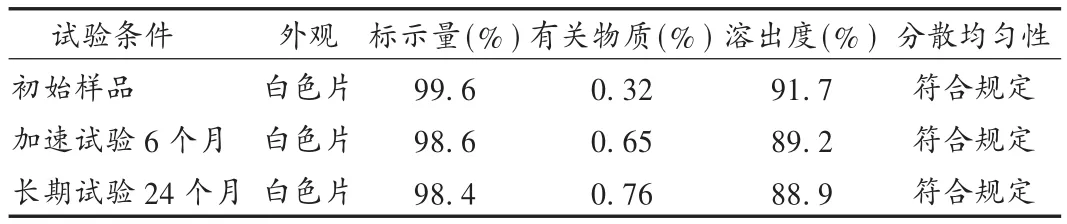
表1 稳定性考察结果
3 讨论
分散均匀性是分散片质量控制的一个重要指标,结合主药性质选择适合的崩解剂是处方制备中的关键因素之一。交联聚维酮是近年来开发的优良新辅料之一,具有很强的吸水膨胀性和优良的崩解性能,在水中可迅速表现出高的毛细管活性和优异的水化能力[6]。选择交联聚维酮内加、交联羧甲基纤维素钠外加的联合使用方式,充分利用不同崩解剂的不同作用原理,能够使盐酸曲美他嗪分散片迅速崩解,还可提高主药溶出度。本品在储藏过程中可能产生降解产物,为保证产品的质量稳定,在曲美他嗪片质量标准基础上,分散片的质量标准增加了有关物质的检查项,采用高效液相色谱法检测,并进行了方法学研究。长期稳定性试验结果表明,本品质量稳定,经加速试验6个月、长期稳定性试验24个月后,含量、溶出度和有关物质等项目均符合规定。
[1]罗先虎,罗 勇.曲美他嗪的临床应用与研究进展[J].实用心脑肺血管杂志,2009,17(12):1 114-1 117.
[2]范金英.曲美他嗪治疗冠心病的临床疗效[J].中国实用医药,2009,4(12):80-82.
[3]沈 宁,王 伟.曲美他嗪与急性心肌梗死的研究进展[J].医学综述,2009,15(20):3 149-3 152.
[4]徐 成,金 春,周自桂,等.乳酸左氧氟沙星分散片的制备与质量研究[J].医药导报,2009,28(5):642-645.
[5]WS-10001-(HD-1254)-2002,国家药品标准·曲美他嗪片[S].
[6]郑少杰,韩章远,韩永龙.药用辅料交联聚维酮的应用进展[J].中国药房,2010,21(13):1 244-1 246.
Preparation and Quality Control of Trimetazidine Hydrochloride Dispersion Tablets
Liu Hairong
(School of Stomatology, Nanjing Stomatological Hospital, Nanjing University, Nanjing,Jiangsu,China 210008)
Objective To study the preparation and quality control of Trimetazidine Dihydrochloride Dispersion Tablets.Methods The HPLC method was established for the related substances determination.The content and dissolution determination was established by UV spectrophotometry.Results The uniformity of disperse of Trimetazidine Dihydrochloride Dispersion Tablets was qualified.Conclusion The preparation was reasonable,controllable and stable.
trimetazidine hydrochloride;dispersion tablets;quality control
TQ460.6;R972+.3
A
1006-4931(2011)07-0032-03
2009-11-18)
刘海蓉,女,主要从事临床药学工作,(电话)025-83374241(电子信箱)lhr441441@163.com。
