PPP和根面脱矿对牙槽骨成骨细胞在病变牙根面附着及增殖的影响
2011-09-20张海燕杨俊海
张海燕,杨俊海,刘 琪
(1.北京电力医院口腔科,北京,100073;2.北京电力医院健康管理中心,北京100073;3.贵州遵义医学院附属口腔医院,贵州遵义,563003)
期望获得因疾病破坏的牙周支持组织的重塑及再生是当今牙周病治疗研究领域的热点[1]。在牙周组织的重塑和再生过程中,牙根面的生物相容性是一个重要因素,为促进牙周附着,根面进行平整后,通常采用根面处理,不仅可清除残存于根面的内毒素等有害物质,提高根面的生物相容性,而且有利于促进牙周膜成纤维细胞(PDLF)、牙龈成纤维细胞(HGF)等对牙根面的附着和增殖[2-3]。
贫血小板血浆(PPP)即纤维素(Fibrin),它是由人自身的新鲜全血制成,杜绝了感染,降低了变态反应。PPP的主要成分是纤维蛋白原(fibrinogen)、纤维连接蛋白(fibronectin)、凝血因子Ⅷ和凝血酶(thrombin),PPP的生物学作用除了参与止血和凝血以外,还可作为细胞的附着载体[4-5]具有网络细胞的作用,同时能够促进成纤维细胞和上皮细胞的有丝分裂[6],但是,PPP在促人牙槽骨成骨细胞在病变根面上的附着、增殖方面目前还不甚明了,且在牙周再生领域的研究鲜有报道。
鉴于此,本实验探讨了PPP及根面脱矿单独和联合应用对牙槽骨成骨细胞在病变牙根面的附着和增殖的影响,为它们在牙周病治疗中促牙周再生的临床应用提供理论和实验依据。
1 材料和方法
1.1 材料
1.1.1 牙槽骨成骨细胞来源:遵义医学院附属口腔医院外科门诊提供,经患者同意,选择年龄在18至30岁因阻生埋伏而拔除的牙齿,X线显示无根尖病变、无牙槽骨吸收,收集手术中去除的牙槽骨,用于牙槽骨成骨细胞的培养。
1.1.2 牙根片来源:正常牙根片选临床上因正畸拔除的牙齿,X线显示无根尖病变、无牙槽骨吸收;病变牙根片选择临床上因重度牙周病拔除的患牙。在牙齿拔除前用铅笔沿釉牙骨质界至牙周袋底做标记,此范围为牙周病累及的根面区。拔除过程中注意不损伤根面,牙拔除后立即用生理盐水冲洗后,置于生理盐水中准备进行根片制备。
1.1.3 主要试剂与仪器:胶原酶P(Boehringer Mannheim公司,德国),胎牛血清(TBD生物技术发展中心天津),胰蛋白酶 、DMEM培养液(Sigma美国),MTT(Biomol,USA),扫描电镜(AMRAY 1 000B,美国)。
1.2 方法
1.2.1 牙槽骨成骨细胞培养:取阻生埋伏拔牙时需要去除的牙槽骨,去除牙槽骨粘骨膜后置于含胶原酶P的培养液中37℃消化2 h,采用组织块培养法,将牙槽骨组织在培养液浸润下用金冠剪剪成1 mm3左右的小块,将组织块移入25 mL的培养瓶,,加入少量的含20%小牛血清、100 μ/mL青霉素、100 μ/mL 链霉素、20 mmol/LHepes的DMEM培养液,在37℃,5%CO2和饱和湿度条件下培养。当从组织游出的细胞铺满瓶底约80%时,用0.25%的胰酶消化进行传代,利用免疫组化及碱性磷酸酶活性测试作细胞来源鉴定,至第5~8代细胞用于实验。
1.2.2 牙根片的制备:病变牙根片选门诊拟拔除的患牙周病的牙(松动Ⅲ度以上,附着丧失大于5 mm),根表面标记出牙周袋累及的范围,然后用刮治器刮净病牙根面上残留的组织,并在冷水冷却的条件下用金刚砂片将牙根磨成 4 mm×4 mm、厚1 mm(只磨除牙本质侧,牙骨质侧不磨)的根片,去离子水彻底清洗,高压蒸汽消毒后,浸于DMEM培养液中,4℃冰箱保存,48 h后待用。
1.2.3 PPP[7]的制备:PPP制作全过程严格无菌,取新鲜全血(已加入抗凝剂),离心1 300 rpm,10 min,之后用63 mm钝针头和10 mL注射器抽取淡黄色上层液,即为PPP,留存-20℃冰箱待用。
1.2.4 细胞附着:实验分组为未处理病变根片组、PPP包被病变根片组、病变根片脱矿组、PPP包被脱矿的病变根片组;用双面胶(3×3 mm2)将所有根片按实验分组固定于48孔培养板底部,每组设3个样本,紫外线照射2 h。根片脱矿处理采用24%的EDTA,pH6.7,脱矿2 min[8],PPP包被组用20 μ L的PPP处理根面。每孔等量接种第5~8代人牙槽骨成骨细胞(3×104/mL)细胞悬液 0.5 mL,再于每孔中加入含2%FBS的DMEM培养液0.5 mL,标准环境下孵育24 h,收集并计数根片上每平方毫米附着的细胞数。
1.2.5 细胞形态学观察:实验分组与方法同前,标准环境下分别培养24 h,弃去培养液,PBS冲洗2次,去除未附着细胞,扫描电镜常规样品制备,观察在不同处理组病变根面上附着的牙槽骨成骨细胞的形态。
1.2.6 细胞增殖:实验分组与方法同前,标准环境下分别培养24 h和48 h。在两个时间点,分别取出根片放入48孔板中,用200 μ L的0.25%的胰蛋白酶充分消化5 min,加入MTT(5 mg/ml)20 μ L,标准环境下继续孵育4 h,再加入150?l的二甲基亚砜(Dimethyl sulfoxide,DMSO)不断震荡15 min,用ELX800酶联免疫检测仪在λ=490 nm下读取光密度值。
2 结 果
2.1 细胞附着

图1 OB附着于病变根面(扫描电镜 1 000倍)
牙槽骨细胞在不同处理病变根面上的附着情况,见表1、图1。与未处理组相比,PPP组及根面脱矿组均能促进人牙槽骨成骨细胞对病变根面的附着(P<0.05),二者联合处理促细胞附着效果明显增强(P<0.01),PPP处理和根面脱矿处理两者比较细胞对病变根面的附着无明显差异(P>0.05),与单独经PPP处理和根面脱矿处理相比,PPP和根面脱矿联合处理促细胞附着效果明显增强(P<0.01)。

表1 牙槽骨细胞在不同处理病变根面上的附着(24 h)
2.2 细胞增殖
牙槽骨成骨细胞在不同处理病变根面上分别体外培养48 h与培养24 h增殖比较情况,见表2、图2。未处理组中人牙槽骨成骨细胞体外培养48 h与培养24 h相比,细胞在病变根片上的无增殖(P<0.05);单独PPP或脱矿处理组中人牙槽骨成骨细胞体外培养48 h与培养24h相比,细胞在病变根片上的增殖稍增加,但无统计学意义(P>0.05),PPP和根面脱矿联合处理组中细胞在病变根片上的增殖明显增加(P<0.05)。
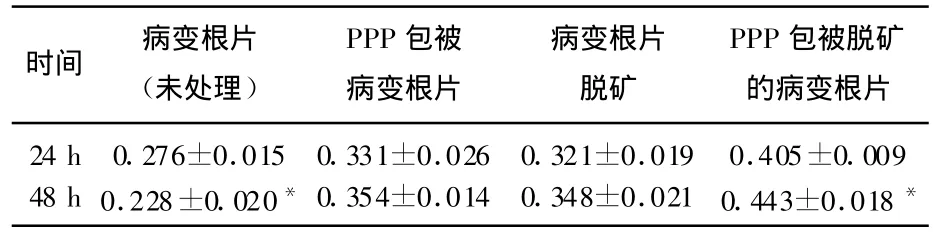
表2 在不同处理病变根面上的增殖比较(24 h和48 h)
2.3 扫描电镜观察结果
病变牙根面的蜂窝状微孔几乎被菌斑、细菌及其代谢产物所覆盖;病变根面脱矿后又恢复近似正常根面的结构特征;附着于经脱矿或(和)PPP处理后的病变根片上的细胞与根面附着紧密,并有不同程度的胞体增大、胞浆突扩展,有的伸出丝状伪足(见图1-4)。

图2 OB附着于脱矿的病变根面(扫描电镜 1 000倍)

图3 OB附着于PPP包被的病变根面(扫描电镜 1 000倍)
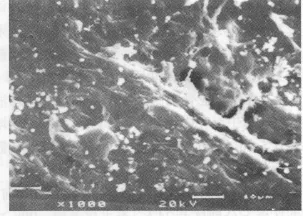
图4 OB附着于PPP包被的脱矿病变根面(扫描电镜 1 000倍)
3 讨 论
牙周组织再生过程中,细胞在牙根面这一特定结构和环境上附着和增殖是进一步发挥生物学功能的必备条件。
以往的研究证实,牙周组织病变的牙根部牙骨质内有细菌、毒素的侵入(参考文献),使得根面结构发生变化,从而不利于牙周组织细胞的附着和增殖,本实验结果也显示,未处理组牙槽骨成骨细胞的附着明显低于实验组,增殖受到抑制,电镜显示细胞在根面的生长状况也较差。而病变根面经脱矿处理后,细胞的附着增加,是因为去除了根面的玷污层,一定程度降解病变根面的内毒素,同时使一些利于细胞生长、附着的骨钙蛋白(OC)及骨涎蛋白(BSP)等非胶原蛋白得以暴露[9-11],Davenport[12]等的研究结果也证实了这一点。在经PPP处理后,PPP中的主要成分纤维蛋白原和纤维连接蛋白等作为细胞外基质的重要组成部分,发挥了网络细胞的作用,介导和促进牙槽骨成骨细胞的趋化、黏附,并对牙槽骨细胞的生长起到积极作用。尤其在经联合处理后,附着及增殖显著增加,电镜观察显示出细胞形态较丰满,突起伸展较充分,有的有伪足伸出。
随着体外细胞培养时间的延长,细胞在联合处理的病变根面增殖显著,可能因为联合处理既去除了根面玷污层、降解根面毒素,还利用PPP本身的特性将细胞吸附于根面并在其中的生物活性成分作用下促进细胞的增殖。由于本实验只检测了24 h和48 h细胞的增殖效应,其远期细胞增殖效应还有待进一步探索。
[1]Narayanan A S,Bartold P M.Biochemistry of periodontal connective tissues and their regeneration:a current perspective[J].Connective Tissue Res,1996,34(3):191.
[2]Lowenguth R A.Blieden T M.Periodontal regeneration:root surface demineralization[J].Periodontol,2000,1(1):54.
[3]Pitaru S,Melcher A H.Orgarnization of and oriented fiber system in vitro by human gingival fibroblastsattached to dental tissues:Ralationship between cells and mineralized and demineralized tissue[J].J Periodontal Res,1987,22(1):6.
[4]Matras H.Fibrin seal:the state of the art[J].J Oral Maxillofac Surg,1985,43(8):605.
[5]Schlag G,Redl H.Fibrin sealant inorthopedic surgery[J].Clin Orthop Relat Res,1988,227(2):269.
[6]Martinowitz U,Saitz R.Fibrin sealant[J].Curr Opin Hematol,1996,3:395.
[7]Gonshor A.Technique for producing platelet-rich plasma and platelet concentrate:background and process[J].Int J Periodontics Restorative Dent,2002,22(6):547.
[8]Davenport D R,M ailhot J M,Wataha J M,et al.Effect of enamel matrix protein application on the viability,proliferation,and attachment of human periodontal ligament fibroblasts to diseased root surfaces in vitro[J].J Clin Periodontol,2003,30(2):125.
[9]Mcallister B,Narayanan A S,Miki Y,et al.Isolation of a fibroblast attachment protein from cementum[J].J Periodontol Res,1990,25(2):95.
[10]Arzate H,Chimal-Monroy J,Hernandez-Lagunas L,et al.Human cementum protein extract promotes chondrogenesis and mineralization in mesenchymal cells[J].J Periodont Res,1996,31(2):144.
[11]Yonemura K,Narayanan A S,Miki Y,et al.Isolation and partial characterization of a growth factor from human cementum[J].Bone Miner,1992,18(3):187.
[12]Davenport D R,M ailhot J M,Wataha J M,et al.Effect of enamel matrix protein application on the viability,proliferation,and attachment of human periodontal ligament fibroblasts to diseased root surfaces in vitro[J].J Clin Periodontol,2003,30(2):125.
