抑郁状态下大鼠海马Notch1信号系统的改变☆
2011-09-17李元戴志萍隋毓秀
李元 戴志萍 隋毓秀
近年来抑郁症海马神经重塑障碍的发病假说颇受关注,认为抑郁症的发生发展伴随着海马神经重塑功能的障碍,而抗抑郁剂的起效与其逆转神经再生有关[1],但其中涉及的信号传导通路尚不明了。Notch信号通路在成年期动物海马区持续表达,且发挥促进神经重塑的作用。癫痫、脑缺血等疾病状态下,Notch信号系统可以通过调整自身的功能状态,调节神经干细胞的增殖,对成年期中枢神经系统的再生有重要作用[2]。在前期研究中,我们发现慢性氟西汀干预明显促进正常大鼠海马区的神经再生,同时伴随Notch1信号通路功能的增强[3]。上述研究提示Notch1信号系统可能在抑郁症海马神经重塑障碍中也发挥了作用。但国内外尚未见相关研究报道。故本研究拟以慢性不可预见的温和性应激刺激 (chronic unpredictable mild stress,CUMS)和孤养法建立抑郁模型,探讨Notch1信号系统是否参与了抑郁症神经重塑障碍。
1 材料与方法
1.1 实验动物 Sprague-Dawley(SD)成年雄性大鼠,体重在220~280 g之间。选择评分相近大鼠约54只,每组18只,随机分为 3组:CUMS14d组、CUMS28d组和对照组。前两组按下述方法建立抑郁模型,而对照组大鼠置于另一房间,每笼5只,不接受任何刺激。
1.2 抑郁模型的建立 联合应用慢性温和不可预知应激和孤养法建立抑郁模型。慢性不可预见温和应激刺激(CUMS)按 Banasr[4]方法略改进,具体包括:夹尾、倾斜鼠笼、湿垫、电击足底、冰水游泳、光照(昼夜颠倒)、禁水、行为限制。CUMS 14 d组和CUMS 28 d组分别接受14 d和28 d的随机刺激。每日采用一种刺激,同种刺激不能持续出现,且单笼饲养。
1.3 海马神经干细胞的增殖、存活和分化 采用免疫组化和免疫荧光法分别检测海马齿状回BrdU阳性细胞数。其中观察应激对海马神经干细胞增殖影响的大鼠,在应激最后1 d腹腔连续注射BrdU;观察应激对海马神经干细胞存活和分化影响的大鼠,在应激开始前腹腔注射BrdU。BrdU注射后2 h,戊巴比妥钠深度麻醉大鼠。多聚甲醛磷酸缓冲液(PBS)溶液灌注、固定、取脑,海马连续冰冻切片,片厚30 μm。BrdU免疫组化标记物:小鼠抗大鼠BrdU抗体(1∶500),生物素化的羊抗小鼠IgG(1∶500),辣根过氧化物酶复合物(1∶100),DAB 显色剂呈色,封片、镜检。BrdU/NeuN、BrdU/GFAP双标标记物:小鼠抗大鼠 BrdU抗体(1∶200),山羊抗小鼠 TRITC(1∶200),兔抗 NeuN 抗体(1∶200)或兔抗 GFAP 抗体(1∶200),山羊抗兔 FITC (1∶200)。
用Nikon CFM-500 E倒置荧光显微镜和图象分析系统进行观察与分析。采用盲法立体计数法计数海马齿状回的BrdU阳性细胞总数。每只大鼠每隔6张选取1张脑片,对海马齿状回,计数两条颗粒细胞层的内侧边界和门区的BrdU阳性细胞。在400倍和1000倍的光镜下计数,视野最边界的细胞不在计数范围内。计数每张脑切片BrdU阳性细胞数,相加后乘以6即得到每个大鼠海马齿状回的总BrdU阳性细胞数目(n=6)。免疫荧光:每只大鼠统计不少于50个BrdU阳性细胞,以双标阳性占全部BrdU细胞的比例×100来表示(n=6)。
1.4 Notch1信号系统相关基因的表达和蛋白水平采用Real time PCR和Western blot法。应激结束后第二天断头处死大鼠,快速剥离海马,机械匀浆后置于-80℃中保存备用。用Triziol法提取总RNA,然后用逆转录酶将mRNA逆转录为cDNA。构建聚合酶体系(Premier 5.0设计)及检测方法详见参考文献[3]。海马组织经蛋白质抽提试剂提取蛋白质,考马斯亮蓝法测定蛋白浓度。4℃封闭过夜,用一抗(rabbit anti-NICD,Hes1,Hes5,Jag1 and Beta-actin antibody,1∶1000,Santa Cruz)室温孵育 1h,洗膜后加入辣根过氧化物标记的二抗((anti-rabbit IgG conjugated to horseradish peroxidase,HRP,1∶5000,Santa Cruz)。ECL(增强化学发光法)显影,凝胶成像分析系统(上海天能仪器有限公司)进行扫描并记录光密度强度。蛋白水平结果以相对灰度值表示,即目的基因与内参(β-actin)灰度测量比值(n=6)。
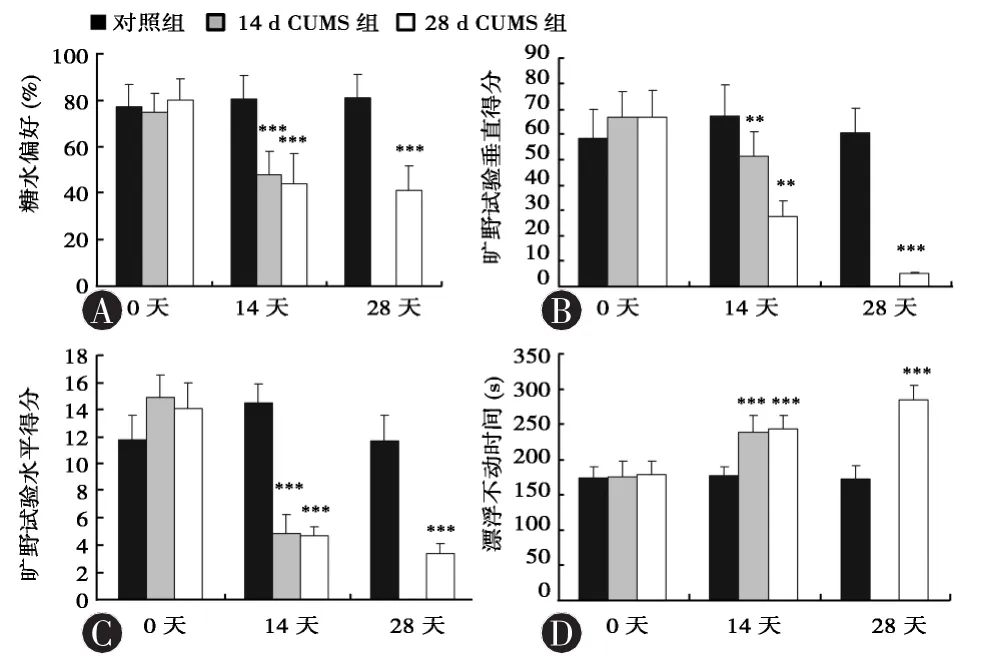
图1 慢性应激对大鼠糖水偏好、旷野水平与垂直得分、强迫游泳漂浮不动时间的影响(n=6)。与对照组比较,经方差分析,**P< 0.01,***P < 0.001。Sucrose preference:糖水偏好;Number of squares crosted:旷野试验水平得分;Number of groming and rearing:旷野试验垂直得分;Immobolity time:漂浮不动时间
1.5 统计方法 采用SPSS 11.5处理数据,数据均以±s表示。所有指标进行one-way-ANOVA分析,组间比较用Bonferroni法。
2 结果
2.1 行为学评估 应激前,各组大鼠体重、糖水偏好、旷野试验水平与垂直得分、强迫游泳漂浮不动时间无明显差异 (P>0.05)。应激 14 d时,CUMS14d组、CUMS 28d组和对照组的体重增长幅度、糖水偏好、旷野试验水平与垂直得分及大鼠漂浮不动时间的差异均有统计学意义 (F值分别为 5.22、24.60、6.08、23.45、48.78,P 均小于 0.05),其中两个模型组大鼠的前面4个指标均较对照组降低(P < 0.05),而漂浮不动时间增加(P < 0.05)。应激28 d时,与对照组相比,CUMS 28 d组大鼠的体重增长幅度、糖水偏好、旷野试验水平与垂直得分也明显降低(F值分别为4.39、42.86、32.16、22.18,P 均小于 0.05),大鼠漂浮不动时间增加,差异有统计学意义(F=185.84,P < 0.05)。见图 1。
2.2 慢性应激对海马神经干细胞增殖、存活和分化的影响 图2显示CUMS对海马神经干细胞增殖的影响,BrdU阳性细胞主要位于亚颗粒细胞层(SGZ),呈簇状,形状不一,提示正在进行有丝分裂的不成熟细胞[5]。CUMS14d 组、CUMS28d 组与对照组海马BrdU阳性细胞分别为(2254.17±164.41)、(1900.33±104.10)、(2919.50±188.80),3 组的差异有统计学意义 (F=65.50,P < 0.001);前两组均较对照组明显减少(P<0.001)。
图3显示CUMS对海马神经干细胞存活的影响,BrdU阳性细胞形状较为规整,呈圆形或椭圆形,BrdU沾染均一,单个分布在齿状回区域。与对照组相比,CUMS 28 d组BrdU阳性细胞明显减少,差异有统计学意义[(2404.50±148.77) vs(1845.33±126.88),F=49.83,P < 0.001)。
免疫荧光双标显示,与对照组相比,CUMS 28 d组 NeuN/BrdU 比例无明显差异[(71.63±10.21) vs(69.11±11.30) P > 0.05];与对照组相比,CUMS 28 d组 GFAP/BrdU 比例无明显差异[14.34±2.03)) vs(17.27±2.93),F=2.61,P > 0.05]。见图 4。
2.3 慢性应激对Notch1信号系统各因子基因表达和蛋白水平的影响 CUMS14d组、CUMS28d组和对照组3组的Notch1信号通路各因子NICDmRNA、Hes1mRNA、Hes5mRNA、Jagged1mRNA 的差异有统计学意义 (F 值分别为 151.57、165.13、21.26、156.01,P 均小于 0.01),前两组均较对照组明显减少(P < 0.01)。见表1。
如表2所示,CUMS14d组、CUMS28d组和对照组 3组的 Notch1信号通路各因子 NICD、Hes1、Hes5、Jagged1的蛋白水平差异有统计学意义(F值分别为 96.59、28.65、5.99、67.56,P 均小于 0.01),前两组均较对照组明显减少(P<0.01)。
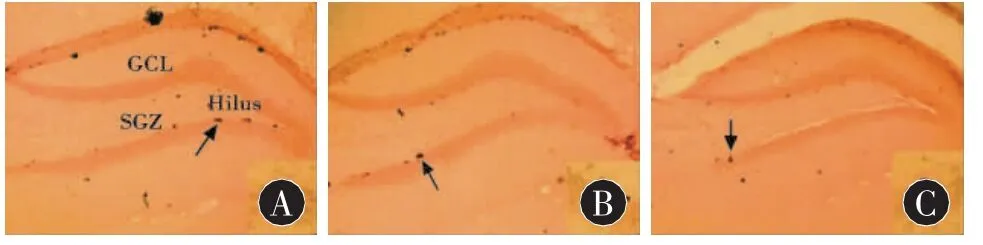
图2 慢性应激对海马齿状回神经干细胞增殖的影响(n=6)。A、B、C分别显示对照组、CUMS 14 d组和CUMS 28 d组海马BrdU阳性细胞(10×),右下角所示为图中箭头所指的呈簇状的BrdU阳性细胞在高倍镜下的图片(40 × )。SGZ:亚颗粒层,GCL:颗粒层,Hilus:门区,下图同。
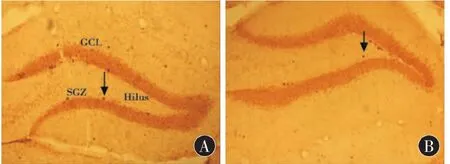
图3 慢性应激对海马齿状回神经干细胞存活的影响(n=6)。A、B分别显示经过28 d应激后对照组、CUMS 28 d组海马的存活神经干细胞(10×)。
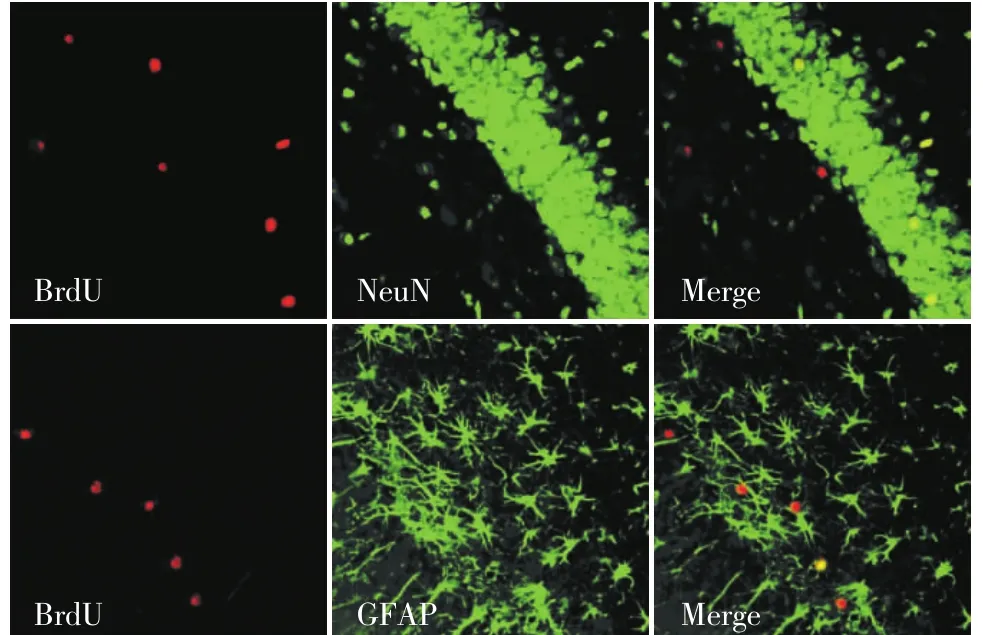
图4 海马齿状回神经干细胞的分化(BrdU/NeuN、BrdU/GFAP双标)(20× )(n=6)
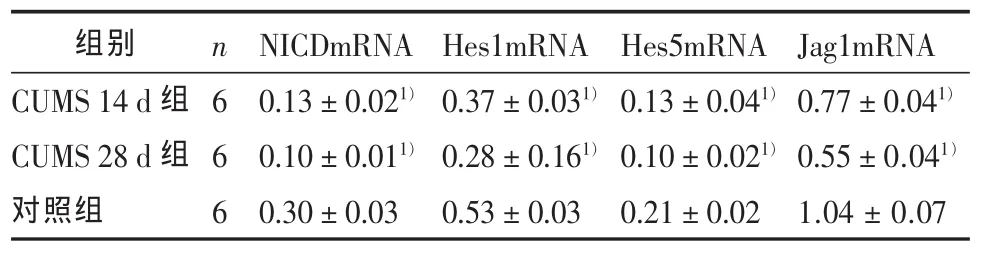
表1 慢性应激后各组大鼠Notch1信号通路各因子基因表达与对照组的比较
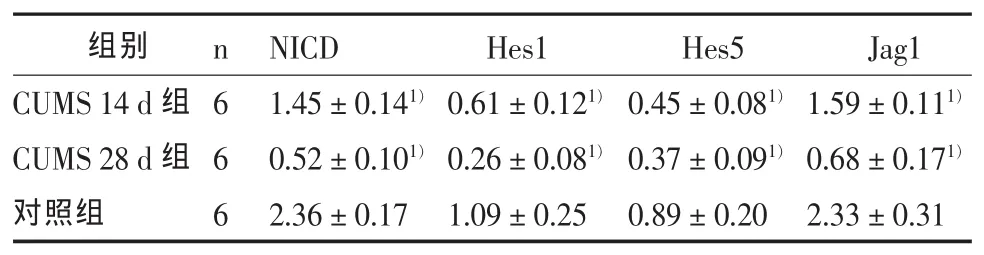
表2 慢性应激后各组大鼠Notch1信号通路各因子蛋白水平与对照组的比较
3 讨论
本研究以CUMS方法建立抑郁症模型,可比较真实、客观的在大鼠身上模拟人类的抑郁症状[6]。本研究结果显示,持续14天和28天的慢性温和不可预知的应激和孤养法均可以抑制大鼠体重的增长幅度,大鼠糖水偏好度显著降低,大鼠的总走格次数和直立活动均降低,强迫游泳漂浮不动时间均显著增加,反映出应激后大鼠的快感缺乏,活动度和对新异环境探究度降低,符合动物抑郁症状的行动迟缓、被动和懒散,及应激导致的行为绝望,表明本研究成功建立了抑郁模型。本研究设定干预14 d和28 d两个CUMS模型组,意在动态观察应激对海马神经干细胞再生和Notch信号的影响。
本研究结果显示,形态学观察显示14 d和28 d抑郁模型组大鼠的海马神经干细胞增殖减少,且海马神经干细胞存活也较对照组明显减少,表明抑郁大鼠的神经干细胞增殖和存活受到抑制;对照组与 CUMS组 NeuN/BrdU、GFAP/BrdU 无明显差异,说明应激对神经干细胞分化为神经元或神经胶质细胞无明显影响。这与目前大部分研究结果一致[7]。既往研究结果显示,抑郁状态下大鼠海马神经干细胞增殖减少[8];CUMS造摸能够较好地模拟抑郁症状,并影响海马齿状回神经发生包括增殖、分化和存活[9]。本研究对海马干细胞分化的结果进一步分析,发现BrdU阳性细胞中约70%为NeuN/BrdU阳性细胞,15%为 GFAP/BrdU阳性细胞,15%的BrdU阳性细胞未双标。可能是干细胞分化的另一亚型细胞,或是位于组织深部,抗体达不到,或是尚未分化的细胞[9]。综上所述,慢性应激干预的大鼠海马齿状回神经干细胞增殖和存活受到抑制,而对分化无明显影响,进一步在动物模型中验证了抑郁症神经重塑障碍假说,表明神经再生在抑郁症的发生中扮演重要角色。
Notch通路由 Notch受体、Notch配体 Jag1及DNA结合蛋白-CSL组成。Hes 1、Hes 5为Notch通路激活后的靶基因,NICD是Notch信号系统的胞内活性部分,我们选取NICD、Hes1、Hes5和Jag1作为检测指标,可以较为全面的反映Notch通路的功能状态。结果显示,Notch1mRNA、Hes1mRNA、Hes5mRNA表达在慢性应激14 d和28 d后均显著减少;Notch1、Hes1、Hes5蛋白水平在慢性应激 14 d和28 d后亦显著减少。Notch通路基因和蛋白水平的下降,提示应激导致Notch信号系统功能的下调,且与慢性应激降低大鼠神经发生并行存在。既往研究表明,Notch信号通路在成年期维持神经干细胞的未分化状态和自我更新中起到重要作用[10]。其中发挥关键性作用的bHLH基因有抑制型和促进型两类,前者包括HES-1、HES-3和HES-5,后者包括神经分化发育相关基因Mash-1、Math、原神经基因Ngn。当抑制型bHLH基因表达时,神经干细胞的分化被抑制。通过上调HES-1和HES-5基因的表达,抑制神经干细胞分化成为神经元和胶质细胞,从而保持神经元和神经胶质细胞合适的数目和比例。当促进型bHLH基因表达上调时,不仅可以促使神经元的生成,而且可以诱导Notch配体的表达,这些配体可以活化邻近细胞的Notch信号通路,上调其HES-1、HES-3和 HES-5的表达。从而保持其在未分化状态,从而维持神经干细胞的稳定和增殖[11]。因此,应激干预下Notch信号通路的动态变化,提示Notch1信号通路有可能与慢性应激状态下海马神经干细胞增殖和存活的调节有关。
本研究结果还显示,Notch配体(Jag1)的mRNA表达和Jag1蛋白水平在慢性应激14 d和28 d后均显著下降。研究表明,Jag1可通过作用于Notch受体和其下游效应器信号分子Shh等来促进神经干细胞的生存[12]。Jagl可诱导Shh蛋白的长期表达,海马齿状回的Shh过分表达增加海马亚颗粒区细胞的增殖和神经发生[13]。在体外,Shh还可以增加室下区细胞的增殖。因此,本研究中Jag1表达的降低与Notch信号功能下调是一致的,这与其减少神经干细胞增殖和存活的作用有关。
我们前期在体实验发现氟西汀促进正常大鼠海马神经干细胞再生的同时Notch信号功能上调[3],离体实验发现Notch信号系统可能参与氟西汀上调胎鼠海马神经干细胞增殖[14]。尽管如此,目前的研究结果尚不足以证实Notch信号通路参与抑郁大鼠海马神经重塑的调节,理想的实验是采用拮抗Notch信号的激活,观察有无神经再生和抑郁行为的好转。但由于γ泌肽酶抑制剂DAPT(Notch通路的常用阻断剂)有明显的肠道毒性,且参与体内多个信号系统的调节,DAPT的应用将造成包括痴呆样的副反应,严重干扰实验的观察[14]。因而,在体实验很难进一步验证Notch信号通路在抑郁神经重塑中的作用。
综上所述,本研究结果显示,慢性应激状态下Notch1信号通路下调的同时,海马神经干细胞的增殖、存活受到抑制。二者发生的一致性,同时结合近年来有关Notch信号通路在成年后神经再生作用的研究结果,初步提示Notch1信号系统可能与抑郁状态下海马神经重塑障碍有关。下一步本研究拟以抗抑郁剂干预抑郁模型大鼠并同时观察Notch1信号系统的改变以验证本研究假说[15],以期为探讨抑郁障碍的发病机制有所贡献。
[1]Dranovsky A,Hen R.Hippocampal neurogenesis: regulation by stress and antidepressants [J].Biol Psychiatry,2006,59(12):1136-1143.
[2]Nadel L.Down's syndrome: a genetic disorder in biobehavioral perspective[J].Genes Brain Behav,2003,2(3):156-166.
[3]Sui Y,Zhang Z,Guo Y,et al.The function of Notch1 signaling was increased in parallel with neurogenesis in rat hippocampus after chronic fluoxetine administration[J].Biol Pharm Bull,2009,32(10):1776-1782.
[4]Banasr M,Duman RS.Regulation of neurogenesis and gliogenesis by stress and antidepressant treatment [J].CNS Neurol Disord Drug Targets,2007,6(5):311-320.
[5]Gouirand AM,Matuszewich L.The effects of chronic unpredictable stress on male rats in the water maze [J].Physiology& Behavior,2005,86(1-2):21-31.
[6] 隋毓秀,张志珺,郭怡菁,等.Notch1信号系统在氟西汀上调大鼠海马神经再生中的作用[J].中国神经精神疾病杂志,2011,37(5):285-289.
[7]Warner Schmidt JL,Duman RS.Hippocampal neurogenesis:opposing effects of stress and antidepressant treatment[J].Hippocampus,2006,16(3):239-249.
[8]Lucassen PJ,Meerlo P,Naylor AS,et al.Regulation of adult neurogenesis by stress,sleep disruption,exercise and inflammation: Implications for depression and antidepressant action[J].Eur Neuropsychopharmacol,2010,20(1):1-17.
[9]Bain MJ,Dwyer SM,Rusak B.Restraint stress affects hippocampal cell proliferation differently in rats and mice[J].Neurosci Lett,2004,368(1):7-10.
[10]Yoon K,Gaiano N.Notch signaling in the mammalian central nervous system: insights from mouse mutants[J].Nat Neurosci,2005,8(6):709-715.
[11]Arumugam TV,Chan SL,Jo DG,et al.Gamma secretasemediated Notch signaling worsens brain damage and functional outcome in ischemic stroke[J].Nat Med,2006,12(6):621-623.
[12]Shimojo H,Ohtsuka T,Kageyama R.Oscillations in notch signaling regulates maintenance of neural progenitors[J].Neuron,2008,58(1):52-64.
[13]Breunig JJ,Silbereis J,Vaccarino FM,et al.Notch regulates cell fate and dendrite morphology of newborn neurons in the postnatal dentate gyrus[J].Proc Natl Acad Sci USA,2007,104(51):20558-20563.
[14]隋毓秀,张志珺,郭怡菁,等.氟西汀调控胎鼠神经干细胞增殖中Notch1通路基因表达的改变[J].东南大学学报,2010,29(5):509-513.
[15]隋毓秀,张志珺,郭怡菁,等.Notch1信号系统与抑郁模型大鼠海马神经重塑障碍[J].中华精神科杂志,2011,44:163-169.
