变形链球菌诱导牙髓细胞MMP-8 mRNA的表达及意义
2011-08-20孙淑芬张影杰姜新朋张颖丽
孙淑芬,张影杰,姜新朋,张颖丽
(1.吉林大学口腔医院牙体牙髓病科,吉林长春 130021;2.吉林大学中日联谊医院手术室)
牙髓组织是一种特殊的疏松结缔组织,当受到刺激时,会产生防御性炎症反应。近年来的研究显示基质金属蛋白酶(matrixmetalloproteinases,MMPs)在牙髓病理过程中发挥着重要的作用,也受到学者们重视[1,5,15]。MMP-8导致细胞外基质(extracellular matrix,ECM))降解,对牙髓组织的损伤存在着复杂的调节机制,但目前对MMP-8在牙髓病中的作用机制尚不清楚,进一步研究,有助于了解牙髓损伤与修复的机制,为临床治疗提供新思路。
1 材料与方法
1.1 主要仪器设备
三级生物安全防护细胞培养实验室(PⅢ),二氧化碳恒温培养箱(Thermo,USA),生物安全柜(Heal force,上海力申),倒置相差显微镜(Olympus,Japan),酶联检测仪(DO32022,华东),96孔细胞培养板(Costor,USA)),滤器(PALL,USA)。Gene Amp PCR System9600扩增仪(PERKIN-ELMER,USA)。
1.2 主要试剂
高糖DMEM培养基(Gibco,USA),胎牛血清FBS(PAA,奥地利),胰蛋白酶(Gibco,USA),EDTA(Gibco,USA),二甲基亚砜DMSO(Sigma,USA),MTT(Sigma,USA),Tris(Sigma,USA),其它为国产分析纯。
1.3 人牙髓细胞的体外培养
取因正畸或阻生拔除的健康牙齿(均无龋坏、根尖周炎及牙周炎),75%酒精消毒牙体,立即无菌条件下完整取出牙髓组织,弃根髓1/3,剪碎组织至0.5 mm3块,以含20%FBS的 DMEM 培养液,37℃、5%CO2、饱和湿度条件的培养箱中孵育。用0.25%的胰蛋白酶、0.02%EDTA的混合消化液进行传代,取4-7代细胞用于实验。
1.4 纯化变形链球菌菌株培养及其上清液提取
将变形链球菌JH1140划线接种于M-S轻唾平板培养基上,立即放入清洁厌氧罐中,取产气袋置于厌氧罐中按说明操作使厌氧罐内达到厌氧环境,37℃恒温培养48 h,用接种环将细菌接种于液体M-S轻唾培养基中,培养方法同上,37℃恒温培养24到48 h。观察试管中细菌生长情况,约48 h后肉眼可见试管壁有浅黄色菌落附着,轻微摇晃菌落不脱落为佳。
在生长良好的变形链球菌试管中取2 ml培养液,加入2.5 ml离心管中,12 000 rpm,4℃离心10 min,吸取上清液1.5 ml,0.22 μ m滤器抽滤灭菌4℃保存。
1.5 变形链球菌刺激牙髓细胞
取过滤获得的变链上清液按1∶50比例稀释后,加入到10%FBS的DMEM培养液中,配置成变形链球菌刺激组细胞培养液。取生长良好的牙髓细胞(细胞爬满培养瓶底壁80%以上)20瓶,加入刺激组细胞培养液,每4 d换液一次,连续培养8 d后用于实验;正常牙髓细胞作为对照。
1.6 PCR检测变形链球菌对牙髓细胞MMP-8 mRNA

表1 引物设计表
采用Oligo 6.0设计引物序列,由赛百盛公司合成。反应条件:预变性94℃,2 min;以下经过35个循环过程:变性 94℃,30 s,退火56℃,30 s,延伸72℃,60 s;再延伸 72℃,10 min,4℃保温。取 5 μ l PCR产物加1 μ l 6×loading Buffer,移液器抽打混匀,在1%琼脂糖凝胶上电泳120 V,25 min,凝胶成像系统照相观察。
2 结果
2.1 RNA提取结果
牙髓细胞总RNA提取效果较好,呈清晰的28 S,18 S和5 S三条带,其中28 S的亮度约为18 S的2倍,RNA无明显降解、无明显的DNA污染。
2.2 PCR产物
在退火温度56℃时,正常组牙髓细胞mRNA逆转录PCR,产物电泳无明显条带,MMP-8 mRNA未见表达;变形链球菌刺激组牙髓细胞mRNA逆转录PCR后,产物电泳显示在Marker标记540 bp附近处有一清晰条带,与预期片段大小一致。符合MMP-8引物设计片段大小,MMP-8 mRNA表达量增强。
3 讨论
3.1 细菌对牙髓细胞合成MMPs的影响
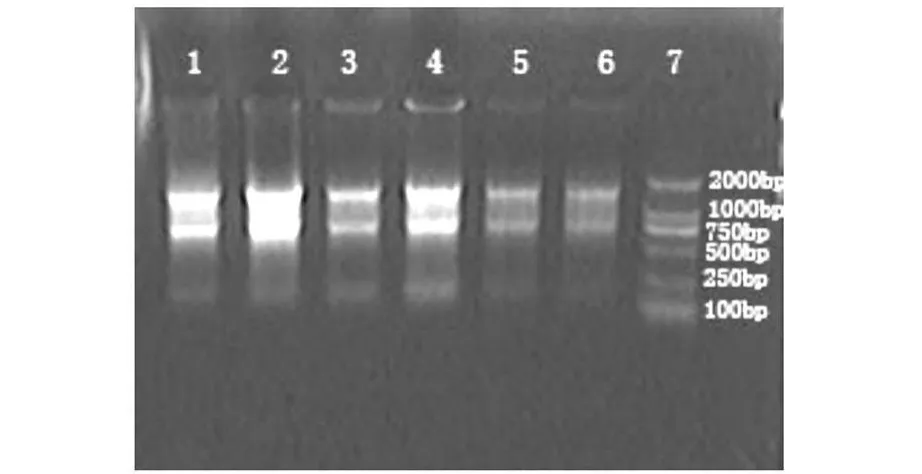
图1 牙髓细胞总RNA提取结果
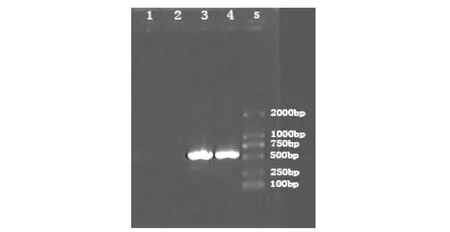
图2 牙髓细胞mRNA MMP-8 RT-PCR结果
牙髓炎多由口腔混合细菌的混合毒力所致,厌氧菌是感染牙髓的优势菌,细菌成分的增多,可刺激多种炎症细胞产生细胞因子,进而促进牙髓细胞合成MMPs增加。Chang等在研究产黑色素类杆菌对人牙髓细胞合成MMPs的影响时,将牙龈卟啉单胞菌和牙髓卟啉单胞菌培养后经离心提取其上清液加入到人牙髓细胞培养液中,混合培养8天后,凝胶酶谱分析发现,牙髓细胞合成的MMP-2明显增多[2]。Nakata等研究中间普氏菌,具核梭杆菌,牙髓卟啉单胞菌和牙髓卟啉单胞菌培对体外人牙髓细胞合成MMPs的影响时发现细菌超声提取物可以促进牙髓细胞合成MMP-1、MMP-2增多[3]。Tjaderhane等研究认为细菌产酸可以激活MMPs[4]。由此可见,厌氧菌的侵入提高了牙髓细胞对ECM的降解活性,细菌导致牙髓病变可能开始于MMPs的作用。但由于早期牙髓炎细菌主要经龋坏后变薄的牙本质层中的牙本质小管侵入牙髓腔,而侵入牙本质小管中的主要菌种为致龋菌—变形链球菌,有研究显示早期牙髓炎中检测出的主要菌为变形链球菌[5,6]。因此本实验借鉴上述学者方法,采用变形链球菌上清液与DMEM混合培养液培养牙髓细胞,以细菌代谢产物快速诱导体外培养人牙髓细胞,实验性模拟牙髓细胞损伤状态的方法,结果显示细菌代谢产物刺激牙髓细胞8d,细胞形态未见明显改变,开始出现散在脱壁现象。证实细菌成分在牙髓病发生发展中起一定作用,致病菌的定居除了通过释放蛋白酶直接降解ECM外,还可以通过其他不同的途径导致组织损伤,如MMPs途径、纤溶酶原依赖性途径、吞噬细胞途径、PMN-丝氨酸蛋白酶途径、破骨细胞吸收途径。其中MMPs途径是牙髓组织ECM降解的主要途径。
3.2 牙髓细胞中MMP-8 mRNA的表达及意义
牙髓炎中MMPs的异常增多将导致细胞外的基质合成与代谢失衡,使得病变发展,成恶性循环,最终导致牙髓坏死及根尖周病变。在牙髓组织中,牙髓细胞、成牙本质细胞是MMPs的主要合成细胞,其中牙髓细胞可产生大部分MMPs,到目前为止所发现的 MMPs 有:MMP-2、MMP-3、MMP-8、MMP-9、MT1-MMP和MMP-20[8]。蛋白溶解酶的存在是细胞外基质降解的必备条件,这些酶根据靶分子的不同可分为三类:丝氨酸蛋白酶,半胱氨酸蛋白酶以及MMPs[9]。Creemers等研究酶在牙髓组织ECM降解中作用时发现,胶原的降解主要依赖于MMPs,其次为半胱氨酸蛋白酶[10]。生理条件下,MMPs的水平较低,其与TIMPs的平衡维持着牙髓组织的健康。弹性蛋白酶、胶原酶活性的增强是化脓性牙髓炎以及牙髓坏死的组织化学特点[11]。牙髓炎中MMPs异常增多将导致细胞外的基质合成与代谢平衡的打破[12、13、14],使得病变发展,呈恶性循环。ECM 是正常细胞维持生存运动和分化的适宜环境,它可影响细胞的形态、控制细胞的迁移、调控细胞的增殖和诱导细胞的分化[7,15]。ECM的及时降解对于胚胎发育、形态发生组织的吸收和改建是必不可少的。正常ECM的降解将导致组织失去供给而坏死。MMPs及金属蛋白酶组织抑制剂(tissue inhibitor of metal-oproteinases,TIMPs)共同调控ECM,维持细胞的稳定性。调控机制的不平衡会使ECM过度降解导致一系列疾病,如肿瘤的侵入及扩散转移、关节炎、牙周炎、牙髓炎等。本实验结果显示体外牙髓细胞经细菌上清液刺激8d后,正常组未见MMP-8 mRNA表达,刺激组表达明显,表达的差异说明MMP-8是牙髓炎症过程中重要的活动因子之一,进一步显示MMP-8在牙髓炎中参与了牙髓组织ECM的降解。牙髓炎症期,牙髓组织中ECM降解是组织发生不可逆性损伤的重要因素之一,是MMPs对细胞外基质降解的主要因素,MMP-8在牙髓组织细胞外基质代谢过程中,特别是在I型胶原的降解过程中发挥着关键性作用,而I型胶原蛋白又是牙髓细胞中主要的细胞外基质成份之一,所以对于MMP-8的研究为牙髓病的治疗奠定了一定的基础。基质金属蛋白酶在牙髓组织细胞外基质代谢过程中发挥着关键性作用。因此,寻找有效的MMPs抑制剂可为攻克牙髓病开辟了一条新的途径。
[1]Hannas A R,Pereira J C,Granjeiro J M,et al.The role of matrixmetalloproteinases in the oral environment[J].Acta Odontol Scand,2007,65(1):1.
[2]Chang YC,Lai CC,Yang SF,et al.Stimulation of matrix metalloproteinases by black-pigmented Bacteroides in human pulp and periodontal ligament cell cultures[J].J Endod,2002,28(2):90.
[3]Nakata K,Yamasaki M,Iwata T,et al.Anaerobic bacterial extracts influence production of matrix metalloproteinases and theirinhibitors by human dental pulp cells[J].J Endod,2000,26(7):410.
[4]TervahartialaT,PirilaE,CeponisA,et al.The in vivo expression of the collagenolytic matrix metalloproteinases(MMP-2,-8,-13,and 14)and matrilys in(MMP-7)in a dult and localized juvenile periodontitis[J].J Dent Res,2000,79(12):1969.
[5]G oncalves LD,Oliveira G,Hurtado PA,et al1 Expression of metalloproteinases and their tissue inhibitors in inflamed gingival biops ies[J].J Periodont Res,2008,43(5):570.
[6]樊明文主编.牙体牙髓病学[M].第3版.北京:人民卫生出版社,2008:149-158.
[7]Jie Bao G,Kari K,Tervahartiala T,et al.Proteolytic activities of oral bacteria on ProMMP-9 and the effect of synthetic proteinase inhibitors[J].Open Dent J,2008,2:96.
[8]Lin SK,Kuo MY,Wang JS,et al.Differential regulation of interleukin-6 and inducible cyclooxygenase gene expression by cytokines through prostaglandin-dependent and-independent mechanisms in human dental pulp fibroblasts[J].J Endod,2002,28(3):197.
[9]Dorothe Burggraf,Doxycycline inhibits MMPs via modulation of plasminogen activators in focal cerebral ischemia[J].Neurobiology of Disease,2007,25:506.
[10]Creemers LB,Jansen ID,Docherty AJ,et al.Gelatinase A(MMP-2)and cysteine proteinases are essential for the degradation of collagen in soft connective tissue[J].Mat rix Biol,1998,17(1):35.
[11]Morand MA,SchilderH,Blondin J,et al.Collagenolytic and elastinolytic activities from diseased human dental pulps[J].J Endod,1981,17(4):156.
[12]Gusman H,Santana RB,Zehnder M.Matrix metalloproteinase levels and gelatinolytic activity in clinically healthy and inflamed humandental pulp[J].Eur J Oral Sci,2002,110(5):353.
[13]lture method:The expression of collagen and matrix metalloproteinases(MMPs)[J].Adv Dent Res,2001,15(8):55.
[14]Shin SJ,Lee J I,Baek SH,et al.Tissue levels of matrix metalloproteinases in pulps and periapical lesions[J].J Endod,2002,28(4):313.
[15]Bildt MM,Bloemen M,Kuijpers-Jagtman AM,et al1 Matrix metal2loproteinase inhibitors reduce collagen gel contraction and alphasmooth muscle actin expression by periodontal ligament cells[J].J Periodontal Res,2009,44(2):266.
