回肠间置术对Ⅱ型糖尿病大鼠血糖影响的实验研究
2011-08-20白军伟王新杰贺永刚尹家俊
郑 伟,武 波,白军伟,尹 敏,王新杰,贺永刚,尹家俊
(大连大学附属中山医院,辽宁大连 116001)
胃旁路术(Roux-en-Y gastric bypass,GBP)和胆胰转流术(biliopancreatic diversion,BPD)等胃肠道重建类减肥手术,在减轻患者体重的同时,对伴2型糖尿病的患者还具有明显改善其糖耐量及胰岛素抵抗的作用[1]。其他减肥手术未见明显的降糖效果,这两种手术最大的共同点是胃肠道重建,通过旷置十二指肠和近端空肠和(或)过早的刺激末段回肠,从而实现降血糖的作用,即“前肠假说”和“后肠假说”[2],但究竟是哪种机制起着更为关键的作用,目前尚不完全清楚,本研究利用一种新的手术方式-回肠间置术(Ilesl transposition IT)[3],将一定长度的末端回肠前移至上段空肠,以实现食物过早刺激末段回肠,从而观察“后肠假说”对链脲佐菌素(STZ)诱导的非肥胖2型糖尿病大鼠的降糖效果,并初步探讨其机制。
1 材料与方法
1.1 实验动物和材料清洁级6周龄雄性SD大鼠35只,体重160-180 g/只,大连医科大学动物实验中心提供,饲养于大连大学附属中山医院中心实验室。STZ(美国sigma公司)、拜安捷血糖仪(美国拜耳公司)、大鼠胰高血糖素肽-1(GLP-1)酶联免疫分析ELISA试剂盒(瑞典Mercodia公司)。
1.2 Ⅱ型糖尿病大鼠模型的制备[4]取35只6周龄SD大鼠高糖高脂饲料喂养4周后,大鼠禁食12小时,按40 mg/kg体重腹腔注射1%的STZ溶液(PH4.2 0.1mol/l的柠檬酸钠-柠檬酸缓冲液),48小时后用快速血糖仪测大鼠尾静脉血糖≥16.7 mmol/l,稳定5天为造模成功,共有30只大鼠成模。
1.3 动物分组将30只成模SD大鼠随机分为手术组(IT组)、假手术组(S-IT组)、对照组(C组),每组10只,术前各组大鼠体重、空腹血糖、GLP-1差异无统计学意义。
1.4 手术方式IT组行回肠间置术:大鼠禁食不禁水12 h,1%戊巴比妥钠(50 mg/kg)腹腔内注射麻醉,上腹正中长约3 cm切开进腹,分离盲肠,距离回盲瓣5 cm和15 cm处分别横断回肠,取出一段长10 cm的末段回肠,保留其完整的神经及血管,将其保存于生理盐水中,间断缝合两断端;在距离十二指肠悬韧带下5 cm处横断空肠,并将这段旷置的末段回肠按其肠管蠕动的方向分别行空肠-回肠、回肠-空肠端端吻合,均采用0/7号无创丝线间断缝合,缝合系膜裂孔。S-IT组,用上述同样的方法进行麻醉,采取与IT组相同部位切断肠管,并做原位吻合,保证相同麻醉时间,术终均用庆大霉素(96万U)2 ml冲洗腹腔后关腹,术后12小时后自由进水,24小时后自由进食,保证充足饮水。
1.5 实验方法分别于术前、术后第1、2、4、8周5个时间点,测空腹与灌服葡萄糖30 min后的血糖、胰岛素和GLP-1,术后2周每两天,2周后每周测1次体重。大鼠禁食过夜,眶静脉取血1 ml,灌服20%葡萄糖(1 g/kg体重)30 min后再取血1 ml,静置30 min后4 000 r/m 离心10 min,分离血清,-70℃冻存;血糖由快速血糖仪测定,GLP-1应用大鼠酶联免疫分析ELISA试剂盒测定。
1.6 统计学方法实验数据以均数±标准差(¯x±s)表示,各组间检测值比较采用t检验和方差分析,P<0.05为差异有统计学意义。采用SPSS 13.0 for windows统计学软件进行统计分析。
2 结果
各组大鼠术前体重、血糖和GLP-1差异均无统计学意义(表1)。

表1 术前各组大鼠体重、血糖及GLP-1
2.1 体重变化术后第1周与C组相比,IT组、S-IT组体重均有明显下降(P<0.01),术后第2周期体重开始回升(P<0.05),术后第4周至实验结束各组大鼠体重均无统计学意义(表2)。

表2 各组大鼠体重变化
2.2 血糖与术前相比,IT组大鼠术后第1周空腹及餐后血糖已开始下降,第2周空腹及餐后血糖由(18.96±1.13)、(31.82±2.33)mmol/L分别下降至(14.45±17.6)、(26.52±1.20)mmol/L,差异具有统计学意义(P<0.05),术后第8周空腹及餐后血糖分别下降至(6.73±1.78)、(12.46±2.54)mmol/L,差异性具有显著的统计学意义(P<0.01),术后第4、8周 IT组血糖明显低于同一时间点S-IT组和C组各大鼠血糖值,差异具有显著统计学意义(P<0.01),整个实验过程中S-IT组和C组大鼠血糖值无明显差异(表3)。
表3 各组大鼠血糖值及变化(mmol/L,±s)
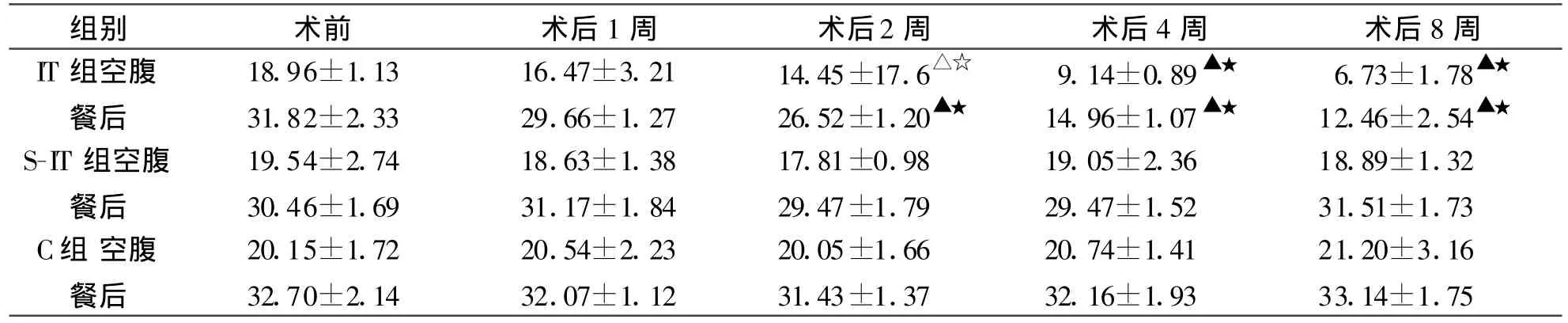
表3 各组大鼠血糖值及变化(mmol/L,±s)
注:同一时间点组间比较,△P<0.05,▲P<0.01,与术前比较,☆P<0.05,★P<0.01。
组别 术前 术后1周 术后2周 术后4周 术后8周IT组空腹 18.96±1.13 16.47±3.21 14.45±17.6△☆ 9.14±0.89▲★ 6.73±1.78▲★餐后 31.82±2.33 29.66±1.27 26.52±1.20▲★ 14.96±1.07▲★ 12.46±2.54▲★S-IT组空腹 19.54±2.74 18.63±1.38 17.81±0.98 19.05±2.36 18.89±1.32餐后 30.46±1.69 31.17±1.84 29.47±1.79 29.47±1.52 31.51±1.73 C组 空腹 20.15±1.72 20.54±2.23 20.05±1.66 20.74±1.41 21.20±3.16餐后 32.70±2.14 32.07±1.12 31.43±1.37 32.16±1.93 33.14±1.75
2.3 GLP-1IT组大鼠空腹GLP-1术后第1周开始上升,灌胃后30分钟升高更为明显,由术前的(21.50±1.68)pmol/L上升到(42.72±2.06)pmol/L差异有统计学意义(P<0.01),至术后第8周空腹及餐后GLP-1值分别上升到(24.23±1.75)、(89.74±2.96)pmol/L,差异有显著的统计学意义(P<0.01),术后第2周至实验结束,IT组GLP-1值均明显高于相同时间点S-IT组和C组,差异均有显著统计学意义(P<0.01,表4)。
表4 各组大鼠GLP-1值及比较(pmol/L±s)
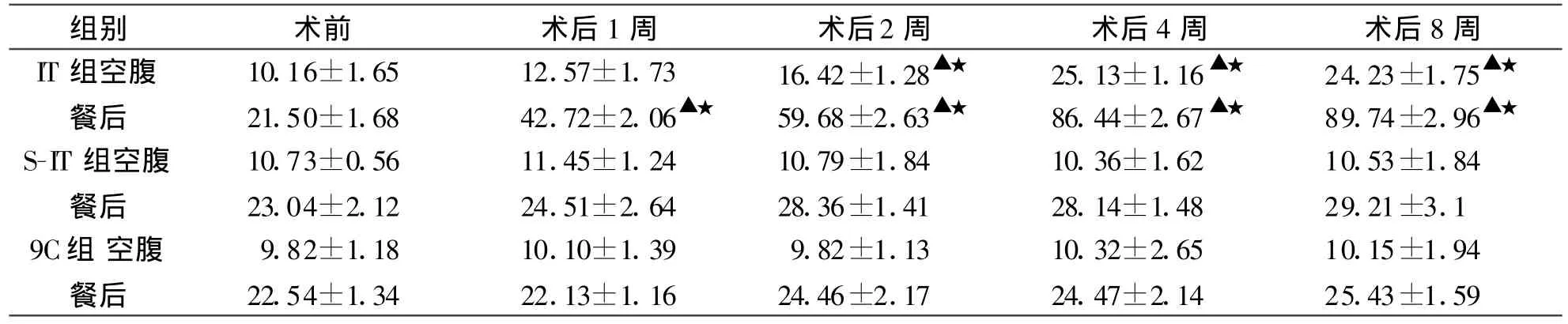
表4 各组大鼠GLP-1值及比较(pmol/L±s)
注:同一时间点组间比较,△P<0.05,▲P<0.01,与术前比较,☆P<0.05,★P<0.01。
组别 术前 术后1周 术后2周 术后4周 术后8周IT组空腹 10.16±1.65 12.57±1.73 16.42±1.28▲★ 25.13±1.16▲★ 24.23±1.75▲★餐后 21.50±1.68 42.72±2.06▲★ 59.68±2.63▲★ 86.44±2.67▲★ 89.74±2.96▲★S-IT组空腹 10.73±0.56 11.45±1.24 10.79±1.84 10.36±1.62 10.53±1.84餐后 23.04±2.12 24.51±2.64 28.36±1.41 28.14±1.48 29.21±3.1 9C组 空腹 9.82±1.18 10.10±1.39 9.82±1.13 10.32±2.65 10.15±1.94餐后 22.54±1.34 22.13±1.16 24.46±2.17 24.47±2.14 25.43±1.59
3 讨论
1995年Pories[5]等对减肥手术的回顾性调查中意外的发现,手术在减轻患者体重的同时对伴有2型糖尿病患者的血糖也有显著的改善作用,从而开启了手术治疗糖尿病的大门。并提出这可能跟手术改变胃肠道结构有关,通过避免食物对十二指肠和近段空肠的过度刺激,及食糜过早的刺激末段回肠,引起肠道激素分泌的改变,从而改善糖尿病患者的糖耐量及胰岛素抵抗,但其机制目前尚不清楚。
经过近十年的临床观察和实验性研究发现,最有效的治疗肥胖症和2型糖尿病的手术方式GBP和BPD术后血糖改善的同时,血清GLP-1也有显著的升高。GLP-1(胰高血糖素样肽-1)由末段回肠黏膜上皮L细胞分泌,能促进糖原合成及脂肪分解,抑制胃排空,抑制胰高血糖素分泌,增加胰岛素的基因表达和胰岛素前提的合成,促进β细胞增殖与抑制其凋亡[6]。另外,GLP-1还有降低食欲的作用,人体注射GLP-1可引起摄食减少[7]。目前认为GLP-1是肠-胰岛轴中控制2型糖尿病最核心的介导因子[8]。术后GLP-1水平升高可能是未完全消化的食糜直接到达末段回肠刺激肠壁L细胞分泌所致,这种变化有助于降低糖尿病患者的血糖,改善胰岛B细胞功能[9]。
本实验利用一种“纯”回肠刺激模型-回肠间置术(IT)[10],仅实验食物对末段回肠过早的刺激,而未减少胃容积和十二指肠的旷置,从而观察术后体重、血糖、GLP-1的变化。术后IT组大鼠血糖显著降低的同时,体重也有略微的降低,但与S-IT组大鼠相比体重变化无显著差异性,术后第4周起直至实验结束各组大鼠体重均无明显差异,显示IT控制糖尿病血糖的作用与体重变化无关。术后IT组大鼠血糖降低的同时,血清GLP-1值也出现显著的升高,餐后GLP-1升高的更为明显,表明末段回肠及其黏膜上皮L细胞对于手术治疗糖尿病起着至关重要的作用,并进一步验证了“后肠假说”的可靠性。
[1]Buchwald H,Avidor Y,Braunwald E,et al.Bariatric surgery:a systematic review and meta-analysis[J].Jama,2004,292:1724.
[2]Mason E E.Ileal[correction of ilial]transposition and enteroglucagon/GLP-1 in obesity(and diabetic?)surgery[J].Obes Surg,1999,9(3):223.
[3]Koopmans HS,Ferri GL,Sarson DL,et al.The effects of ileal transposition and jejunoileal bypass on food intake and GI hormone levels in rats[J].Physiol Behav,1984,33:601.
[4]Mu SN,Gao Yun,Wang FS,et al.Rat model of type 2 diabetes induced by streptozotocin and high-carbonhydrate fat-Diet[J].Chin J Comp Med,2008,18(2):19.
[5]Pories WJ,Swanson MS,MacDonaldKG,et al.Who would have thought it?Anoperation proves to be the most effective therapy foradult-onset diabetes mellitus[J].Ann Surg,1995,222:339.
[6]Patriti A,Aisa MC,Annetti C,et al.How the hindgut can cure type 2 diabetes.Ileal transposition improves glucose metabolism and beta-cell function in Goto-kakizaki rats through an enhanced Proglucagon gene expression and L-cell number[J].Surgery,2007,142(1):74.
[7]Simon A.Gastrointestinal surgery and gut hormones[J].Current Opinion in Endocrinology&Diabetes,2005,12:89.
[8]Cummings DE,Overduin J,Foser-Schubert KE.Gastric bypass forobestity:Meganisms of weight loss and diabetes resolution[J].J ClinEndocri&Metab,2004,89(6):2608.
[9]John B,Dixon,Walter J,et al.Surgery as an Effective Early Intervention for Diabesity[J].Diabetes care,2005,28(2):472.
[10]Strader AD.Ileal transposition provides insight into the effectiveness of gastric bypass surgery[J].Physiol Behav,2006,88:277.
