依托泊苷固体脂质纳米粒的研制
2011-08-07赵向男佳木斯大学药学院黑龙江省高校生物药制剂重点实验室佳木斯市154007
于 莲,赵向男,崔 丹,杜 妍(佳木斯大学药学院黑龙江省高校生物药制剂重点实验室,佳木斯市 154007)
肺癌是全球范围内发病率和死亡率最高的恶性肿瘤,严重威胁人类的生命。依托泊苷(Etoposide,ET)为鬼臼毒素的糖代谢产物,具有广谱抗癌活性,尤其对早期扩散、预后恶劣的小细胞肺癌效果良好。改变剂型、提高已有抗癌药的疗效、降低其毒副作用,已成当务之急。固体脂质纳米粒(Solid lipid nanoparticles,SLN)的研究起始于20世纪90年代,是新型的亚微给药系统,其不但可以促进药物吸收、减少药物毒性,而且还有控释、靶向的功能[1]。本试验将ET制成SLN,以期通过缓释作用提高药物的疗效。
1 仪器与试药
JY92-2D型超声波细胞破碎机(宁波新芝生物科技股份有限公司);JB-2型恒温磁力搅拌器(上海雷磁仪器厂);Zetasizer 3000 HS纳米粒度及表面电位分析仪(英国Malvern公司);JEM-1200Ex透射电镜(日本电子公司);1100型高效液相色谱仪(美国安捷伦公司);LE-80K型超高速冷冻离心机(美国Beckman公司)。
ET原料药及对照品(淄博磐信医药化工有限公司,批号:PX20091105,含量:99.4%);ET-SLN(佳木斯大学药学院自制,批号:20100315,含量:12.4%);单硬脂酸甘油酯(天津市博迪化工有限公司);大豆磷脂(上海金伴药业有限公司);泊洛沙姆(型号:188,德国BASF公司)。
2 方法与结果
2.1 ET-SLN制备
采用乳化-超声分散法制备。称取处方量单硬脂酸甘油酯(脂质材料)与ET混匀,加热70℃熔融,作为油相。将大豆磷脂、泊洛沙姆作为复配乳化剂加入10 mL重蒸馏水溶解,迅速加热至相同温度作为水相。在磁力搅拌下将油相滴加到同温度水相中制备成初乳[2],继续搅拌同时加入冷水(4℃)至20 mL。超声波细胞破碎机600 W超声10 min,冷却至室温,得ET-SLN分散液,用0.45µm微孔滤膜过滤得ET-SLN胶体分散液,同法制备不含药物的SLN分散液,作为空白对照。
2.2 正交试验筛选ET-SLN最优处方
通过前期单因素考察结果得知,脂质材料和乳化剂的用量对ET-SLN的包封率有较大的影响。分别以单硬脂酸甘油酯、大豆磷脂、泊洛沙姆、ET的处方用量为A、B、C、D 4个因素,每个因素设3个水平,采用L9(34)正交设计表,以包封率(EE/%,包封率=(c总投药量-c上清液)/c总投药量×100%)为评价指标进行正交试验,结果见表1、表2、表3。
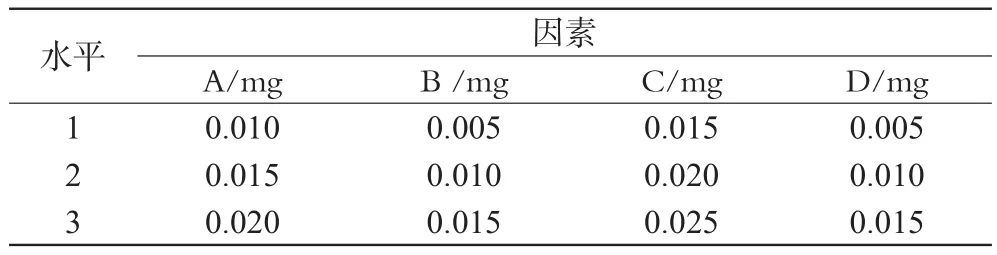
表1 因素水平表Tab 1 Factors and levels
Rj的值越大,说明该因素影响越明显;由此可知,各因素影响的主次顺序是B>A>D>C,由表2得出的最优化处方为第8号处方,即A3B2C1D3,单硬脂酸甘油酯、大豆磷脂、泊洛沙姆、ET的处方用量分别为0.020、0.010、0.015、0.015 mg,该处方制得ET-SLN包封率较高,选取最优处方按“2.1”项下方法制备3批,计算包封率结果见表4。
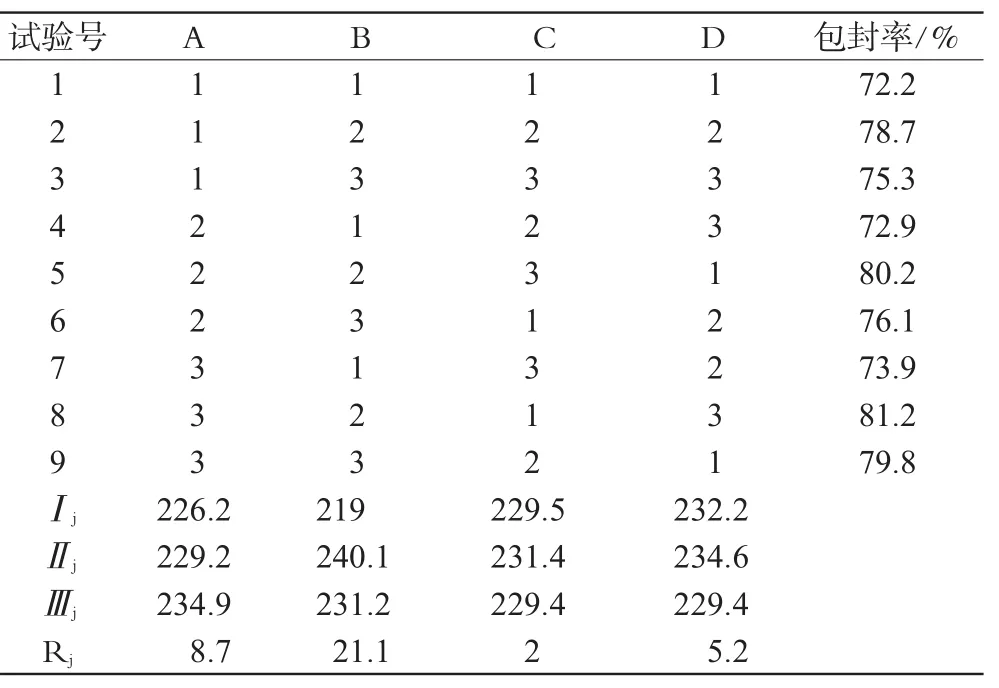
表2 正交试验结果Tab 2 Results of orthogonal test
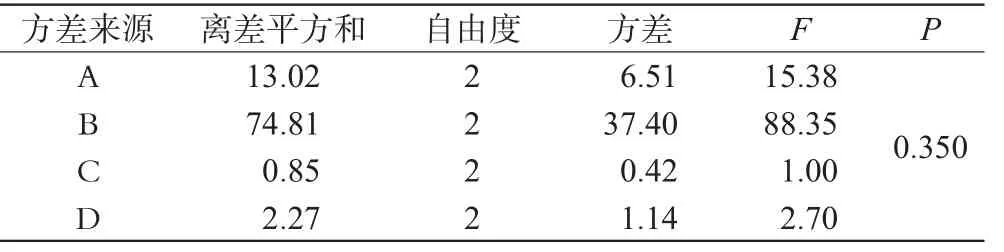
表3 方差分析结果Tab 3 Variance analysis

表4 3批ET-SLN包封率测定结果Tab 4 Encapsulate coefficiency of 3 batches of ET-SLN
2.3 ET-SLN形态、粒径、表面电位的测定
纳米粒体系用水稀释20倍,吸取2滴,用2%磷钨酸钠负染,以透射电镜观察其形态及分布,结果见图1;以激光粒度分析仪测定粒径和粒度分布,结果见图2。
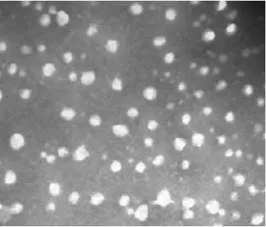
图1 ET-SLN透射电镜图(×105)Fig 1 TEM of ET-SLN(×105)
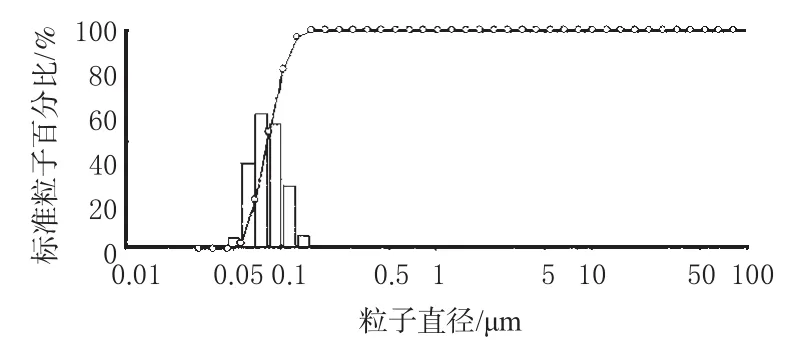
图2 ET-SLN粒径分布Fig 2 Distribution of particle size of ET-SLN
由图1可见,制得的ET-SLN形态较圆整,大小较均一,基本为类球形的实体粒子。ET-SLN平均粒径(83±0.5)nm、粒度分布窄。
以表面电位分析仪测定Zeta电位,结果为(-23±0.3)mV,属热力学稳定体系[3]。本研究制得的纳米粒表面带有负电荷,可以与带正电荷的药物作用,从而得到高包封率的载药纳米粒。
2.4 包封率和载药量的测定
2.4.1 含量测定
(1)色谱条件:色谱柱为Diamonsil C18(250 mm×4.6 mm,5 μm);流动相为甲醇-水-乙腈=30∶50 ∶20;检测波长为285 nm;流速为0.7 mL·min-1;柱温为30 ℃;进样量为20 μL。
(2)溶液制备及系统适用性试验:对照品溶液:精密量取ET对照品贮备液(500 μg·mL-1)1 mL置于10 mL容量瓶中,用流动相稀释,定容,制得50 μg·mL-1的对照品溶液进样。供试品溶液和空白溶液:精密量取ET-SLN或空白SLN 0.5 mL置于10 mL容量瓶中,用甲醇定容;精密量取上述溶液1 mL置于10 mL容量瓶中,加流动相定容即得。进样后,3种溶液色谱结果见图3。
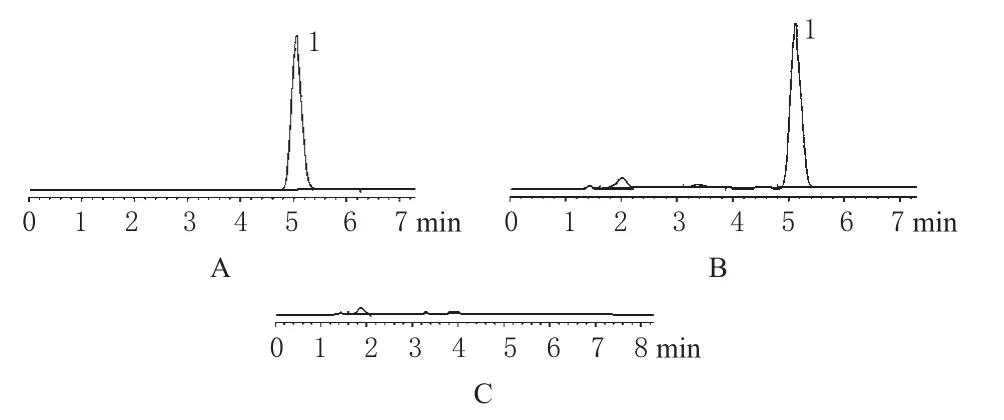
图3 高效液相色谱图Fig 3 HPLC chromatograms
(3)线性范围及方法学考察:精密称取ET对照品适量,用流动相溶解并稀释成浓度为50 μg·mL-1溶液。分别精密量取上述溶液2.0、3.0、4.0、5.0、6.0、7.0 mL置于10 mL容量瓶中,流动相定容后进样。以峰面积(A)对浓度(c,mg·mL-1)作图,绘制标准曲线,得回归方程A=41.368c+383.06(r=0.999 3),ET检测浓度线性范围为0.01~0.035 mg·mL-1;平均回收率为98.8%(RSD为0.77%,n=9);精密度试验中RSD为0.67%(n=6)。
2.4.2 包封率和载药量测定方法
采用低温超速离心法。精密移取纳米粒1 mL,然后超速离心(30 000 r·min-1)30 min,上清液稀释后用高效液相色谱法测定,计算药物包封率和载药量(载药量=(c总投药量-c上清液)/c纳米粒×100%)。结果,3批ET-SLN包封率平均为81.2%,平均载药量为12.4%。
2.5 体外释放试验
采用动态透析袋法考察体外释放情况,根据《中国药典》2010年版二部附录释放度测定法[4]进行。ET在37℃时,其在磷酸盐缓冲液(PBS,pH7.4)中饱和溶解度仅为145~150 mg·L-1。移取2 mL的ET-SLN分散液置于截留分子量为14 000的透析袋中,两端夹紧,置于装有PBS 50 mL的锥形瓶中,在(37±0.5)℃恒温水浴振荡器中,分别于0.5、1、2、4、6、8、10、12、24、48 h将介质全部取出(同时补加50 mL空白释放介质),过0.22 μm微孔滤膜,测定药物含量,计算累积释药率,绘制体外释药曲线,详见图4。
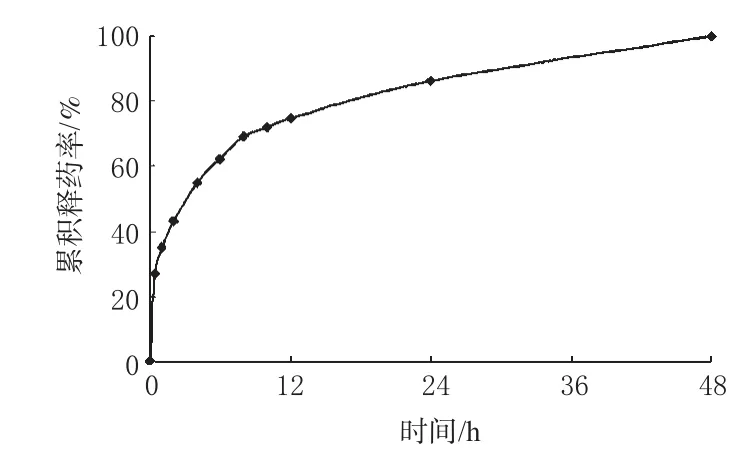
图4 ET-SLN体外释药曲线Fig 4 Drug release profile of ET-SLN
由图4可知,ET-SLN在最初的2 h,释放了药物总量的40%左右;随后,结合在脂质纳米粒骨架中的药物呈相对缓慢的速度释放,可持续48 h。
3 讨论
采用乳化-超声分散法制备ET-SLN操作简单、易于控制,仪器价格低廉、成本低,比较适合实验室操作。
以生理相容的、可生物降解的单硬脂酸甘油酯作为脂质材料制备的SLN的粒径较小且分布均匀;以大豆磷脂和泊洛沙姆(188)作复合乳化剂时,可以提高SLN表面的亲水性、增大空间位阻及调整电位,延长SLN在体内的循环时间,不但能够有效地降低粒径,而且制得的纳米粒稳定性较好。
体外释药时,在2 h内,药物分子可能一部分吸附在纳米粒的表面,或者富集在纳米粒的外层而产生突释,此后药物的释放主要是从固体骨架中扩散,并达到缓释作用。
[1] 翟 文,陈庆华,朱宝泉.固体脂质纳米粒的研究进展[J].中国医药工业杂志,2001,32(9):424.
[2] 耿叶慧,杨 丽,张 瑜,等.吡喹酮固体脂质纳米粒的制备及其理化性质研究[J].中国药房,2007,18(28):2 197.
[3] 曹露晔,闫晶超,王玉生,等.蓝萼甲素固体脂质纳米粒的制备及理化性质研究[J].中国药房,2008,19(9):666.
[4] 国家药典委员会编.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:附录ⅩD.