反义寡脱氧核苷酸抑制多药耐药基因mdr1表达并逆转耐药肝癌细胞的体外试验研究
2011-08-07彭志平蒋明东尹晓玲文明李少林重庆医科大学基础医学院重庆市400016
彭志平,蒋明东,尹晓玲,文明,李少林(重庆医科大学基础医学院,重庆市400016)
化学药物治疗是临床上肝癌治疗的重要手段之一,但存在于肿瘤细胞的多药耐药(Multidrug resistance,MDR)机制却严重阻碍了化疗药物的疗效[1]。研究[2]表明,多药耐药基因mdr1及其编码蛋白过度表达是肝癌细胞产生MDR的一条重要途径。因此,从基因水平研究抑制mdr1基因的表达来逆转肝癌细胞MDR,以期增加肿瘤化疗的敏感性是非常必要的。在本研究中,笔者以mdr1基因为靶点,设计并合成寡脱氧核苷酸(ODN),其中ODN分为反义ODN(ASODN)和正义ODN(SODN),从体外培养耐阿霉素(ADM)肝癌细胞HepG2/ADM来观察ASODN对其mdr1基因表达及化疗药物抑制肝癌细胞增殖的影响,探讨ASODN逆转肝癌细胞MDR的可行性。
1 仪器与材料
1.1 仪器
Thermo Forma细胞培养箱(美国赛默飞公司);超纯水系统(美国Millipore公司);480型聚合酶链式反应(PCR)仪(美国PE公司);Fotodyne 60-2107型凝胶成像系统(美国Image公司);550型全自动酶标仪(美国Bio-Rad公司);752型紫外分光光度计(上海第三分析仪器厂)。
1.2 试药
逆转录聚合酶链式反应(RT-PCR)试剂盒及DNA分子量标记X174HincⅡ digest Maker(日本Takara公司);总RNA抽提试剂盒和转染试剂盒(转染试剂为脂质体)(美国Invitrogen公司);蛋白质分子量标准(大连宝生物工程有限公司,范围:6.5~200 kDa)mdr1单克隆抗体(美国Santa Cruz公司);二氨基联苯胺(DAB)检测试剂盒(北京索莱宝科技有限公司);mdr1-ASODN、mdr1-SODN及引物(上海生工生物工程技术服务有限公司);MTT(美国Sigma公司);ADM注射用粉末(美国法玛西亚制药公司,批号:20081103,规格:每瓶10 mg);顺铂注射用粉末(DDP,美国施贵宝公司,批号:20081104,规格:每支20 mg);5-氟尿嘧啶注射液(5-FU,江苏同泰药业有限公司,批号:20081105,规格:250 mg∶10 mL)。
ODN及引物序列见表1。
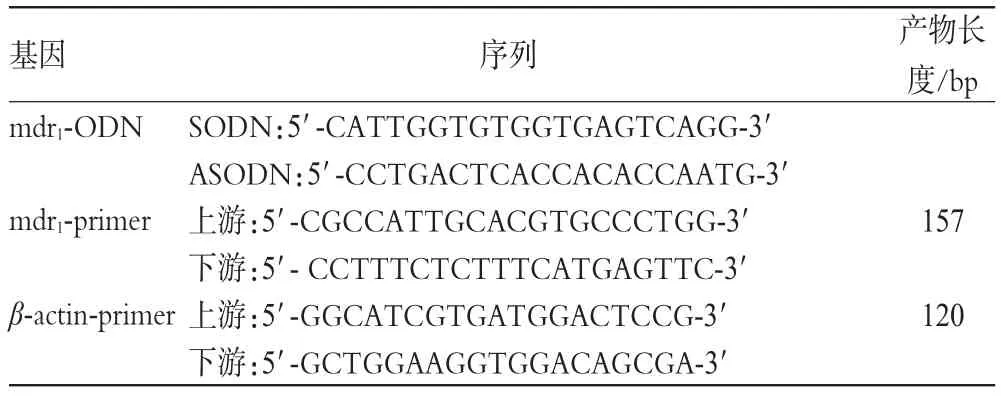
表1 ODN及引物序列Tab 1 Sequence of oligodeoxyribonucleotide and primer
1.3 细胞
人肝癌细胞HepG2由重庆医科大学病理生理学教研室段红教授惠赠;耐ADM肝癌细胞HepG2/ADM由重庆医科大学基础医学院核医学实验室建立,方法如下:将ADM加入至HepG2细胞培养液中,按培养瓶内ADM终浓度逐次递加0.1 mg·L-1,当细胞存活率达到90%以上时,再进行下一梯度的耐药诱导,直至终浓度达到2 mg·L-1。
2 方法
2.1 细胞培养
采用含10%胎牛血清的DMEM培养基(含青霉素100 u·mL-1、链霉素100 u·mL-1),37 ℃、5%CO2常规培养HepG2/ADM细胞。取对数生长期HepG2/ADM细胞,以DMEM培养液稀释制成2×105个/mL细胞悬液备用。
2.2 反义抑制试验
2.2.1 分组。试验分为mdr1-ASODN处理组、mdr1-SODN对照组和空白对照组。mdr1-ASODN处理组:HepG2/ADM细胞中加入mdr1-ASODN和脂质体混合液;mdr1-SODN对照组:HepG2/ADM细胞中加入mdr1-SODN和脂质体混合液;空白对照组:HepG2/ADM细胞中加入脂质体。
2.2.2 脂质体转染。于6孔细胞培养板中接种HepG2/ADM细胞(浓度为2×105个/mL),加入无血清、无抗生素的DMEM培养液,大约24 h后,按照“2.2.1”项下分组加入ODN与脂质体混合液(ODN与脂质体质量比为1∶3)200µL,继续培养6 h。去除转染液,每孔加DMEM培养液(含10%胎牛血清),继续培养48 h。脂质体转染参照转染试剂盒说明书进行。
2.2.3 mdr1mRNA表达的检测。采用RT-PCR法,提取各组细胞的总RNA,并用分光光度计定量,取3µg RNA在1.2%琼脂糖凝胶电泳,检测RNA的完整性。取5µg RNA为模板,用mdr1的特异引物,逆转录合成cDNA。PCR操作按试剂盒说明书进行,同时以β-actin为内参对照;并以水作为阴性对照检测试验过程是否有污染。取PCR扩增产物10µL在2%琼脂糖凝胶电泳,溴化乙锭(EB)染色,对PCR产物琼脂糖凝胶电泳进行图像照相及扫描分析,得β-actin及mdr1mRNA表达的灰度值,以mdr1mRNA灰度值/β-actin灰度值,表示mdr1mRNA表达相对含量,比较3组间mdr1mRNA表达的差异。
2.2.4 mdr1蛋白表达的检测。采用蛋白免疫印迹法,分别提取各培养孔HepG2/ADM细胞的胞浆蛋白,通过聚丙烯酰胺凝胶电泳分离,将蛋白样品转移至聚偏氟乙烯(PVDF)膜上,蛋白封闭液37℃封闭PVDF膜1 h,磷酸盐吐温缓冲液(PBST)洗涤,加mdr1单克隆抗体(1∶300)37 ℃孵育4 h,PBST振荡洗涤2次,加过氧化物酶标记二抗(1∶200)37℃孵育20 min,PBST洗涤4次,每次5 min,DAB室温显色,对显色结果进行照相及图像扫描分析,得β-actin及mdr1蛋白表达的灰度值,以mdr1蛋白灰度值/β-actin灰度值,表示mdr1蛋白表达相对含量,比较3组间mdr1蛋白表达的差异。
2.3 MTT法检测HepG2/ADM细胞对化疗药物的敏感性
HepG2/ADM细胞转染mdr1-ASODN继续培养48 h,收集对数生长期细胞作试验组,未经转染处理的细胞作对照组,分别接种于96孔细胞培养板上,每孔细胞数2×104个,每孔总体积200 μL。每个样本设3个平行孔。2组细胞中分别加入培养液终浓度分别含20、10、50 mg·L-1的ADM、DDP和5-FU,37℃、5%CO2孵箱中培养24 h后,每孔加入0.5 mg·mL-1MTT,继续培养4 h,弃上清,加入二甲基亚砜200 μL,振荡5 min,酶标仪(570 nm)检测吸光度(A),计算平行孔平均A值,计算细胞增殖抑制率:细胞增殖抑制率=(1-试验组平均A值/对照组平均A值)×100%。
2.4 统计学方法
3 结果
3.1 HepG2/ADM细胞中mdr1mRNA表达比较
结果表明,本试验过程没有污染,空白对照组、mdr1-SODN对照组、mdr1-ASODN处理组mdr1mRNA表达相对含量分别为0.97±0.11、0.82±0.08、0.26±0.09。与mdr1-SODN对照组和空白对照组比较,mdr1-ASODN处理组HepG2/ADM细胞中mdr1mRNA表达明显降低(P<0.05)。各组HepG2/ADM细胞中mdr1mRNA表达比较见图1。
3.2 HepG2/ADM细胞中mdr1蛋白表达比较
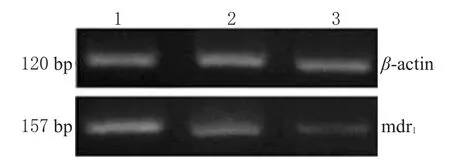
图1 各组HepG2/ADM细胞中mdr1mRNA表达比较Fig 1 Comparison of mdr1mRNA expression of HepG2/ADM in each group
结果表明,空白对照组、mdr1-SODN对照组、mdr1-ASODN处理组mdr1蛋白表达相对含量分别为0.66±0.07、0.62±0.08、0.34±0.07。与mdr1-SODN对照组和空白对照组比较,mdr1-ASODN处理组HepG2/ADM细胞中mdr1蛋白表达明显降低(P<0.05)。各组HepG2/ADM细胞中mdr1蛋白表达比较见图2。

图2 各组HepG2/ADM细胞中mdr1蛋白表达比较Fig 2 Comparison of mdr1protein expression of HepG2/ADM in each group
3.3 HepG2/ADM细胞对化疗药物的敏感性
与对照组比较,ADM、DDP和5-FU对试验组HepG2/ADM细胞增殖抑制率均明显增加(P<0.05),说明mdr1-ASODN转染部分恢复了HepG2/ADM细胞对化疗药物的敏感性。2组HepG2/ADM细胞的增殖抑制率比较详见表2。
表2 2组HepG2/ADM细胞的增殖抑制率比较(%%,±s,n=3)Tab 2 Comparison of proliferation inhibition ratio of HepG2/ADM(%%,±s,n=3)

表2 2组HepG2/ADM细胞的增殖抑制率比较(%%,±s,n=3)Tab 2 Comparison of proliferation inhibition ratio of HepG2/ADM(%%,±s,n=3)
组别对照组试验组ADM 29.2±1.9 57.3±2.7 DDP 33.9±1.7 47.7±2.9 5-FU 31.6±1.6 52.2±2.3
4 讨论
MDR是指一些肿瘤细胞对一种抗肿瘤药物产生耐药性的同时对其他非同类药物也产生耐药性,这是造成肿瘤化学药物治疗失败的主要原因。研究[3~6]发现,肿瘤MDR的产生与耐药基因mdr1、mrp、lrp等表达上调有关,其中mdr1及其相应编码产物过度表达又是产生MDR的主要因素,故从基因水平抑制mdr1基因的表达来逆转肿瘤MDR的研究显得十分必要。
反义技术[7,8]是应用碱基配对的原理,以表达某种特定蛋白的基因为靶基因,人工设计一段与之互补的基因片段封闭该靶基因的表达,使之低表达或不表达,从而阻断与此基因有关的一系列生物学行为。
本研究选择肝癌细胞mdr1基因的关键区域作为靶基因,人为合成与之互补的脱氧核酸片段,在转染ASODN后,检测发现HepG2/ADM细胞中mdr1mRNA及其蛋白表达明显降低(P<0.05),说明ASODN能够进入体外培养细胞内与靶基因特异性结合,产生抑制靶基因表达的效果。
HepG2细胞属人肝癌组织细胞,能大容量培养和传代,是肝癌耐药试验研究的常用细胞株。肿瘤细胞对化疗药物的敏感性检测常常采用MTT法[9,10]。MTT是一种简便快捷的体外药敏检测法,人为误差小。在MTT试验中,笔者将经过mdr1-ASODN转染前、后的HepG2/ADM细胞分别用肝癌常用化疗药物ADM、DDP和5-FU处理,结果发现转染后的细胞增殖抑制率较转染前均有明显提高,说明MDR肝癌细胞部分恢复了对化疗药物的敏感性。
本试验表明,体外ASODN能有效抑制mdr1基因的表达,并恢复肝癌HepG2/ADM细胞对化疗药物的敏感性,是一种逆转肿瘤MDR的有效手段。但是ASODN应用于体内逆转MDR,其自身的体内稳定性及对肿瘤细胞的靶向性作用将是今后研究的重点方向和难点问题。
[1] Giglia JL,Antonia SJ,Berk LB,et al.Systemic therapy for advanced hepatocellular carcinoma:past,present,and future[J].Cancer Control,2010,17(2):120.
[2] 许景峰.肿瘤细胞mdr1基因多药耐药的研究进展[J].解放军药学学报,2010,26(5):453.
[3] Viñolas N,Provencio M,Reguart N,et al.Single nucleotide polymorphisms in MDR 1 gene correlates with outcome in advanced non-small-cell lung cancer patients treated with cisplatin plus vinorelbine[J].Lung Cancer,2011,71(2):191.
[4] 翟宝进,伍 烽,邵泽勇,等.阿霉素诱导人肝癌细胞多药耐药株的建立及其生物学特性评价[J].癌症,2004,23(4):391.
[5] Salih SM.Retrovirus-mediated multidrug resistance gene(MDR1)overexpression inhibits chemotherapy-induced toxicity of granulosa cells[J].Fertility and Sterility,2011,95(4):1 390.
[6] 朱宝英,黄 静,王永林,等.P-糖蛋白及肿瘤多药耐药的逆转[J].中国药房,2011,22(6):550.
[7] Leonetti C,Zupi G.Targeting different signaling pathways with antisense oligonucleotides combination for cancer therapy[J].Curr Pharm Des,2007,13(5):463.
[8] 梁秦龙,王 梅,王 冰,等.反义寡核苷酸抑制人恶性黑素瘤A375细胞survivin mRNA及其蛋白的表达[J].西安交通大学学报,2008,29(5):570.
[9] Hoffmann K,franz C,Zhi X,et al.Sorafenib modulates the gene expression of multi-drug resistance mediating ATP-binding cassette proteins in experimental hepatocellular carcinoma[J].Anticancer Research,2010,30(11):4 503.
[10] 师以康,吴淑英,黄云虹,等.基因mdr1高表达多药耐药肿瘤细胞对力达霉素的药物敏感性[J].药学学报,2006,41(12):1 146.