SLC30A9基因在乳腺癌组织中的差异表达及临床意义
2011-08-01林书瀚黎丹戎利基林唐东平张力图
廖 燕 林书瀚 黎丹戎 利基林 唐东平 唐 凯 张力图
SLC30A9(solute carrier family 30 member 9)又名GAC63,是一个与DNA修复相关的基因[1],其大部分功能未知。SLC30A9定位于4p13,在以往的研究中,大约50%膀胱癌被证实在4p13的4个区域存在杂合性缺失[2],在其它的人类肿瘤包括子宫颈癌[3]、胃腺癌[4]和 BRCA1突变的肿瘤中[5],通过扫描肿瘤组织染色体区域发现,4号染色体短臂存在频繁的杂合性缺失,提示该区域的基因可能与肿瘤的发病有关。近年来发现,SLC30A9可以与β-catenin相互作用,影响Wnt信号通路的激活[6],而Wnt信号通路与多种肿瘤的发展相关[7]。我们从生物信息学分析得到SLC30A9在乳腺癌组织和正常乳腺组织中存在差异性表达,因此,本研究以RT-PCR技术探讨SLC30A9在乳腺癌组织中的表达情况,为进一步分析SLC30A9与肿瘤发生的关系奠定基础。
1 材料与方法
1.1 研究对象与标本保存
30例乳腺癌标本取自2004年12月至2005年6月在广西医科大学附属肿瘤医院住院的手术病例。患者均为女性,年龄30~74岁,中位47岁。其中浸润性导管癌25例,低分化腺癌2例,乳头状癌1例,黏液腺癌1例,导管内癌1例。有淋巴结转移19例,无淋巴结转移11例。所有病例均经病理检查确诊,分别收集30例乳腺癌癌灶组织、30例癌旁组织和10例相应的正常乳腺黏膜组织(距离病灶5cm以上且无癌浸润者)。期间还收集了20例乳腺良性病变组织。这些组织分别离体后,10min内投入液氮速冻,然后转移至-80℃超低温冰箱冻存备用。
1.2 主要试剂和仪器
Trizol总RNA抽提试剂由Invitrogen公司提供,逆转录试剂盒及Taq酶、RNAse-free水等试剂由Promega公司提供。引物设计采用Primer 5软件设计,引物合成由上海博亚生物技术有限公司完成。仪器主要为美国PTC2000型多通道PCR仪、美国PE公司PX2型高性能PCR仪,美国Bio-Rad Gel DOC2000型凝胶成像分析系统。
1.3 RNA的提取
1.3.1 物品和试剂的特殊准备:将清洁的金属器械和泡酸晾干的玻璃器皿放入烤箱,180℃以上高温烘烤5h,以灭活RNA酶,不耐高温的塑料和橡胶制品用配好的1‰DEPC液浸泡12h以上,捞起装盒、打包,高压蒸汽灭菌后烘干备用。所用的溶液均用RNAsefree DEPC水配制。
1.3.2 抽提总RNA的步骤 利用TROZOL一步法提取。
1.3.3 总RNA的鉴定 测定RNA的浓度和纯度:取5μl RNA液加入195μl Rnase-free DEPC水稀释40倍,用双光束紫外分光光度仪(超薄石英杯)测定λ260nm和λ280nm的吸光度值(OD值),根据公式计算浓度CRNA(μg/ml)=OD260×40×40÷1 000,根据OD260/OD280比值反映RNA纯度,所有样本的OD260/OD280比值均在1.8~2.0之间,说明提出的RNA纯度较高,符合标准。
总RNA的电泳鉴定:用1%琼脂糖凝胶电泳1h,琼脂糖凝胶用凝胶成像分析系统扫描,观察若有28S、18S两条带出现,5S条带很微弱,加样孔内无明显DNA残留,说明所提取的总RNA符合要求。
1.3.4 逆转录-多聚酶链式反应(RT-PCR) 按照A3500型逆转录试剂盒(美国Promega公司)实验操作步骤进行。在进行逆转录前先去除RNA中可能存在的痕量DNA。
1.3.5 多聚酶链式反应(PCR) 所用引物为:F-5'GCC AAT TGC ATG GGC CTT AGT TC 3'R-5'TGC CCT TAC TGA TCG GTC ATT CTC C 3'10μl反应体系。PCR反应条件为94℃变性30s、65℃复性30s、72℃延长1min,30次循环。
1.3.6 RT-PCR结果判定 1.6%的琼脂糖凝胶电泳验证,凝胶电泳成像系统成像,测算出相应的光密度比值(SLC30A9 mRNA与GAPDH mRNA之比)。凝胶电泳分析软件(BIORAD公司Quantity one软件)分析测定其光密度,各电泳条带净密度值按下列公式计算:净密度值=(平均密度-背景密度)×面积。以所扩GAPDH密度作为内参照,以目标基因净密度与GADPH净密度的比值进行半定量比较。
1.4 统计学处理
用SPSS10.0 for windows软件对数据进行统计学分析。计数、计量资料分别做t检验和χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 SLC30A9 mRNA的表达水平
全组90例乳腺组织样品中均有SLC30A9 mRNA表达。在30例乳腺癌患者中,5例(4、9、10、12号和13号)患者的癌组织、癌旁组织及正常组织中均存在SLC30A9基因mRNA差异性表达,占16.7%(5/30)。4、9号和12号患者的癌组织中,SLC30A9的表达比相应的正常组织低,而10号和13号患者则表现出在癌组织中表达上调。SLC30A9 mRNA在乳腺癌组织、癌旁组织、正常乳腺组织和乳腺良性病变组织的表达情况。见图1-3。
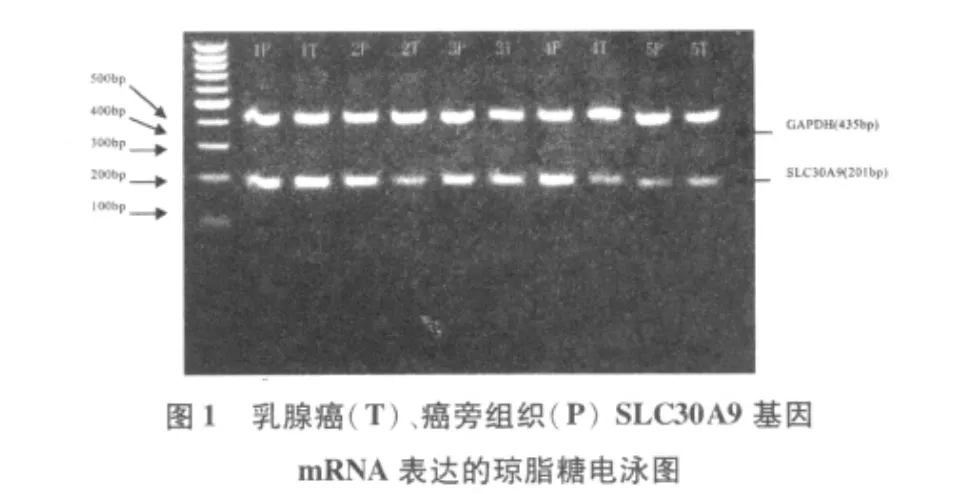


图3 乳腺癌(T)、乳腺良性病变组织(B)SLC30A9基因mRNA表达的琼脂糖电泳图
从组间分析来看,SLC30A9基因mRNA在30例乳腺癌患者的癌组织、癌旁组织和10例正常乳腺组织及20例乳腺良性病变组织中均有表达。其平均光密度比值分别为0.443±0.247、0.427±0.253、0.405±0.209、0.547±0.190。上述4组分别两两比较,SLC30A9 mRNA表达水平的差异均无统计学意义(P>0.05)。见表1。
表1 乳腺癌组织、癌旁组织和正常乳腺组织SLC30A9 mRNA表达水平比较)

表1 乳腺癌组织、癌旁组织和正常乳腺组织SLC30A9 mRNA表达水平比较)
组织类型 n SLC30A9 mRNA P乳腺癌组织 30 0.443±0.247乳腺癌癌旁组织 30 0.427±0.253正常乳腺组织 10 0.405±0.209乳腺良性病变组织 20 0.547±0.190>0.05
2.2 乳腺癌组织SLC30A9 mRNA的表达与各临床病理因素的关系
乳腺癌组织中SLC30A9 mRNA的平均光密度比值在不同年龄、临床分期、病理类型、淋巴结转移及远处转移的组间比较,差异均无统计学意义(P>0.05)。见表2。
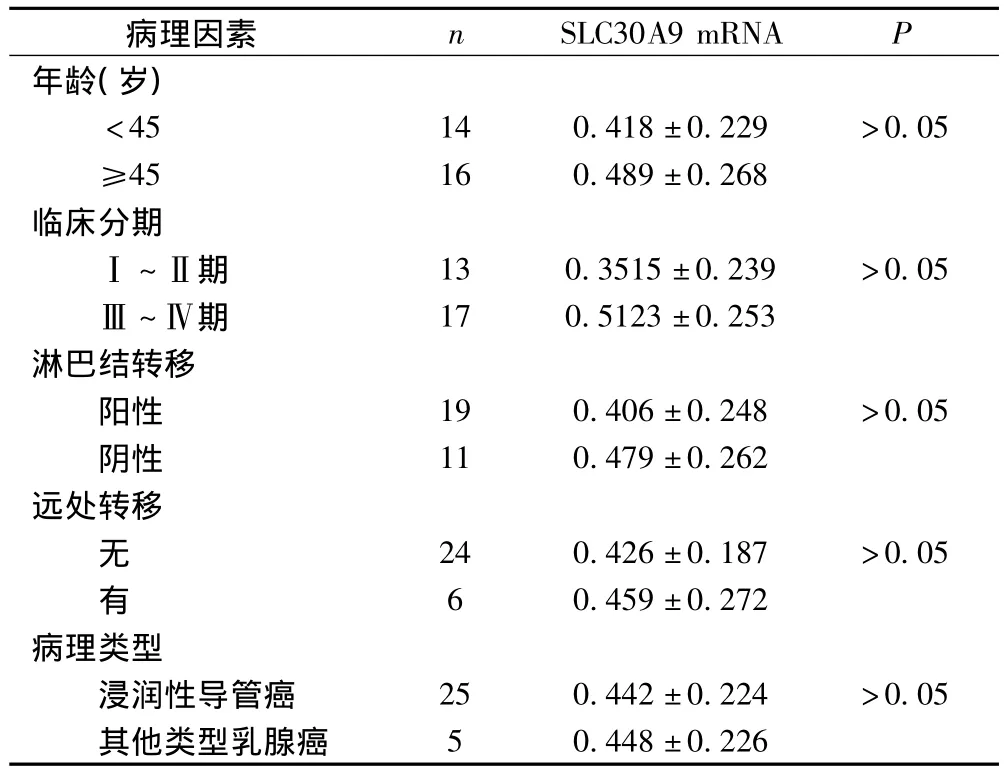
表2 SLC30A9 mRNA在癌组织中的表达与各临床病理因素的关系
3 讨论
本研究利用半定量RT-PCR法对30例乳腺癌的癌组织及其相应的癌旁组织、10例正常乳腺组织和20例乳腺良性病变组织进行SLC30A9 mRNA表达水平的检测。结果发现SLC30A9基因mRNA在90例乳腺组织样品中均有表达。对其平均光密度值进行比较,组间差异均无统计学意义(P>0.05)。即从整体组间的比较来看,没有差异性表达,提示SLC30A9对乳腺癌的发生不是一个主要的因素。但研究发现,肿瘤的发生是多个基因相互作用的过程,大多数涉及的基因只起着部分作用。在突变扫描的研究中,往往只在大量的目的标本中发现极少部分的突变。因此,在筛选疾病基因的过程中我们更应注重个体的差异。在本实验中,我们发现5例标本在癌组织、癌旁组织及正常组织中存在表达异常,占16.7%(5/30),其中,有3例癌组织SLC30A9的表达比相应的正常乳腺组织低,而其他2例则表现出在癌组织中表达上调。实验结果提示在这些标本中存在有基因突变的可能,这有待于突变扫描的结果证实。也可能该基因的表达调控出现误差,造成表达的不稳定。提示SLC30A9基因可能不是乳腺癌主导基因,但有可能起部分作用或与其他因素共同作用。
将30例乳腺癌患者按不同年龄(是否≥45岁)、临床分期的早晚(Ⅰ/Ⅱ期或Ⅲ/Ⅳ期)、病理类型(浸润性导管癌、黏液腺癌、低分化腺癌、乳头状癌、导管内癌)、有无淋巴结转移和远处转移进行分组后,分别在不同组别间比较癌组织SLC30A9 mRNA表达水平,差异均无统计学意义。提示SLC30A9 mRNA与乳腺癌患者不同年龄、临床分期、病理类型、有无淋巴结转移和远处转移等无关。
由于我们发现在一些标本中SLC30A9的表达有上调,而一些标本中有下调,因此我们用生物信息学的方法分析基因的microRNA(miRNA)调控情况,发现在SLC30A9的3'端非翻译区存在有miRNA的结合位点,这说明该基因可能受mRNA的调控。这提示我们需要做该基因的miRNA结合位点的扫描分析,观察是否存在基因突变从而影响表达。目前发现,大约有30%的人类基因表达可以被miRNA调控,而miRNA的调控与肿瘤的发生相关[8~10]。有关方面值得深入研究。
[1] 张忠清.2001年美国癌症统计报告介绍[J].中国肿瘤,2001,10(9)∶520-522.
[2] Walker RA,Jones JL,Chappell SA,et al.Molecular pathology of breast cancer and its applocation to clinical management[J].Cancer and Metastasis Reviews,1997,16(1)∶5-27.
[3] Strausberg RL,Feingold EA,Grouse LH,et al.Generation and initial analysis of more than 15 000 full-length human and mouse cDNA sequences[J].Proc Natl Acad Sci USA,2002,99(26)∶16899-16903.
[4] Sim DL,Chow VT.The novel human HUEL(C4orf1)gene maps to chromosome 4p12~p13 and encodes a nuclear protein containing the nuclear receptor interaction motif[J].Genomics,1999,59∶224-233.
[5] Sim DL,Yeo WM,Chow VT.The novel human HUEL(C4orf1)protein shares homology with the DNA-binding domain of the XPA DNA repair protein and displays nuclear translocation in a cell cycle-dependent manner[J].The International Journal of Biochemistry & Cell Biology,2002,34∶487-504.
[6] Chen YH,Yang CK,Xia M,et al.Role of GAC63 in transcriptional activation mediated by beta-catenin[J].Nucleic Acids Res,2007,35(6)∶2084-2092.
[7] 杜彦艳,刘 鑫,单保恩.Wnt/β-catenin信号转导通路与肿瘤关系的研究进展[J].肿瘤,2009,29(8)∶803-805.
[8] Denli AM,Tops BB,Plasterk RH,et al.Processing of primary microRNAs by the microprocessor complex[J].Nature,2004,432∶231-235.
[9] Gregory RI,Yan KP,Amuthan G,et al.The Microprocessor complex mediates the genesis of microRNAs[J].Nature,2004,432∶235-240.
[10] Lund E,Guttinger S,Calado A,et al.Nuclear export of microRNA precursors[J].Science,2004,303∶95-98.
