大鼠骨髓间充质干细胞对胶质瘤的趋向性
2011-06-28刘佳梅
刘 颖 陈 东 刘佳梅 薛 辉
(吉林大学白求恩医学院组织学与胚胎学教研室,吉林 长春 130021)
由于恶性脑胶质瘤在脑组织中的广泛浸润特性,使现有的手术及辅助性放疗、化疗的疗效不能令人满意,也限制了基因治疗载体的应用。为此,应用具有迁移能力的细胞作为基因治疗的载体有希望成为颅内胶质瘤治疗的有效手段。已有实验表明,大鼠骨髓间充质干细胞(BMSCs)可迁移到脑肿瘤和脑缺血等部位〔1〕,但具体机制还不是十分清楚。趋化因子(CXC)及其受体(CXCR4)和其配体基质细胞因子-1(SDF-1)在BMSCs向C6胶质瘤迁移的作用,国内外尚未见报道。本文通过CXCR4和 SDF-1在 BMSCs和 C6胶质瘤细胞的表达,探讨BMSCs向C6胶质瘤细胞的迁移机制。
1 材料与方法
1.1 BMSCs分离培养 无菌条件下取出Wistar大鼠(由本校实验动物中心提供,体重约200 g)股骨,用注射器吸取无钙镁的Hank液,冲出骨髓,反复吹打,用比重1.073的percoll分离,经Hank液洗后,用10%胎牛血清(FCS)的IMDM重悬细胞,以1×108/ml细胞密度种植于培养瓶中,37℃,5%CO2的恒温培养箱中培养。第3天换液,以后每3 d换液1次,直至细胞融合达90%。对接近融合的细胞用0.25%胰酶孵育消化2~3 min,以1∶2的比例传代培养。
1.2 免疫细胞化学染色 将BMSCs、小鼠(NIH3T3)细胞和C6胶质瘤细胞分别接种于35 mm培养皿中,待细胞长至70%~80%时,行常规免疫组织化学方法处理,BMSCs和NIH3T3细胞进行CXCR4染色,C6胶质瘤细胞进行CXCR4和SDF-1染色。小鼠抗大鼠CXCR4抗体和SDF-1抗体均购自美国Santa cruz公司。二抗购自福州迈新公司。
1.3 BMSCs体外迁移 实验分NIH3T3细胞对照组和BMSCs实验组。先将Matrigel放入4℃冰箱中过夜,使其溶解;将Matrigel用不含血清的IMDM培养基1∶1稀释;加60μl稀释后的Matrigel于Transwell小室的聚碳酯膜上,37℃温箱30 min,使Matrigel聚合成凝胶;收集 C6胶质瘤细胞,调细胞浓度为105/ml,取100μl加入下室;补基础培养液至600μl;分别收集BMSCs和NIH3T3细胞,调节细胞浓度为105/ml,取100μl加入上室;24 h后,取出小室,用棉签擦去膜上面未穿过膜的细胞。
1.4 BMSCs在荷瘤鼠脑内的迁移 ①Wistar大鼠5只(由本校实验动物中心提供),平均体重260~300 g,大鼠胶质瘤模型建立见文献〔2〕。苏木素-伊红(HE)染色,冲洗后,于倒置相差显微镜下(200×)观察穿过膜的细胞数。每个膜中央部分和周围部分各随机取3个视野,计数每个视野内的穿过微孔的细胞数。每组3个平行孔。②在BMSCs移植前,将Hoechst33342加入培养基中(终浓度为5μg/ml),48 h后,0.25%胰蛋白酶消化后,离心收集细胞,用生理盐水制细胞悬液备用。Hoechst33342标记的BMSCs呈蓝色。③C6胶质瘤接种3 d后,分别于5只荷瘤鼠对侧大脑注射106个BMSCs。Wistar大鼠经10%水合氯醛腹腔注射麻醉(0.3 ml/kg)后,固定于立体定位仪上。用磷酸盐缓冲液(PBS)调整细胞浓度为108/ml,用微量注射器抽取5μl标记的BMSCs悬液。注射位点见文献〔2〕。④BMSCs移植21 d后,取脑冠状切面制作冰冻切片,切片厚10μm。用Olympus荧光显微镜直接观察细胞的迁移和存活。同时进行CXCR4和SDF-1常规免疫组织化学染色。
2 结果
2.1 BMSCs的培养 细胞培养24 h后,首次换液,去除未贴壁细胞。原代培养3 d时,贴壁细胞呈球形、多角形、梭形,细胞较小,细胞之间比较稀疏。原代培养的细胞生长缓慢,呈克隆状生长,培养2 w后,细胞达到融合。有一些小圆形细胞,传代后可被去除。传代后,大而扁平状细胞逐渐增多,但随着细胞分裂生长,细胞密度增大,细胞汇流处的BMSCs形态较均一,为长梭形,呈旋涡状或平行生长,折光性较强。传代后的细胞生长速度比原代细胞快,一般7 d即可传代。
2.2 BMSCs、NIH3T3细胞和C6胶质瘤细胞CXCR4和SDF-1的表达 免疫细胞化学结果表明,少数BMSCs表达CXCR4,阳性率为0.86%;NIH3T3细胞不表达CXCR4;C6胶质瘤细胞表达CXCR4和 SDF-1,阳性率分别为 63.53%和 48.42%。见图1。
2.3 BMSCs体外迁移实验 体外迁移实验结果表明,24 h后,可见NIH3T3细胞和 BMSCs向下层C6胶质瘤细胞迁移,BMSCs迁移的细胞数显著多于NIH3T3细胞。
2.4 BMSCs在大鼠脑内的迁移

图1 BMSCs和C6胶质瘤细胞CXCR4和SDF-1表达的免疫组化结果
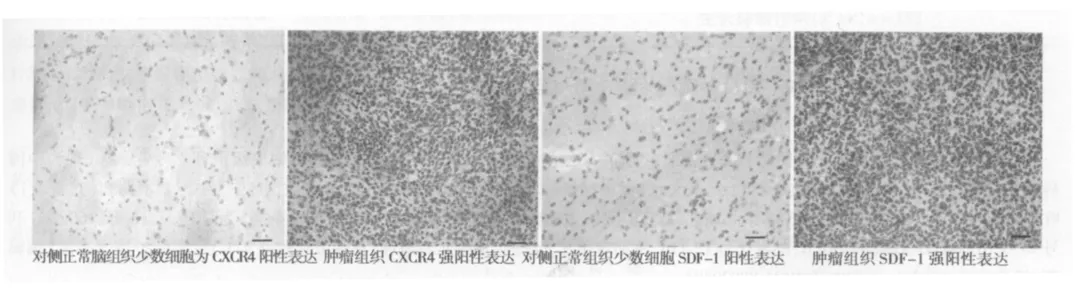
图2 肿瘤组织和正常脑组织CXCR4和SDF-1表达的免疫组化结果(标尺示20μm)
2.4.1 肿瘤组织CXCR4和SDF-1的表达 免疫组织化学检测肿瘤组织CXCR4和SDF-1表达均呈强阳性。对侧正常脑组织仅有少数细胞为CXCR4和SDF-1阳性。见图2。
2.4.2 BMSCs向胶质瘤迁移 BMSCs移植21 d后,荧光显微镜下观察到BMSCs广泛分布于周围的胼胝体、皮层和血管。见图3。
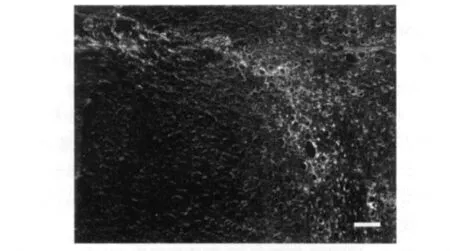
图3 BMSCs移植21 d后广泛分布于胼胝体(标尺示20μm)
3 讨论
目前手术加放化疗是恶性胶质瘤的主要治疗方法,但临床效果并不令人满意,这主要是由于部分肿瘤细胞能够扩散浸润,并广泛迁移至正常脑组织,这些浸润病灶常常远离原发病灶,形成所谓“卫星病灶”,逃避常规的治疗成为胶质瘤复发的主要原因。如何有效地治疗浸润病灶,是治疗胶质瘤的关键。BMSCs属于多能干细胞,其在不同条件下可分化为成骨细胞、脂肪细胞和神经细胞等多种细胞〔3〕。BMSCs可以来源于患者自体,从而避免了免疫排斥反应。BMSCs移植后能在宿主体内长期存活和分化,稳定表达内源性或外源性基因,发挥治疗作用,同时与宿主整合,发挥修补作用。BMSCs的主动迁移性更补充了常规治疗方法不能达到的远距离治疗能力。到目前为止,尚未发现移植入脑内的BMSCs具有致瘤性,临床应用是较为安全的。因此,研究者希望能够用BMSCs作为基因治疗肿瘤的载体。BMSCs可主动迁移到肿瘤部位已被证实,但对其迁移机制知之甚少。CXC趋化因子受体CXCR4是一种G蛋白耦联的具有7个跨膜亚单位的受体,SDF-1是其唯一配体。最早研究发现CXCR4表达在T淋巴细胞、单核细胞和中性粒细胞中,能够介导这些细胞的趋化作用。大量实验证明,在器官损伤时,骨髓中的CXCR4阳性BMSCs被动员释放到外周血,并通过SDF-1的趋化作用到达损伤的组织〔4,5〕。BMSCs中约1%的细胞表达CXCR4,但对BMSCs的迁移非常重要。研究证明在胶质母细胞瘤中SDF-1和CXCR4共同存在,并且随着肿瘤恶性程度的增高表达都增加。
本结果说明BMSCs向C6胶质瘤细胞迁移与CXCR4和SDF-1有一定的关系。体内实验发现胶质瘤模型鼠健侧大脑注射BMSCs,移植21 d后,不但BMSCs在脑内可存活较长时间,而且可见到BMSCs沿着胼胝体、脑室和血管向对侧肿瘤组织迁移。免疫组织化学结果显示胶质瘤CXCR4和SDF-1表达呈强阳性。健侧正常大脑组织虽有CXCR4和SDF-1表达,但显著少于患侧肿瘤组织。BMSCs向胶质瘤迁移机制是相当复杂的。除了与CXCR4/SDF-1通路有关外,还可能是由于肿瘤细胞分泌的可溶性因子〔如血管内皮生长因子(VEGF)、血小板衍生因子(PDGF)和白细胞介素(IL-8)等〕〔6〕和 BMSCs分泌的黏附分子(如CD44等)有关。本实验证明胶质瘤细胞对BMSCs具有明显的趋化作用,可能与胶质瘤细胞高表达CXCR4和SDF-1有关,且BMSCs在体内可长期生存,没有免疫排斥反应,这一结果为以BMSCs为细胞载体的靶向治疗胶质瘤提供了实验依据。
1 Deng W,Han Q,Liao RC,et al.Long-term distribution of adult stem cells in different tissues after transplantation〔J〕.Stem Cell Cell Ther,2003;1:62-5.
2 刘 颖,陈 东,李菁华.骨髓间充质干细胞向神经细胞分化及在成年胶质瘤大鼠脑内的迁移〔J〕.神经解剖学杂志,2007;23(6):626-30.
3 Herzog EL,Chai L,Krause DS.Plasticity of marrow-derived stem cells〔J〕.Blood,2003;102(10):3483-93.
4 Ma J,Ge J,Zhang S,et al.Time course of myocardial stromal cell-derived factor 1 expression and beneficial effects of intravenously administered bone marrow stem cells in rats with experimental myocardial infarction〔J〕.Basic Res Cardiol,2005;100(3):217-23.
5 Ratajczak MZ,Kucia M,Reca R,et al.Stem cell plasticity revisited:CXCR4-positive cells expressing mRNA for early muscle,liver and neural cells“hide out”in the bone marrow〔J〕.Leukemia,2004;18:29-40.
6 Vogel W,Grunebach F,Messam CM,et al.Heterogeneity among human bone marrow derived mesenchymal stem cells and neural progenitor cells〔J〕.Haematologica,2003;88:126-33.
