HBx蛋白对α干扰素诱导的MxA蛋白表达的影响
2011-06-09管世鹤沈继龙杨东亮
管世鹤,潘 颖,杨 凯,沈继龙,杨东亮
(安徽医科大学1.第二附属医院检验科,2.人兽共患病安徽省重点实验室,安徽 合肥 230032;3.华中科技大学同济医学院附属同济医院临床免疫研究室,湖北武汉 430030)
HBx蛋白(Hepatitis B virus X protein)是HBV X基因编码的多功能蛋白,不仅能够影响细胞内信号转导途径如:ERK、SAPK-JNK、p38、Ras-Raf-MAP、PI-3-K途径等[1-2],还在病毒的转录复制、肝细胞癌的发生发展等过程起到重要作用[3-4]。有研究报道[5],激活的ERK信号转导途径可能会影响 α干扰素(IFN-α)诱导的JAK-STAT信号转导途径分子的表达,但HBx蛋白能否通过ERK信号转导途径抑制IFN-α抗病毒活性目前尚不清楚。为此,本研究以HepG2细胞为研究模型,通过基因转染等技术分析HBx蛋白能否影响IFN-α抗病毒蛋白表达,并通过ERK抑制剂PD98059抑制ERK信号转导途径,进一步探讨HBx蛋白可能存在拮抗IFN-α抗病毒活性的分子生物学机制。
1 材料和方法
1.1主要材料转染试剂盒脂质体LipofectamineTM2000与RNA提取试剂盒Trizol Reagent购自Invitrogen公司。逆转录试剂盒Reverse Transcription System购自Promega公司。RT-PCR引物由上海生物工程有限公司合成。IFN-α1b购自深圳科兴生物工程有限公司。兔抗人抗-磷酸化ERK,兔抗人抗-STAT1抗体、兔抗人抗-磷酸化STAT1抗体购自Bioworlde公司。二抗购自中杉金桥公司。PD98059购自Promega公司,质粒pcDNA3.1(-)购自Invitrogen公司。重组质粒FL1-145HBx由美国Drexel大学医学院Dr.Clippinger惠赠,HepG2细胞由本实验室保存。
1.2细胞的培养及分组处理HepG2细胞用含10%小牛血清、1×105U·L-1青霉素、1×105U·L-1链霉素、2 mmol·L-1谷氨酰胺 DMEM 培养液培养。转染前一天行HepG2细胞传代,并以5×107·L-1接种6孔板。接种后2 d待细胞汇合约为75%时,按试剂盒说明书步骤分别混合质粒pcDNA3.1(-)或 FL1-145HBx 4μg与 LipofectamineTM2000 250 μl至无血清DMEM行转染。HepG2细胞分为4组,对照组(CG):HepG2细胞不做任何处理;空载体组(EG):HepG2细胞按上述转染方法转染质粒pcDNA3.1(-);转染组(TG):HepG2细胞转染表达HBx蛋白的质粒FL1-145HBx;预处理组(PG):HepG2细胞转染 FL1-145HBx后 6 h换含有 40μmol·L-1的PD98059的DMEM培养液培养24 h。以1 000 kU·L-1的IFN-α作用于各组细胞6 h。
1.3免疫印迹法检测蛋白表达预冷PBS洗6孔板中细胞3次,每孔加80 μl含有蛋白酶抑制剂的细胞裂解液,冰上反应10 min,振荡,12 000 r·min-14℃离心 10 min,收集上清液与 20 μl蛋白上样缓冲液混合煮沸10 min。取20 μl行SDS-PAGE电泳,80mA电流2 h湿电转,10%脱脂奶粉封闭过夜,加一抗过夜,PBS洗3次,加二抗室温孵育2 h,PBS漂洗3次,ECL试剂盒检测。
1.4 RT-PCR检测MxA、STAT1细胞总RNA的提取采用 TRIzol试剂,并参照文献[6]进行 RT-PCR操作。以目的基因与内参β-actin灰度值的比值表示目的基因mRNA相对表达水平。(引物序列及反应条件见Tab 1)。
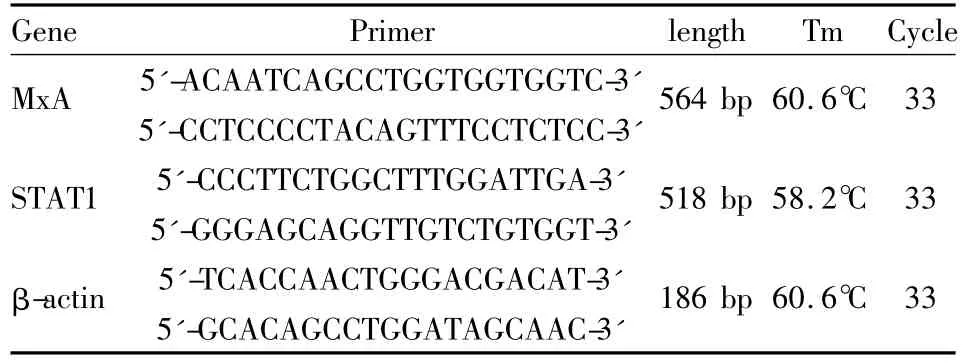
Tab 1 Primers and reaction conditions
1.5统计学处理数据用±s表示。用SPSS13.0软件进行统计学处理,组间采用方差分析。
2 结果
2.1HBx蛋白对IFN-α诱导的MxA蛋白表达的影响以1 000 kU·L-1浓度的IFN-α处理各组细胞,免疫印迹和RT-PCR法分别检测细胞HBx蛋白和MxA mRNA表达水平。从Fig 1和Fig 2可以看出,转染组和预处理组细胞均能够表达HBx蛋白,转染组细胞MxA mRNA表达水平(0.32±0.03)明显低于对照组(0.65±0.05)和空载体组(0.66±0.05),差异有统计学意义(F=59.39,P<0.05)。而经PD98059预处理的细胞中,MxA mRNA表达水平(0.59±0.05)接近于对照组和空载体组(F=1.91,P>0.05)。

Fig 1 Expression of HBx protein in each group

Fig 2 Effects of HBx on the expression of MxA mRNA in each group
2.2HBx蛋白对IFN-αJAK-STAT信号转导途径分子STAT1表达的影响RT-PCR结果发现,转染组细胞STAT1 mRNA表达水平为(0.47±0.06),与对照组(2.13±0.12)和空载体组(2.15±0.09)比较,差异有统计学意义(F=325.92,P<0.05)(见Fig 3)。免疫印迹检测结果与RT-PCR检测结果相符合,即转染组细胞中t-STAT1及p-STAT1明显低于对照组和空载体组(见Fig 4、Tab 2)。
Tab 2 Expression of p-STAT1 and t-STAT1 protein in each group(±s,n=8)

Tab 2 Expression of p-STAT1 and t-STAT1 protein in each group(±s,n=8)
*P <0.05 vs untransfected group and empty vector group.
Group p-STAT1 protein t-STAT1 protein Control group 2.63 ±0.38 2.64 ±0.33 Empty vector group 2.40 ±0.45 2.48 ±0.06 Transfection group 0.51 ±0.04* 0.58 ±0.03*Pre-treatment group 1.77 ±0.12 2.33 ±0.14

Fig 3 Effects of HBx on the expression of STAT1 mRNA in each group

Fig 4 Effects of HBx on the expression of p-STAT1 and t-STAT1 protein in each group
2.3HBx蛋白对ERK信号转导途径的影响为进一步研究HBx蛋白抑制MxA蛋白表达的机制,免疫印迹法检测各组细胞中p-ERK蛋白表达情况。从Fig 5可以看出,随着HBx蛋白的表达,转染组细胞中 p-ERK蛋白表达增强,但经 ERK抑制剂PD98059预处理后,细胞中p-ERK蛋白的表达明显降低。
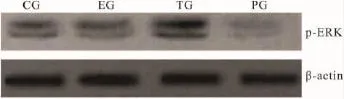
Fig 5 Effects of HBx on the expression of p-ERK protein in each group
3 讨论
IFN-α是临床治疗乙型肝炎的重要药物之一,它通过与细胞膜上的的受体结合诱导胞质中的STAT蛋白P91和P113进行酪氨酸磷酸化,最终促发和诱导细胞表达多种抗病毒蛋白:如双链RNA激活的蛋白激酶(PKR)、2',5'-寡腺苷酸合成酶(2',5'-OAS)、抗黏液病毒A蛋白(MxA)、抗粘液病毒B蛋白(MxB)[7-8]。然而,本课题组前期的研究发现,在体外IFN-α并不能抑制HepG2.2.15细胞中HBV的复制,进一步的研究发现[9],IFN-α诱导的重要的抗病毒蛋白MxA蛋白在HepG2.2.15中不表达,在HepG2细胞中能够正常表达。据此,我们推测HBV可能通过抑制MxA蛋白的表达而发挥拮抗干扰素的抗病毒作用。
HBx是一种具有双重作用的转录激活因子,具有促进多种蛋白激酶的活化,并激活体内多种信号转导途径的功能,其与ERK信号转导途径的相互作用在乙型肝炎的发病和发展中起着重要作用[10]。本研究发现,在表达HBx蛋白的 HepG2细胞中,IFN-α诱导的抗病毒蛋白MxA表达降低,同时JAKSTAT信号转导途径分子p-STAT1和t-STAT1的表达也下降,这表明HBx蛋白很可能通过影响STAT1蛋白的表达及磷酸化而抑制抗病毒蛋白MxA的表达,进而拮抗IFN-α抗病毒活性。进一步研究发现,特异性的ERK信号转导途径阻断剂PD98059能够通过抑制p-ERK蛋白的表达而恢复抗病毒蛋白MxA和JAK-STAT信号转导途径分子p-STAT1和t-STAT1的表达。上述研究结果表明HBx蛋白很可能通过ERK信号途径与JAK-STAT信号转导途径的共同作用,从而影响IFN-α抗病毒蛋白MxA的表达。
本研究初步探讨HBx蛋白对IFN-α诱导抗病毒活性可能存在的影响,并推测HBx蛋白很可能通过抑制抗病毒蛋白的表达而发挥拮抗和反作用IFN-α抗病毒作用,这也很可能是部分乙型肝炎患者干扰素治疗效果不佳的原因之一。
[1]Bouchard M J,Schneider R J.The enigmatic X gene of hepatitis B virus[J].J Virol,2004,78(23):12725 - 34.
[2]邝建玉,杨 林.乙型肝炎病毒X蛋白与细胞信号转导途径[J].国际流行病学传染病学杂志,2008,35(6):399 -402.
[2]Kuang J Y,Yang L.Protein X of hepatitis B virus and cell signal transduction pathways[J].Int J Epidemiol Infect Dis,2008,35(6):399-402.
[3]Xu Z,Yen T S,Wu L,et al.Enhancement of hepatitis B virus replication by its X protein in transgenic mice[J].J Virol,2002,76(5):2579-84.
[4]侯全玲,唐 红,何 芳,等.乙肝病毒X蛋白增强小鼠体内HBV的转录及复制[J].四川医学,2008,29(6):629-31.
[4]Hou Q L,Tang H,He F,et al.Hepatitis B virus X protein augments HBV transcription and replicationin vivo[J].Sichuan Med J,2008,29(6):629 -31.
[5]Noser J A,Mael A A,Sakuma R,et al.The RAS/Raf1/MEK/ERK signaling pathway facilitates VSV-mediated oncolysis:implication for the defective interferon response in cancer cells[J].Mol Ther,2007,15(8):1531 -6.
[6]陈莹瑛,李 俊,施 磊,等.玉屏风多糖对佐剂性关节炎大鼠T细胞亚群的影响[J].中国药理学通报,2010,26(5):588-92.
[6]Chen Y Y,Li J,Shi L,et al.The influence of Yupingfeng polysaccharide on T lymphocyte subgroup of adjuvant arthrits rat[J].Chin Pharmacol Bull,2010,26(5):588 - 92.
[7]Samuel C E.Antiviral actions of interferons[J].Clin Microbiol Rev,2001,14(4):778 -809.
[8]徐丙发,范鲁雁,范清林,等.重组人白蛋白干扰素α-2b融合蛋白的抗HBV机制[J].中国药理学通报,2010,26(2):274-5.
[8]Xu B F,Fan L Y,Fan Q L,et al.Study on mechanisms of anti-HBV activity of recombinant human serum albumin-interferon-α-2b fusion protein[J].Chin Pharmacol Bull,2010,26(2):274 -5.
[9]管世鹤,刘华平,杨东亮,等.新型低密度cDNA Macroarray的建立及其应用于干扰素抗HBV的研究[J].中华实验和临床病毒学杂志,2005,19(3):246 -9.
[9]Guan S H,Liu H P,Yang D L,et al.Establishment of a new lowdensity cDNA Macroarray and the application in the activity of IFN against HBV[J].Chin J Exp Virol,2005,19(3):246 -9.
[10]Klein N P,Schneider R J.Activation of Src family kinases by hepatitis B virus HBx protein and coupled signaling to Ras[J].Mol Cell Biol,1997,17(11):6427 -36.
