C肽对GK大鼠糖尿病肾病的影响
2011-06-08姜永玮张文健许世清成兰云娄晋宁
姜永玮,张文健,许世清,成兰云,娄晋宁
近年来,在我国 20 岁以上的人群中,糖尿病的发病率不断上升,糖尿病患病率已经达到9.7%[1]。糖代谢紊乱导致微血管病变,引发一系列并发症,包括肢体缺血坏死、视网膜病变和肾功能衰竭等,是导致糖尿病患者致残和死亡的主要原因。糖尿病肾病是糖尿病最常见的微血管并发症之一,约占住院糖尿病患者的 20%~30%,其中约30%的糖尿病肾病将会发展成为终末期肾功能衰竭。因此,如何防治糖尿病肾病是糖尿病临床治疗面临的重要问题。
糖尿病肾病的主要病理改变包括肾小球基底膜增厚、系膜增生、肾小球足细胞形态改变、肾小球硬化等[2],而糖尿病肾病的主要功能改变包括 24小时尿蛋白升高,特别是微量白蛋白的升高[3]。虽然口服降糖药或胰岛素治疗能够较好地控制血糖水平,但并不能完全防止或逆转糖尿病肾病的发生或发展。C 肽是胰岛素原转变成胰岛素时切下的一段肽链,与胰岛素等分子释放入血[4]。C 肽本身虽然没有调节血糖的作用,但文献报道,其可以延缓甚至治疗糖尿病动物的糖尿病肾病[5-6],提示 C 肽可能具有与胰岛素不同的生理作用。为评价 C 肽对糖尿病肾病,特别是对 2 型糖尿病伴糖尿病肾病的治疗作用,我们将灌注有 C 肽的 ALZET 微量渗透压泵放置到伴有糖尿病肾病的自发性糖尿病 GK 大鼠的腹腔内,评价 C 肽对糖尿病肾病大鼠的肾脏功能和肾脏病理的影响,并分析其可能的相关分子机制,为糖尿病肾病防治提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级 8 周龄 GK 大鼠购自上海斯莱克实验动物有限公司[合格证号:SCXK(沪)2007-0005];SPF 级 8 周龄雄性 Wistar 大鼠购自北京维通利华实验动物有限公司[合格证号:SCXK(京)2006-0009]。
1.1.2 主要试剂 高脂饲料(普通饲料 88.2%、精炼猪油 10%、胆固醇 1.5%、猪胆盐 0.3%)购自中国科学院实验动物中心;大鼠 C 肽购自美国Sigma 公司;微量渗透压泵(2ML4)购自美国 Alzet公司;BCA 法蛋白测定试剂盒购自碧云天公司;大鼠白蛋白 ELISA 检测试剂盒购自美国 Assaypro公司;兔抗大鼠 FN(Fibronectin)抗血清购自美国Santa Cruz 公司;兔抗大鼠 RAGE(receptor of advanced glycation end products)抗血清和小鼠抗大鼠 PKC-β(protein kinase C-β)单克隆抗体购自美国 Sigma-Aldrich 公司;兔抗大鼠 PKA(protein kinase A)抗血清购自英国 Abcam 公司;RNeasy总 RNA 提取试剂盒购自德国 Qiagen 公司;SYBR green PCR reagent kit 购自日本 Toyobo 公司;ECL 化学发光试剂购自美国 Millipore 公司。
1.2 方法
1.2.1 实验动物 SPF 级 8 周龄 GK 大鼠,体重 250~300 g,采用高脂饲料喂养。当 GK 大鼠连续 3 d 血糖 ≥ 16.7mmol/L 时,确认为糖尿病模型建立。成模后的糖尿病 GK 大鼠继续普通饲料喂养 10 周,直至 24 小时尿蛋白达到 300 mg以上,确认为糖尿病肾病动物模型建立成功[3]。SPF级同龄雄性 Wistar 大鼠,体重 250~300 g,用普通饲料喂养相同时间作为正常对照组。
1.2.2 动物分组 将 24 只糖尿病肾病 GK 大鼠用随机数字表法分为3 组,每组 8 只。C 肽治疗组:将灌注了 2 ml C 肽溶液(用 0.9%生理盐水配制)的 ALZET 微量渗透压泵以手术方法植入大鼠腹腔,并于 28 d 后更换一次含有药物的微量渗透压泵。该泵以 50 pmol/(kg·min) 的恒定速率释放 C 肽。空白对照组:腹腔植入灌注 0.9%生理盐水的微量渗透压泵,其他步骤同 C 肽治疗组。胰岛素治疗组:使用甘精胰岛素皮下注射 2.5 IU/d。各组治疗时间均为12 周。另以同龄 Wistar 大鼠饲养 12 周作为正常组。
1.2.3 功能评价
1.2.3.1 血糖检测 治疗前以及治疗后第1、2、3 个月,各组大鼠尾静脉取血测量血糖。
1.2.3.2 尿蛋白和尿白蛋白检测 将各组大鼠置于代谢笼中,收集 24 小时尿液。大鼠尿蛋白检测使用 BCA 法蛋白测定试剂盒,按照说明书测定各组大鼠 24 小时尿蛋白;使用大鼠白蛋白 ELISA检测试剂盒,按照说明书测定各组大鼠 24 小时尿白蛋白。
1.2.4 肾脏病理检查 治疗结束后,将大鼠处死,肾脏经生理盐水灌洗后,部分肾组织用于提取肾小球;部分组织用 10%中性甲醛固定,石蜡包埋后用于 PAS 染色和免疫组织化学染色;部分组织用2.5%戊二醛室温下固定,由北京协和医学院电镜室制作透射电镜标本,在 JEM1010 透射电子显微镜下观察肾小球基底膜(GBM)和足细胞的形态。
1.2.5 免疫组织化学染色 石蜡切片常规脱蜡、脱水,微波热修复,3%过氧化氢溶液封闭内源性过氧化物酶。一抗分别使用兔抗大鼠 FN 抗血清、兔抗大鼠 RAGE 抗血清、小鼠抗大鼠 PKC-β 单克隆抗体、兔抗大鼠 PKA 抗血清,4℃孵育过夜。二抗使用辣根过氧化物酶标记的羊抗兔 IgG 抗体或羊抗小鼠 IgG 抗体,37℃孵育 30min。二氨基联苯胺(DAB)显色,苏木素溶液复染、封片后镜检。
1.2.6 实时定量 PCR 治疗结束后,各组大鼠的肾皮质,置于 100 目金属筛网中,用玻璃注射器内芯研磨,收集滤过的细胞悬液,在 4℃条件下,2500×g离心 8min。弃上清,沉淀经 M199 溶液重悬后,过 300 目金属筛网。用 M199 溶液反复冲洗 300 目筛网,收集肾小球,4℃2500×g离心 8min。
使用 RNeasy 总 RNA 提取试剂盒和逆转录试剂盒进行总 RNA 的提取和逆转录。使用 SYBR green PCR reagent kit,应用 ABI PRISM 7300 序列检测系统两步法进行 PCR 扩增。引物序列见表1。2-△△Ct法半定量分析FN、RAGE、PKC-β以及PKA基因 mRNA 水平的变化。

表1 PCR 扩增反应引物及产物Table 1 PCR primers and amplification products
1.2.7 Western blot 提取肾小球总蛋白,采用紫外分光光度法在 280 nm 测定蛋白含量。取 30 μg总蛋白进行聚丙烯酰胺凝胶电泳(SDS-PAGE)后,将蛋白转印至 PVDF 膜,用含 5%脱脂奶粉的TBST 室温封闭 2 h,洗膜后分别加入兔抗 FN 抗血清、兔抗 RAGE 抗血清、小鼠抗大鼠 PKC-β 单克隆抗体、兔抗大鼠 PKA 抗血清、小鼠抗 β-actin单克隆抗体,4℃杂交过夜。洗膜后,用辣根过氧化物酶标记的羊抗兔 IgG 或羊抗小鼠 IgG 进行二抗杂交。使用 ECL 化学发光试剂显色,暗室曝光成像。
1.3 统计学分析
所有数据应用 SPSS13.0 软件进行统计学分析,各组数据以±s表示,组间比较采用单因素方差分析。P<0.05 为差异有统计学意义,P<0.01 为统计学差异非常显著。
2 结果
2.1 C 肽治疗对大鼠血糖及肾脏功能的影响
在治疗期间,正常组大鼠血糖处于正常水平;胰岛素治疗组大鼠血糖维持在(10.24±2.95)mmol/L;而空白对照组和 C 肽治疗组大鼠血糖都持续维持在 16.7mmol/L以上(图1A)。
与正常组比较,空白对照组大鼠的 24 小时尿蛋白和 24 小时尿白蛋白持续升高,而 C肽治疗组大鼠的 24 小时尿蛋白和 24 小时尿白蛋白逐渐降低,从治疗 2 个月开始与空白对照组间统计学差异非常显著(P<0.01);胰岛素治疗组大鼠的24 小时尿蛋白和 24 小时白蛋白也呈持续升高趋势,各时间点与空白对照组大鼠相比没有统计学差异,见图1B 和 C。

图1 C肽对大鼠血糖、尿蛋白和尿白蛋白的影响(A:C 肽对大鼠血糖的影响;B:C 肽对大鼠 24 小时尿蛋白的影响;C:C 肽对大鼠 24 小时尿白蛋白的影响。* 与空白对照组大鼠相比,P<0.01)Figure 1 Effects of C-peptide on blood glucose,urinary protein and urinary albumin of GK rats with diabetic nephropathy.(A:Effects of C-peptide on blood glucose; B: Effects of C-peptide on urinary protein; C: Effects of C-peptide on urinary albumin.*P<0.01 vs vehicle group)
2.2 C 肽对大鼠肾小球基底膜和足细胞形态的影响
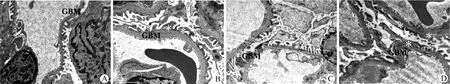
图2 C 肽对糖尿病肾病大鼠肾小球基底膜和足细胞形态的影响电镜图×20 000(A:正常组;B:空白对照组;C:C肽治疗组;D:胰岛素治疗组。* 代表足突融合)Figure 2 Effects of C-peptide on glomerular base membrane (GBM) and morphology microscopy of podocytes in kidney of diabetic GK rat.×20 000 (A: Normal group; B: Vehicle group; C: C-peptide group; D: Insulin group.* represents podocyte foot processes)
与正常大鼠肾小球基底膜相比,空白对照组大鼠基底膜明显增厚,足细胞的足突融合或缺失,排列不规则;C 肽治疗组大鼠的基底膜明显变薄,足细胞的形态和排列明显改善;而胰岛素治疗组大鼠的基底膜和足细胞改变与空白对照组大鼠类似(图2)。
2.3 C 肽对大鼠肾小球硬化的影响
肾脏 PAS 染色结果显示:正常大鼠肾小球毛细血管袢薄而清晰,肾小球囊间隙明显(图3A);空白对照组大鼠肾小球基底膜明显增厚,系膜细胞增生,毛细血管袢有结节状粉红色的物质沉积,肾小球球囊间隙几乎消失(图3B);C 肽治疗组大鼠肾小球毛细血管袢比较清晰,肾小球囊间隙明显(图3C);而胰岛素治疗组肾小球硬化没有明显改善作用(图3D)。
对肾小球 FN 的免疫组织化学染色结果显示:与正常大鼠肾脏(图3E)相比,空白对照组大鼠肾脏染色浓集,肾小球系膜细胞可见棕黄色阳性染色(图3F);胰岛素治疗组大鼠肾小球阳性染色略有减少(图3H),而 C 肽治疗大鼠肾小球阳性染色明显减少(图3G);肾小球 FN 的实时定量 PCR(图3I)及 western blot(图3J)检测结果与免疫组化染色结果一致。
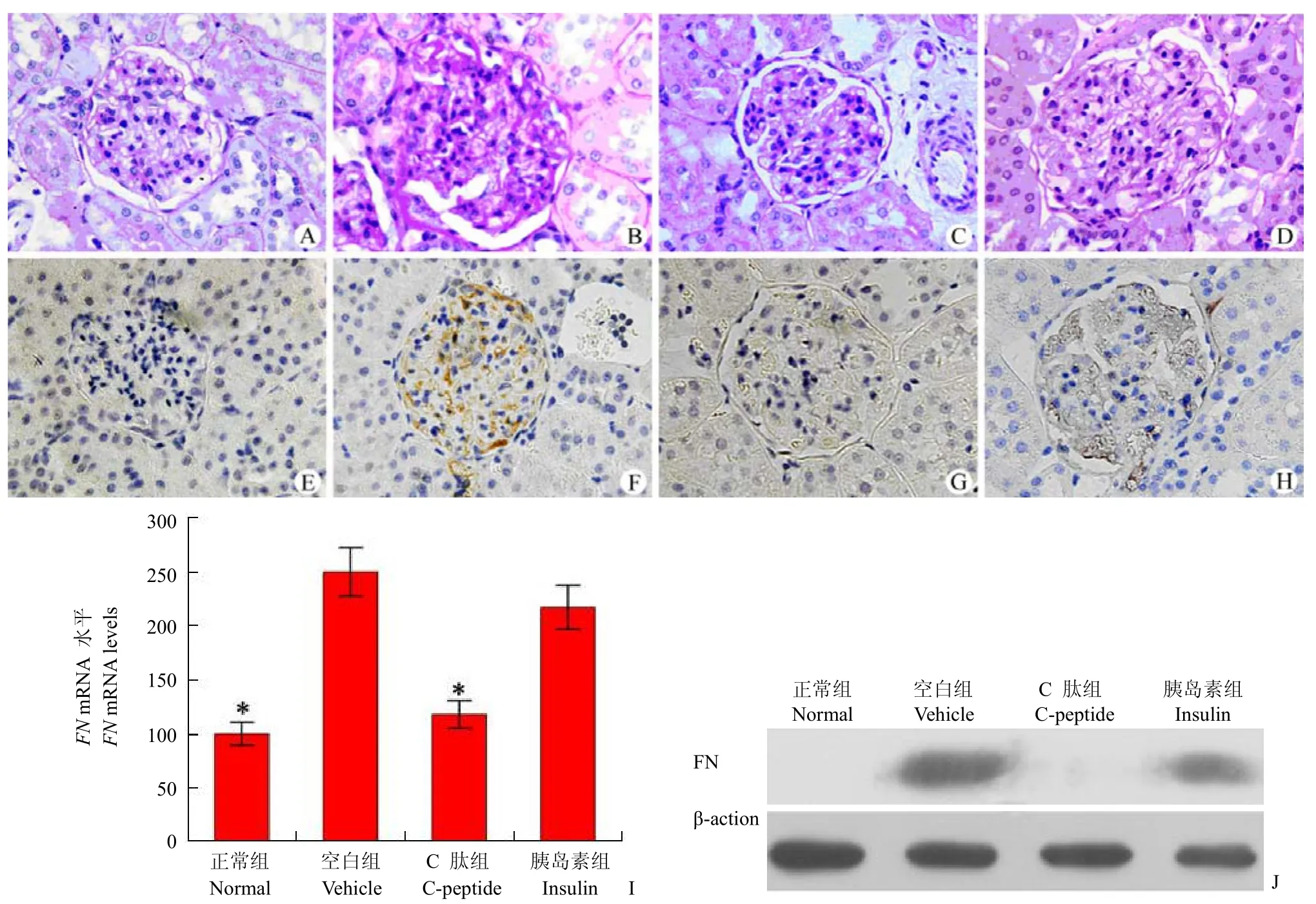
图3 C 肽对糖尿病 GK 大鼠肾小球硬化的影响×400(A~D:分别为正常组、空白对照组、C 肽治疗组、胰岛素治疗组大鼠肾脏 PAS 染色;E~H:分别为正常组、空白对照组、C 肽治疗组、胰岛素治疗组大鼠肾脏的 FN 免疫组织化学染色;I:实时定量 PCR 检测大鼠肾小球 FN mRNA 表达;J:Western blot 检测大鼠肾小球 FN 蛋白表达。* 与空白对照组相比,P<0.01)Figure 3 Effect of C-peptide on glomerulosclerosis in diabetic GK rat.×400 [A - D: PAS (Periodic acid-Schiff) staining of glomeruli in normal group, vehicle group, C-peptide group and insulin group; E - H: Immunohistochemistry staining of FN in normal group, vehicle group, C-peptide group and insulin group; I: Real-time PCR for FN mRNA levels in glomerular lysates; J: Western blot analyses for FN protein in glomerular lysates.*P<0.01 vs vehicle group]
2.4 C 肽对糖尿病肾病大鼠肾小球 RAGE、PKC-β以及 PKA 表达的影响
实时定量 PCR(图4A)、western blot(图4B)以及免疫组织化学染色(图4C)结果显示:与正常大鼠比较,空白对照组大鼠肾小球 RAGE、PKC-β 在 mRNA 水平、蛋白水平以及组织水平的表达均显著升高(P<0.01),而 PKA 在 mRNA水平、蛋白水平以及组织水平的表达均显著降低(P<0.01);与空白对照组相比,C 肽治疗显著下调糖尿病肾病 GK 大鼠肾小球 RAGE、PKC-β 的表达,升高 PKA 的表达;胰岛素治疗也可以部分降低 RAGE 在肾小球的表达,但是对 PKC-β 以及 PKA 在糖尿病肾病大鼠肾小球的表达水平没有明显的影响。

图4 C 肽治疗 GK 大鼠肾小球 RAGE、PKC-β 以及 PKA 表达的影响×400(A:实时定量 PCR 检测大鼠肾小球RAGE、PKC-β 和 PKA mRNA 表达水平;B:Western blot 检测大鼠肾小球 RAGE、PKC-β 和 PKA 蛋白表达水平;C:免疫组织化学染色检测大鼠肾小球 RAGE、PKC-β 和 PKA 组织表达水平;*与空白对照组大鼠相比,P<0.01)Figure 4 Effect of C-peptide treatment on the expression of RAGE, PKC-β and PKA in glomeruli.×400 (A: Real-time PCR quantification of RAGE, PKC-β and PKA mRNA levels in glomeruli lysates.B: Western blot analyses of RAGE, PKC-β and PKA protein levels in glomeruli lysates.C: Immunohistochemistry staining of RAGE, PKC-β.and PKA in glomeruli; *P<0.01 vs vehicle group)
3 讨论
最近研究表明,C 肽是一种生物活性物质,并具有与胰岛素不同的生理作用[7-8]。C 肽治疗能够防止或者延缓糖尿病患者的糖尿病肾病的进展,有效降低肾小球高滤过率以及蛋白尿[5,9-11]。但是 C肽治疗 2 型糖尿病肾病的相关机制尚不明了。
GK 大鼠是一种自发性非肥胖型 2 型糖尿病动物模型,在病程较早期出现糖尿病肾病。我们采用高脂饲料诱发 GK 大鼠血糖升高后,继续饲养10 周,直至出现 24 小时尿蛋白以及 24 小时尿白蛋白明显升高等糖尿病肾病改变后作为本研究的动物模型。
我们将 C 肽灌注微渗泵,放置大鼠腹腔,并通过微渗泵恒定缓慢释放 C 肽,从而评价 C 肽治疗对糖尿病肾病的影响。首先,观察了 C 肽对糖尿病大鼠的血糖,24 小时尿蛋白和 24 小时尿白蛋白的影响。结果显示,C 肽不能降低糖尿病 GK大鼠的血糖,但在治疗 2 个月后可以明显降低24 小时尿蛋白以及 24 小时尿白蛋白,与文献[12]报道结果相一致。蛋白尿是糖尿病肾病的主要表现之一[13],不仅与糖尿病肾病的肾脏损伤程度密切相关,而且是直接导致肾功能恶化的重要危险因子[14]。因此,C 肽治疗后尿蛋白和尿白蛋白水平的降低,是糖尿病肾病改善的重要指标。
我们进一步研究了大鼠肾小球的病理改变。肾小球滤过屏障由内皮细胞基底膜和足细胞组成[15],其结构改变是糖尿病肾病发生蛋白尿的病理基础。透射电镜观察显示,糖尿病大鼠肾小球的基底膜明显增厚,足细胞足突融合甚至缺失,而在 C 肽治疗后,肾小球基底膜的厚度减小,足细胞的融合及缺失明显减少。糖尿病肾病的主要病理改变是肾小球硬化和肾小球细胞外基质(ECM)增生,与蛋白尿及肾功能损害有直接关系。PAS 染色结果显示,C 肽治疗能够降低糖尿病 GK 大鼠肾小球硬化程度,并且伴随 FN 表达水平的降低。FN 主要分布于系膜基质中,是构成肾小球 ECM 主要的非胶原糖蛋白,FN 的改变可以充分反映肾小球 ECM 的变化[16]。C 肽治疗可以从 mRNA 水平、蛋白表达水平以及组织水平降低 FN 在糖尿病肾病大鼠肾小球的表达。
最后,我们研究了 C 肽治疗糖尿病肾病可能的分子机制。目前认为,糖尿病糖代谢紊乱产生的糖基化终末产物(AGEs)通过作用于肾小球毛细血管的 RAGE 激活蛋白激酶,从而引发一系列氧化应激反应,导致细胞损伤。细胞内的高血糖是导致细胞内外 AGEs 升高的始动因素[17],动物实验表明,阻断 RAGE 可以阻止糖尿病肾病的继续进展[18]。AGEs 与 RAGE 结合后,可导致 PKC 的激活,引发氧化应激反应促进糖尿病肾病的进展,包括增加血管内皮细胞损伤和通透性、促进细胞外基质的合成、细胞因子激活等[19]。现已证明,PKC-β亚基在糖尿病肾病发生、发展过程发挥重要作用[20]。小鼠在注射链尿佐菌素(streptozotocin,STZ)诱导成糖尿病模型后,阻断 PKC-β 亚基,可以逆转STZ 诱导的小鼠糖尿病肾病[21]。PKA 的激活不仅与 PKC 具有交互抑制作用[22],而且能够降低血管内皮细胞的氧化应激反应[23],提示 PKA 的激活可能对糖尿病肾病具有保护作用。本研究结果显示,C 肽治疗可以在 mRNA 水平、蛋白水平以及组织水平降低下调 RAGE 在肾小球微血管的表达和PKC-β 亚基表达;恢复 PKA 在肾小球的表达。
另外,我们在实验中发现,胰岛素治疗虽然能够降低糖尿病 GK 大鼠的血糖,但不减少 24 小时尿蛋白和白蛋白。形态学和免疫组织化学染色都显示,胰岛素治疗对糖尿病 GK 大鼠肾小球的病理改变没有明显的改善作用。这一结果提示,外源性的胰岛素由于缺乏 C 肽,对糖尿病肾病没有明显的治疗作用,另一方面,外源性胰岛素的应用可以通过反馈机制抑制内源性胰岛素的产生,导致 C肽水平的进一步降低,对糖尿病肾病产生不利的影响。
综上所述,我们的研究表明:C 肽能够明显改善糖尿病肾病肾小球的微血管病理改变;C 肽可能通过下调肾小球微血管 RAGE 以及 PKC-β 的表达,上调 PKA 的表达从而减少糖尿病肾病大鼠的尿蛋白排泄。
[1]Yang SH, Dou KF, Song WJ.Prevalence of diabetes among men and women in China.N Engl J Med, 2010, 362(25):2425-2426.
[2]Fioretto P, Mauer M.Histopathology of diabetic nephropathy.Semin Nephrol, 2007, 7(2):195-207.
[3]Molitch ME, Defronzo RA, Franz MJ, et al.Nephropathy in diabetes.Diabetes Care, 2004, 27 Suppl 1:S79-S83.
[4]Steiner DF, Clark JL, Nolan C, et al.Proinsulin and the biosynthesis of insulin.Recent Prog Horm Res, 1969, 25:207-282.
[5]Johansson BL, Borg K, Fernqvist-Forbes E, et al.Beneficial effects of C-peptide on incipient nephropathy and neuropathy in patients with Type 1 diabetes mellitus.Diabet Med, 2000, 17(3):181-189.
[6]Samnegård B, Jacobson SH, Jaremko G, et al.Effects of C-peptide on glomerular and renal size and renal function in diabetic rats.Kidney Int, 2001, 60(4):1258-1265.
[7]Wahren J, Ekberg K, Samnegård B, et al.C-peptide: a new potential in the treatment of diabetic nephropathy.Curr Diab Rep, 2001, 1(3):261-266.
[8]Rebsomen L, Khammar A, Raccah D, et al.C-Peptide effects on renal physiology and diabetes.Exp Diabetes Res, 2008, 2008:281536.
[9]Johansson BL, Borg K, Fernqvist-Forbes E, et al.Beneficial effects of C-peptide on incipient nephropathy and neuropathy in patients with Type 1 diabetes mellitus.Diabet Med, 2000, 17(3):181-189.
[10]Nordquist L, Shimada K, Ishii T, et al.Proinsulin C-peptide prevents type-1 diabetes-induced decrease of renal Na+-K+-ATPase alpha1-subunit in rats.Diabetes Metab Res Rev, 2010, 26(3):193-199.
[11]Nordquist L, Brown R, Fasching A, et al.Proinsulin C-peptide reduces diabetes-induced glomerular hyperfiltration via efferent arteriole dilation and inhibition of tubular sodium reabsorption.Am J Physiol Renal Physiol, 2009, 297(5):F1265-F1272.
[12]Effect of intensive therapy on the development and progression of diabetic nephropathy in the Diabetes Control and Complications Trial.The Diabetes Control and Complications (DCCT) Research Group.Kidney Int, 1995, 47(6):1703-1720.
[13]Rudberg S, Osterby R, Dahlquist G, et al.Predictors of renal morphological changes in the early stage of microalbuminuria in adolescents with IDDM.Diabetes Care, 1997, 20(3):265-271.
[14]Araki S, Haneda M, Koya D, et al.Clinical impact of reducing microalbuminuria in patients with type 2 diabetes mellitus.Diabetes Res Clin Pract, 2008, 82 Suppl 1:S54-S58.
[15]Huber TB, Benzing T.The slit diaphragm: a signaling platform to regulate podocyte function.Curr Opin Nephrol Hypertens, 2005,14(3):211-216.
[16]Iglesias-de la Cruz MC, Ziyadeh FN, Isono M, et al.Effects of high glucose and TGF-beta1 on the expression of collagen IV and vascular endothelial growth factor in mouse podocytes.Kidney Int, 2002,62(3):901-913.
[17]Degenhardt TP, Thorpe SR, Baynes JW.Chemical modification of proteins by methylglyoxal.Cell Mol Biol (Noisy-le-grand), 1998,44(7):1139-1145.
[18]Brownlee M.Biochemistry and molecular cell biology of diabetic complications.Nature, 2001, 414(6865):813-820.
[19]Noh H, King GL.The role of protein kinase C activation in diabetic nephropathy.Kidney Int Suppl, 2007(106):S49-S53.
[20]Steinberg SF.Structural basis of protein kinase C isoform function.Physiol Rev, 2008, 88(4):1341-1378.
[21]Ohshiro Y, Ma RC, Yasuda Y, et al.Reduction of diabetes-induced oxidative stress, fibrotic cytokine expression, and renal dysfunction in protein kinase Cbeta-null mice.Diabetes, 2006, 55(11):3112-3120.
[22]Scheurich P, Kobrich G, Pfizenmaier K.Antagonistic control of tumor necrosis factor receptors by protein kinases A and C.Enhancement of TNF receptor synthesis by protein kinase A and transmodulation of receptors by protein kinase C.J Exp Med, 1989, 170(3):947-958.
[23]Oeseburg H, de Boer RA, Buikema H, et al.Glucagon-like peptide 1 prevents reactive oxygen species-induced endothelial cell senescence through the activation of protein kinase A.Arterioscler Thromb Vasc Biol, 2010, 30(7):1407-1414.
