注射用头孢拉宗钠的体内外抗菌活性研究
2011-06-08白小刚胡辛欣李聪然杨信怡张伟新娄人慧游雪甫
白小刚,胡辛欣,李聪然,杨信怡,张伟新,娄人慧,游雪甫
头孢拉宗(cefbuperazone)是由日本富山化学工业制药株式会社于 20世纪 70年代开发,并于1985年上市的第三代头孢类广谱抗生素,其作用机制与其他头孢菌素类抗生素相似,主要通过抑制细菌细胞壁的合成从而发挥杀菌作用[1-2]。头孢拉宗在国外已有多年临床应用经验,其安全性和有效性已得到充分的验证,具有穿透力强、体内分布广的优点,在诸多部位均可达到有效治疗浓度[1-2]。目前我国也已有厂家对该产品进行研发和生产[3]。因此,为评价国产头孢拉宗的抗菌活性,本实验以头孢美唑、头孢西丁、头孢替坦、头孢米诺、头孢唑啉、头孢呋辛、头孢哌酮、头孢吡肟为对照,对国产头孢拉宗的体内外抗菌活性进行比较研究。
1 材料与方法
1.1 材料
1.1.1 实验药物 注射用头孢拉宗钠购自桂林南药股份有限公司;注射用头孢美唑钠购自日本第一三共普乐发株式会社(Daiichi Sankyo Propharma Co., Ltd.);注射用头孢西丁钠购自海口市制药厂有限公司;注射用头孢替坦二钠购自重庆市庆余堂制药有限公司;注射用头孢米诺钠购自江西东风药业股份有限公司;注射用头孢唑啉钠购自华北制药股份有限公司;头孢呋辛购自中国药品生物制品检定所;注射用头孢哌酮钠购自丽珠集团丽珠制药厂;注射用盐酸头孢吡肟购自悦康药业集团有限公司。
1.1.2 培养基和试剂 MH 琼脂培养基、中国蓝琼脂培养基购自中国药品生物制品检定所;MH 肉汤培养基、脑心浸液培养基购自美国 Difco 公司;Nitrocephin 纸片购自法国梅里埃公司;高活性干酵母购自广州丹宝利有限公司。
1.1.3 实验菌株 受试菌株为2008 – 2009年间自北京地区医院收集的 20 种共 663株临床分离致病菌(其中革兰阳性菌 146株,革兰阴性菌517株,产 β-内酰胺酶菌株共 535株),包括金黄色葡萄球菌 37株[产 β-内酰胺酶菌株 34株,耐甲氧西林金黄色葡萄球菌(MRSA)16株]、表皮葡萄球菌 35株[产 β-内酰胺酶菌株 8株,耐甲氧西林表皮葡萄球菌(MRSE)17株]、化脓链球菌18株、肺炎链球菌 19株、粪肠球菌 18株(产β-内酰胺酶菌株 1株)、屎肠球菌 19株、大肠埃希菌 55株[均为产 β-内酰胺酶菌株,其中产超广谱 β-内酰胺酶(ESBLs)菌株 26株]、肺炎克雷伯杆菌 56株(均为产 β-内酰胺酶菌株,其中产ESBLs 菌株 26株)、铜绿假单胞菌 37株(均为产 β-内酰胺酶菌株)、鲍曼不动杆菌 37株(均为产 β-内酰胺酶菌株)、奇异变形杆菌 37株(产β-内酰胺酶菌株 22株)、普通变形杆菌 37株(产β-内酰胺酶菌株 36株)、阴沟肠杆菌 37株(均为产 β-内酰胺酶菌株)、产气肠杆菌 37株(均为产β-内酰胺酶菌株)、聚团肠杆菌 17株(产 β-内酰胺酶菌株 16株)、弗劳地枸橼酸杆菌 37株(均为产 β-内酰胺酶菌株)、异型枸橼酸杆菌 37株(产β-内酰胺酶菌株 36株)、雷极普鲁菲登杆菌 19株(均为产 β-内酰胺酶菌株)、摩根摩根菌 37株(产β-内酰胺酶菌株 33株)和黏质沙雷菌 37株(均为产 β-内酰胺酶菌株)。质控菌株选用金黄色葡萄球菌 ATCC29213、肺炎链球菌 ATCC49619、粪肠球菌 ATCC29212、大肠埃希菌 ATCC25922、ATCC35218 和肺炎克雷伯杆菌 ATCC700603、铜绿假单胞菌 ATCC27853,所有质控菌株均购自美国模式培养物集存库(ATCC),且最低抑菌浓度(MIC)均在美国临床实验室标准化协会(CLSI)规定范围内。细菌 β-内酰胺酶鉴定采用Nitrocephin 纸片法,并按照 CLSI[4]规定方法鉴定细菌 ESBLs。
1.1.4 实验动物 外观健康 ICR 小鼠 720 只,雌雄各半,4~5 周龄,体重 18~22 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2007-0001。实验前 1 天预养以适应环境。
1.2 方法
1.2.1 MIC 测定 参照 CLSI[5]标准方法,采用平皿二倍稀释法和 Denley 多点接种器进行药敏实验。药物用 MH 肉汤培养基进行二倍稀释,使其终浓度依次为0.03~128 μg/ml,将适量各梯度浓度药物分别加入平皿中,与 MH 琼脂培养基混匀。以多点接种器接种实验菌(接种量为1×104cfu/点),接种后置 35℃恒温培养 18 h 观察结果,无菌生长的平皿中所含药物的最小浓度即为MIC。
1.2.2 最低杀菌浓度(MBC)测定 选取金黄色葡萄球菌 12株、大肠埃希菌 13株、肺炎克雷伯杆菌 12株为实验菌,采用试管二倍稀释法确定各实验菌的 MIC(接种量为5×105cfu/ml)后,依次吸取未见细菌生长各管的培养液各 0.1 ml,转移到不含抗生素的琼脂平皿中,置 35℃恒温培养18 h 观察结果,菌落数小于 50 个(至少 99.9%接种菌被杀死)的平皿中所含最低药物浓度即为MBC。
1.2.3 杀菌曲线(KCs)测定 以金黄色葡萄球菌ATCC29213、大肠埃希菌 ATCC25922 为实验菌,过夜培养后分别接种于 MH 琼脂培养基中(接种量为1×105cfu/ml),35℃培养 30min 后加入头孢拉宗钠注射液,调整药物的终浓度分别为8 MIC、4 MIC、2 MIC、1 MIC、0.5 MIC、0(空白对照组),置 35℃继续培养,并分别在培养 2、4、6、8、12、24 h 时取样,于营养琼脂平板上计活菌落数,绘制时间-菌落数对数曲线即 KCs。
1.2.4 诱导耐药实验 以金黄色葡萄球菌ATCC29213、金黄色葡萄球菌 15、大肠埃希菌ATCC25922、大肠埃希菌 1515、肺炎克雷伯杆菌ATCC700603、肺炎克雷伯杆菌 7 为实验菌,选取头孢美唑、头孢西丁、头孢替坦和头孢米诺作为对照药物。以各抗生素对受试菌株的 1/4 MIC 每天转种,诱导 20 d,并于诱导第4、8、12、16、20 天时,采用金黄色葡萄球菌 MH 肉汤微稀释法测定抗生素对各菌株的 MIC,观察药物对受试菌的诱导耐药情况。
1.2.5 体内抗菌活性测定 将 720 只 ICR 小鼠进行随机分组,每组 10 只。以大肠埃希菌ATCC25922、大肠埃希菌 1515、肺炎克雷伯杆菌9613、肺炎克雷伯杆菌 7、金黄色葡萄球菌 15 为感染菌,选取头孢美唑、头孢唑啉作为对照药物。用 5%高活性干酵母稀释受试菌株,于小鼠腹腔注入 100%最小致死量(MLD)的菌液 0.5 ml,实验组小鼠感染后 15min 和 6 h 分别皮下给药2 次,空白对照组小鼠感染后不给药,观察 7 d 内小鼠的生存数量,并利用 Bliss 法[6]计算半数有效剂量(ED50)及其 95%可信区间,进行统计学处理。
给药方案:①大肠埃希菌 ATCC25922 感染量为1.3×106cfu/鼠,药物剂量分别为:头孢拉宗1.5、2、3、4.2、6 mg/kg,头孢美唑 25、35、50、70、100 mg/kg,头孢唑啉 3.5、5、7、10、14 mg/kg;②大肠埃希菌 1515 感染量为3.6×106cfu/鼠,药物剂量分别为:头孢拉宗 0.06、0.09、0.13、0.18、0.25 mg/kg,头孢美唑 2.5、3.5、5、7、10 mg/kg,头孢唑啉 2.5、3.5、5、7、10 mg/kg;③肺炎克雷伯杆菌 9613 感染量为7×106cfu/鼠,药物剂量分别为:头孢拉宗 0.18、0.25、0.35、0.5、0.7 mg/kg,头孢美唑 5、7、10、14、20 mg/kg,头孢唑啉 5、7、10、14、20 mg/kg;④肺炎克雷伯杆菌 7 感染量为7×105cfu/鼠,药物剂量分别为:头孢拉宗50、70、100、140、200 mg/kg,头孢美唑 1000 mg/kg,头孢唑啉 1000 mg/kg;⑤金黄色葡萄球菌 15 感染量为2.6×105cfu/鼠,药物剂量分别为:头孢拉宗50、70、100、140、200 mg/kg,头孢美唑 25、35、50、70、100 mg/kg,头孢唑啉 3.5、5、7、10、14 mg/kg。所有药物配制时均按实际活性药物计算浓度。
1.3 统计学处理
应用 SPSS 13.0 统计学软件进行数据处理,组间检测结果的比较采用 LSD 法,以P<0.05 为差异有统计学意义。
2 结果
2.1 临床分离菌的 MIC 分布
体外 MIC 测定结果表明,注射用头孢拉宗钠具有广谱抗菌活性,对 663株临床分离菌均有不同程度的抗菌作用,其中对 146株革兰阳性菌的抗菌活性较弱,对 517株革兰阴性菌普遍具有较强的抗菌作用(表1)。
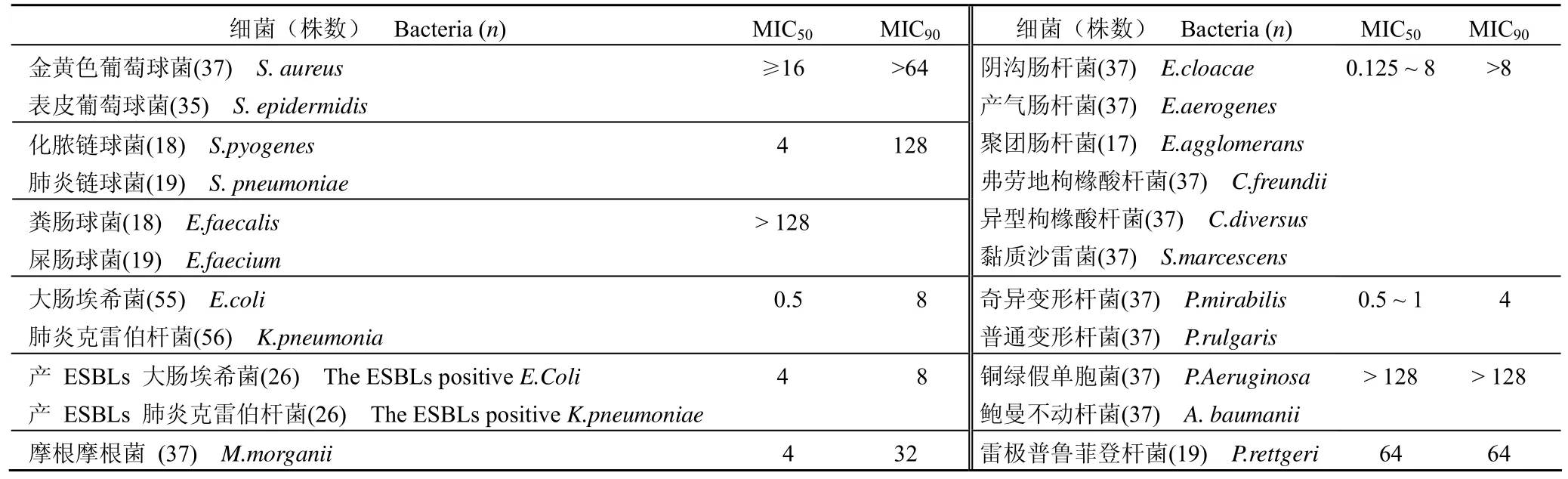
表1 头孢拉宗对 663株临床分离菌的体外抗菌活性(MIC,μg/ml)Table 1 The antibacterial activity of cefbuperazone against 663 clinical isolated bacteria in vitro (MIC, μg/ml)
头孢拉宗对革兰阳性菌,包括耐甲氧西林金黄色葡萄球菌(MRSA)、耐甲氧西林表皮葡萄球菌(MRSE)的抗菌活性较弱,MIC50值在 16 μg/ml以上,抗菌活性与头孢米诺、头孢替坦相近。对粪肠球菌和屎肠球菌的抗菌活性弱,MIC50值均大于128 μg/ml,抗菌活性与其他同类受试药物相近。
头孢拉宗对多种革兰阴性菌均具有较高的抗菌活性。其中对大肠埃希菌、肺炎克雷伯杆菌及其产 ESBLs 菌株的抗菌活性较强,MIC90值均为8 μg/ml,抗菌活性与头孢替坦和头孢米诺相近,较头孢吡肟和头孢西丁强 2~8 倍,明显优于头孢呋辛、头孢唑啉和头孢哌酮。对肠杆菌的抗菌活性较强,MIC50值在 0.125~8 μg/ml 范围内,MIC90值在 8 μg/ml以上,抗菌活性较头孢替坦、头孢呋辛和头孢哌酮强 2~32 倍,明显优于头孢美唑、头孢西丁、头孢米诺和头孢唑啉,弱于头孢吡肟;但对雷极普鲁菲登杆菌的抗菌活性较弱,MIC50、MIC90值均为64 μg/ml,抗菌活性略优于头孢西丁、头孢哌酮、头孢唑啉和头孢呋辛,弱于头孢米诺、头孢吡肟、头孢替坦和头孢美唑 4~32 倍。
头孢拉宗对铜绿假单胞菌和鲍曼不动杆菌等非发酵杆菌抗菌活性较弱,MIC50、MIC90值均大于 128 μg/ml,与多数其他同类受试药物相近,其中对铜绿假单胞菌的抗菌活性弱于头孢哌酮和头孢吡肟,对鲍曼不动杆菌的抗菌活性稍弱于头孢米诺和头孢吡肟。
2.2 最低杀菌浓度(MBC)
注射用头孢拉宗钠对 12株金黄色葡萄球菌的 MBC50/MIC50、MBC90/MIC90比值均为2,对13株大肠埃希菌和 12株肺炎克雷伯杆菌的MBC50/MIC50、MBC90/MIC90比值均为1(表2)。
2.3 杀菌曲线(KCs)
头孢拉宗钠注射液对大肠埃希菌 ATCC25922、金黄色葡萄球菌 ATCC29213 的杀菌曲线测定结果见图1、图2。
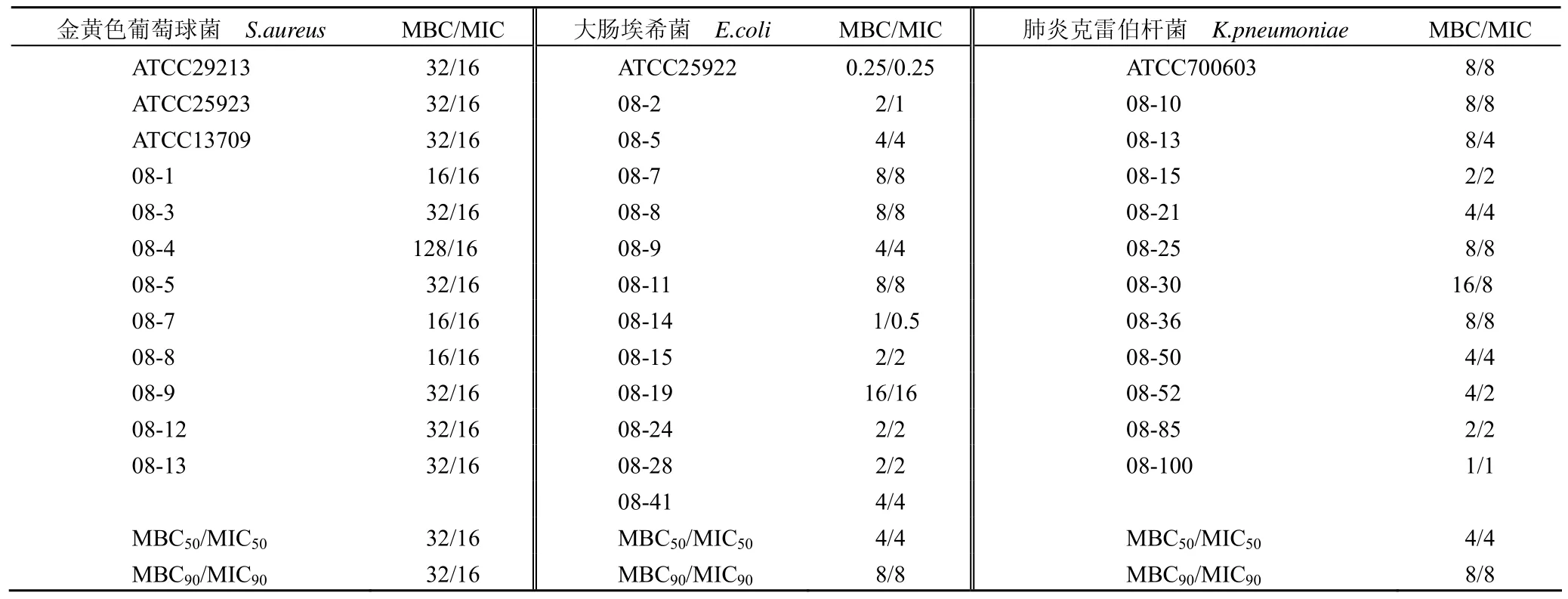
表2 头孢拉宗对金黄色葡萄球菌、大肠埃希菌和肺炎克雷伯杆菌的 MBC/MIC 比较Table 2 MBC/MIC of cefbuperazone against E.coli, K.pneumoniae and S.aureus
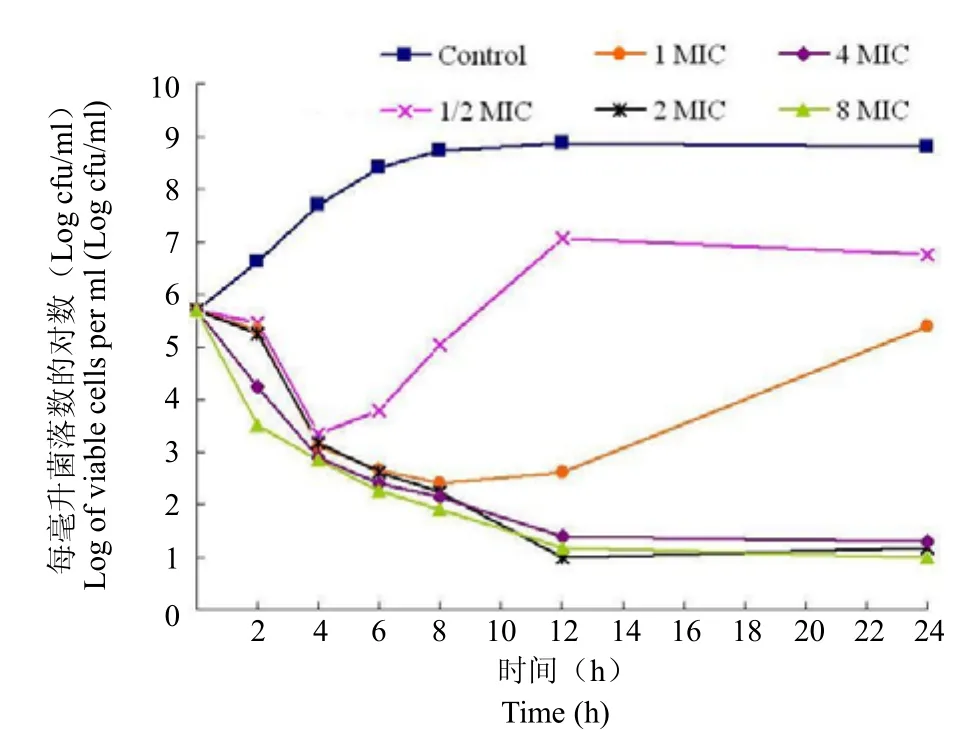
图1 头孢拉宗对大肠埃希菌 ATCC25922 的杀菌活性Figure 1 The antibacterial activities of cefbuperazone against E.col ATCC25922
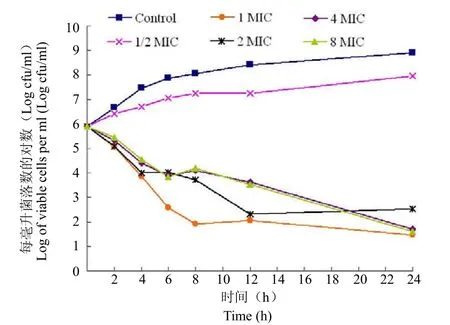
图2 头孢拉宗对金黄色葡萄球菌 ATCC29213 的杀菌活性Figure 2 The antibacterial activities of cefbuperazone against S.aureus ATCC29213
2.4 诱导耐药实验
诱导耐药实验结果表明,分别以 1/4 MIC 剂量诱导 20 d 后,头孢拉宗及其对照药对金黄色葡萄球菌、大肠埃希菌和肺炎克雷伯杆菌的抗菌活性无明显改变(表3)。
2.5 体内抗菌活性
头孢拉宗及其对照药皮下给药对感染小鼠的体内疗效结果显示,头孢拉宗对金黄色葡萄球菌15 感染小鼠的体内疗效与头孢美唑相近(P>0.05),但弱于头孢唑啉(P<0.01);头孢拉宗对大肠埃希菌 ATCC25922、大肠埃希菌 1515、肺炎克雷伯杆菌 9613、肺炎克雷伯杆菌 7 感染小鼠的体内疗效明显优于头孢美唑和头孢唑啉(均P<0.01,表4)。
3 讨论
头孢拉宗,又名头孢拉宗钠、头孢布宗钠、乙氧哌甲氧头孢菌素钠等,其化学名称为(6R, 7S)-7-[(2R, 3S)-2-(4-乙基 2, 3-二氧代-1-哌嗪甲酰氨基)-3-羟基丁酰氨基]-7-甲氧基-3-{[(1-甲基-1H-四唑-5-基)硫]甲基}-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸,属第三代头孢类抗生素,具有广谱的抗菌活性,对革兰阳性、革兰阴性细菌和厌氧菌均有作用,其中对厌氧菌作用优于一般第三代头孢菌素类抗生素。此外,7 位甲氧基的引入使得头孢拉宗对 β-内酰胺酶的稳定性增加,且优于多数同类品种[1-2],而本研究结果也证实,头孢拉宗对产 β-内酰胺酶菌株具有较强的抗菌作用。
本研究表明,头孢拉宗对革兰阴性菌特别是大肠埃希菌和肺炎克雷伯杆菌具有较强的抗菌作用,对革兰阳性菌的抗菌作用较弱。除铜绿假单胞菌、雷极普鲁菲登杆菌和鲍曼不动杆菌外,头孢拉宗对大肠埃希菌(包括产 ESBLs 大肠埃希菌)、肺炎克雷伯杆菌(包括产 ESBLs 肺炎克雷伯杆菌)、奇异变形杆菌、普通变形杆菌、产气肠杆菌、阴沟肠杆菌、聚团肠杆菌、弗劳地枸橼酸杆菌、异型枸橼酸
杆菌、摩根摩根菌和黏质沙雷菌均具有较强的抗菌活性,其对革兰阴性菌的体外抗菌活性大多优于头孢西丁、头孢美唑、头孢唑啉、头孢哌酮、头孢替坦和头孢呋辛,但稍弱于头孢吡肟;对革兰阳性菌的体外抗菌活性与头孢替坦和头孢米诺相近。MBC和 KCs 测定结果表明,头孢拉宗对金黄色葡萄球菌、大肠埃希菌、肺炎克雷伯杆菌均呈现杀菌作用,且以 1/4 MIC 剂量诱导 20 d 对其抗金黄色葡萄球菌、大肠埃希菌和肺炎克雷伯杆菌的活性无明显影响。头孢拉宗皮下给药对大肠埃希菌、肺炎克雷伯杆菌、金黄色葡萄球菌腹腔感染小鼠具有较好的体内抗菌活性,对大肠埃希菌 ATCC25922、大肠埃希菌 1515、肺炎克雷伯杆菌 7、肺炎克雷伯杆菌 9613 感染小鼠的体内疗效明显优于头孢美唑和头孢唑啉,对金黄色葡萄球菌 15 感染小鼠的体内疗效与头孢美唑相近,弱于头孢唑啉。
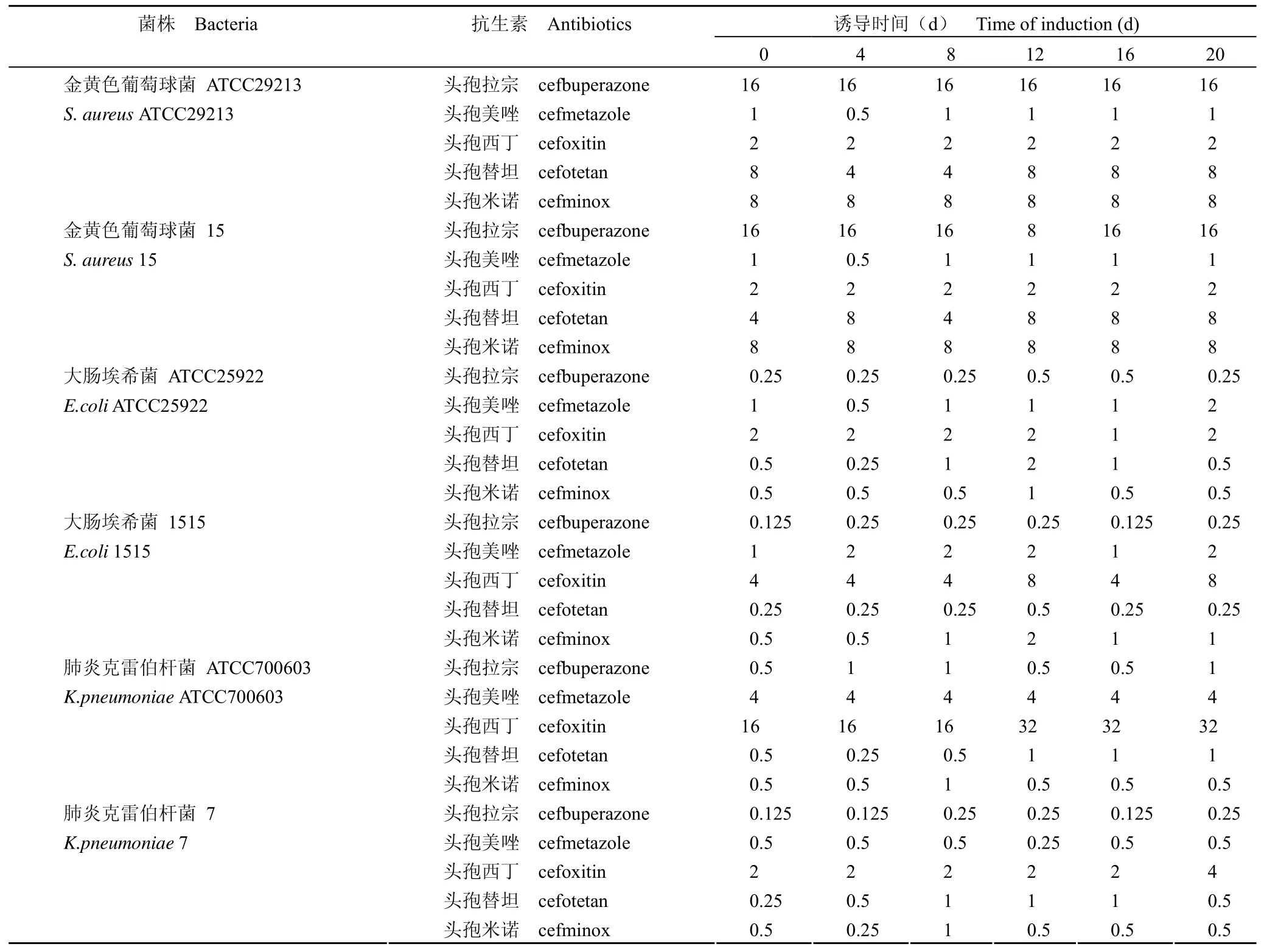
表3 头孢拉宗及其对照药的体外诱导耐药实验结果(MIC,µg/ml)Table 3 In vitro induction of resistance to cefbuperazone and control drugs (MIC, µg/ml)
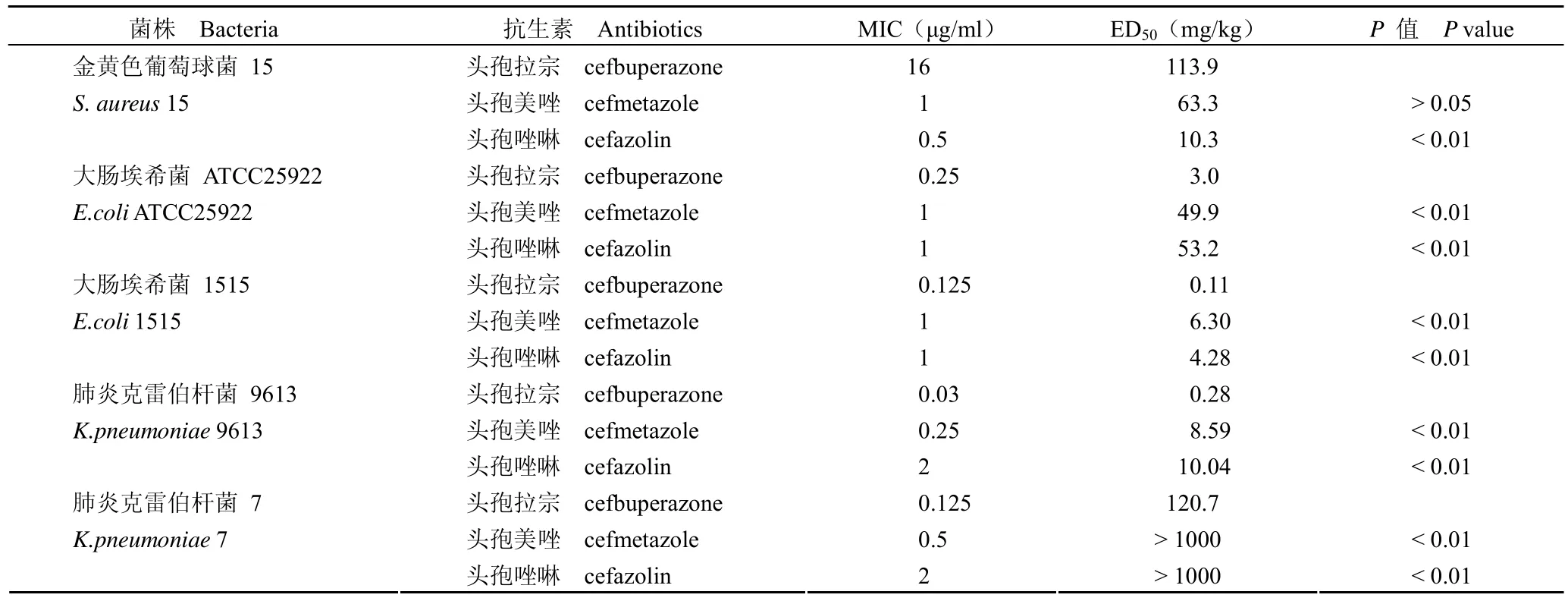
表4 头孢拉宗及其对照药皮下给药对感染小鼠的体内疗效比较Table 4 Effects on systemically infected mice of cefbuperazone and control drugs given by subcutaneous
综上,本研究对照多种其他同类药物,研究证实了国产头孢拉宗具有较强的体内外抗菌活性,为该药物的开发和应用提供了依据。
[1]Takano S, Takakura I, Ochiai H, et al.Studies on beta-lactam antibiotics for medicinal purpose.XIII.Synthesis and structureactivity relationships of 7 beta-[alpha-(4-alkyl-2,3-dioxo-1-piperazinecarboxamido)-alpha-substituted acetamido]-7 alphamethoxycephalosporanic acids.Yakugaku Zasshi, 1982, 102(7):629-645.
[2]Taki H, Yasuda T, Ochiai H, et al.7-alpha-methoxycephalosporins and pharmaceutical composition comprising the same: US, 4263292.1981-04-21.
[3]Ci ZM, Fucm, Cui MQ, et al.Synthesis of cefbuperazone.J Chengdu Univ (Nat Sc Ed), 2009, 28(3):199-201.(in Chinese)慈志敏, 付超美, 崔名全, 等.头孢拉宗的合成.成都大学学报(自然科学版), 2009, 28(3):199-201.
[4]Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing; sixteenth informational supplement.2006, 26(3):M100-S16.
[5]Clinical and Laboratory Standards Institute.Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically;approved standard-seventh edition.2006, 26(2):M7-A7.
[6]Zhang WG, Lin FS, Li BB.Calculations and procedures of Pharmacolog.Beijing: People’s Medical Publishing House, 1988:351.(in Chinese)张文贵, 林福生, 李北波.药理学计算与程序.北京: 人民卫生出版社, 1988:351.
