应用凝集素芯片检测细胞膜表面糖链种属特异性
2011-06-08马汝海王天骄潘忠诚何群
马汝海,王天骄,潘忠诚,何群
细胞膜表面糖复合物在构建复杂的多细胞器官和生物体中担任特别重要的角色,参与细胞之间以及细胞与其基质之间的相互作用,这些相互作用是多细胞生物发育和生物功能的关键环节[1]。
多细胞的个体发育和各种类型细胞的活化与聚糖结构改变有着密切联系,基于这一方面已经有大量文献报道。人们已经意识到在哺乳动物胚胎发育以及细胞活化过程中会发生细胞表面的糖基化改变,认为糖基化可参与细胞黏附、受体活化、细胞分化以及组织形态发生。但是关于在不同的相关物种中,相同糖蛋白是否具有相同类型的糖基化、相同的组织细胞膜是否具有相同类型的糖链这方面报道尚不多。
凝集素(lectin)是一类糖结合蛋白,能专一地识别单糖或寡糖中特定的糖基序列并与之结合,常用于寡糖和糖复合物的分离纯化和糖链的结构分析[2]。在本研究中,我们用构建的凝集素芯片分别对小鼠和兔的细胞膜表面糖链类型进行了检测,提取相同组织细胞并进行荧光标记,利用凝集素与糖链的亲和性捕获细胞,激光扫描仪扫描检测捕获细胞的凝集素位点,根据捕获得到的细胞膜表面糖链与凝集素特异亲和性的不同确定不同组织细胞膜的糖链类型[3],以探求不同物种间相同组织细胞膜的糖链特异性。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性健康 C57 小鼠,均为6 周龄,体重 20~24 g;雌性健康大耳白兔,均为13 周龄,平均体重 2100 g。小鼠和白兔均购自于中国医科大学实验动物部,饲养条件均符合国家SPF 级标准。
1.1.2 试剂 凝集素、牛血清白蛋白(BSA)、酪蛋白、戊二醛均购自美国 Sigma 公司;RPMI 1640培养液购自南京凯基生物科技发展有限公司;红细胞裂解液(ELS)、HE 染色液和吖啶橙购自北京赛驰生物科技有限公司;硅烷耦联剂(3-氨丙基三甲氧基硅烷)SCA-1103 购自国泰华荣化工新材料有限公司。
1.1.3 仪器 MGⅡ600 生物芯片点样仪为英国BioRobiotics 公司产品;Gene TACTMLS IV 激光扫描仪为美国 Genomic Solutions 公司产品;低温离心机为美国 Sigma 公司产品;ECLIPSE 80i 荧光显微镜为日本 Nikon 公司产品。
1.2 方法
1.2.1 凝集素芯片的制备 凝集素芯片的具体制备方法参考文献[3]。选择 22 种凝集素,利用MicroGridⅡ600 生物芯片点样仪在芯片上制备凝集素点阵(图1),每个位点均设 2 个平行点。选用 BSA 为阴性质控,选用马铃薯凝集素(STL)为阳性质控。点样后将芯片置于 37℃湿盒内水化30min,4℃冰箱存储备用。凝集素及其糖链亲和特异性见表1。
1.2.2 组织细胞悬液的制备 无菌条件下分别取10 只 C57 小鼠和 5 只大耳白兔的肝、脾、肾组织,以含有肝素的 D-hank 液清洗后剪碎,加入浓度为0.25%的胶原酶 IV,37℃水浴消化 1 h,170×g离心 8min,弃上清,加入红细胞裂解液去除红细胞,170×g离心 5min,收集沉淀,D-hank液重悬细胞,加入吖啶橙染色 5min,170×g离心5min,弃上清,以 RPMI 1640 培养液洗涤 2 次,并调整细胞的终浓度为1×105个/ml。
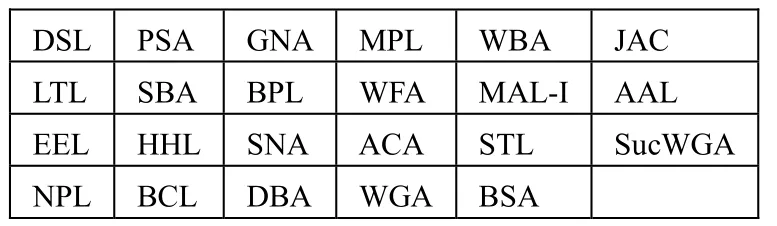
图1 凝集素芯片布阵图Figure 1 Layout of lectin microarray
1.2.3 凝集素亲和性检测 取出点样制备的凝集素芯片,37℃湿盒内水化 15min,加入浓度为0.5%的酪蛋白溶液(含 0.01 mol/L PB,pH7.2)封闭 5min,再以 0.01 mol/L 的 PB 缓冲液(pH7.2)洗涤 5min 后吹干。将制备的细胞悬液分别滴加至芯片上,37℃孵育 40min,以 0.01 mol/L PBS(pH 7.2)缓冲液洗涤 5min,加入浓度为3%的戊二醛(含 0.01 mol/L PBS,pH 7.2)固定 10min。Gene TACTMLS IV 激光扫描仪检测芯片中各凝集素位点的荧光信号强度,行 HE 染色后于 ECLIPSE 80i荧光显微镜下观察各凝集素位点所捕获的细胞形态。
1.2.4 不同胶原酶消化的影响 制备组织细胞悬液时,分别用 0.25%的胶原酶 I、II 代替胶原酶Ⅳ 对组织进行消化,同样利用凝集素芯片检测各凝集素位点的荧光信号强度,观察不同胶原酶消化对检测结果的影响。

表1 凝集素的组织来源及其糖链亲和特异性Table 1 Tissue origin and glycoprofiles binding specificities of lectins
2 结果
2.1 小鼠和兔肝、脾、肾细胞膜表面糖链的凝集素芯片检测
对 10 只小鼠和 5 只大耳白兔不同组织细胞膜表面糖链检测的结果显示,小鼠和兔相同组织细胞膜表面糖链类型基本相同,仅个别凝集素位点略有不同。其中,在 GNA、LTL、HHL、NPL 位点,兔脾细胞检测结果均为阴性,小鼠脾细胞检测结果均为阳性。在 BPL、WFA 位点,兔肾细胞检测结果均为阴性,小鼠肾细胞检测结果均为阳性;而在MAL-I 位点,兔肾细胞检测结果为阳性,小鼠肾细胞检测结果为阴性。在 MPL、WBA、LTL、SBA、BPL、WFA、MAL-I、AAL、BCL 位点,兔肝细胞检测结果均为阳性,小鼠肝细胞检测结果均为阴性;而在 NPL 位点,小鼠肝细胞检测结果为阳性,兔肝细胞检测结果为阴性。在 DSL、STL 位点,小鼠和兔各组织细胞检测结果均为阳性;而在EEL、DBA 位点,小鼠和兔各组织细胞检测结果均为阴性(表2、图2)。

表2 小鼠和兔肝、脾、肾组织细胞膜表面糖链的凝集素芯片检测结果Table 2 The test results of glycoprofiles on the liver,spleen, kidney tissue cells surface of mice and rabbits by lectin microarray
2.2 不同胶原酶消化对检测结果的影响
在 GNA 位点,兔脾组织分别经 3 种胶原酶消化后捕获的细胞数目存在差异,经胶原酶 II 消化后可见极少量细胞,而经其他两种胶原酶消化后则未见捕获细胞。兔肾组织以及小鼠的脾和肾组织经不同胶原酶消化后,检测结果无明显差异,仅个别凝集素位点捕获细胞数略有差别。在 BCL 位点,兔肝组织经胶原酶 IV 消化后捕获细胞最多,经胶原酶 II 消化后捕获细胞较少,经胶原酶 I 消化后仅捕获少量细胞。上述结果提示不同胶原酶消化可影响细胞膜表面个别糖链的特性。
3 讨论
细胞膜表面含有丰富的糖复合物,在细胞连接、细胞识别、免疫应答、信号传递中起着重要作用。在细胞识别方面,这些糖复合物具有两类生物学功能:①被同一个体的内源受体所识别;②被其他生物体所识别,多数病原生物体必须要首先通过识别靶细胞表面的聚糖序列从而结合靶细胞。糖复合物的这两类识别功能必然受到不同类型和速率的进化选择压力,在有些种内和种间存在糖基化变异,其中比较典型者即为ABO 血型系统[4-5]。
凝集素芯片的建立为细胞膜表面糖链的通量、快速检测建立了一个平台[6-8]。本实验选择了 22 种凝集素制备凝集素芯片,对小鼠和兔的脾、肾、肝组织细胞膜表面糖链进行通量检测,为了避免年龄引起的细胞膜糖链的差异,本实验选用的均为6 周龄小鼠和成年大耳白兔。检测结果显示,小鼠和兔相同组织的细胞膜表面糖链类型基本相同,提示相同组织细胞膜表面糖链具有其保守性,这可能与组织分化及其功能密切相关。但小鼠和兔相同组织细胞膜表面糖链也存在其特异性,对于兔脾细胞,在 LTL(α-L-Fuc)、GNA(α1, 3Man not Glc)、HHL(α1, 3Man)和 NPL(α1, 6Man)位点均为阴性,而小鼠脾细胞在这些位点的检测结果均为阳性,提示小鼠脾细胞膜表面含有少量的甘露糖糖链成分,兔脾细胞则没有。兔肾细胞只有在 DSL、AAL、MAL-I、STL 位点均为阳性,对应凝集素的糖链亲和特异性,兔肾细胞膜表面糖链以 GlcNAc为主;而小鼠肾细胞在 DSL、BPL、WFA、AAL、STL 位点均为阳性,对应凝集素的糖链亲和特异性,小鼠与兔肾细胞膜表面的共有糖链为GlcNAc;此外,小鼠肾细胞膜表面还表达 GalNAc 型糖链,兔肾细胞在 MAL-I(Glcβ1, 4GalNAc)位点为阳性,提示小鼠和兔肾细胞膜表面 GalNAc 型糖链在末端支链细节存在差别。小鼠和兔的肝细胞膜表面糖链类型差异较大,兔肝细胞表面呈现大量的GalNAc 型糖链和岩藻糖糖链,而小鼠肝细胞表面GalNAc 型糖链呈阴性,但有 Man 型糖链表达。STL 与 GlcNAc 型糖链具有特异的亲和性,GlcNAc化蛋白是细胞骨架蛋白,参与细胞骨架和膜结构,在本实验中我们将 STL 作为阳性对照,检测结果显示,所有组织细胞在 STL 位点检测均为阳性,证实了这些组织细胞膜表面共表达 GlcNAc 型糖蛋白。而在作为阴性质控的无糖链特异亲和性的BSA 位点,所有组织细胞的检测结果均为阴性。
α1, 3Gal 抗原表位是由 2-型糖脂与对应糖蛋白在特异的 α1, 3 半乳糖基转移酶的作用下合成而成,但该抗原及与其对应的 α1, 3 半乳糖基转移酶在包括人类在内的旧大陆灵长类的细胞和组织中多数不存在。在本实验中,小鼠和兔各组织细胞膜表面糖链的检测结果显示,两者在 EEL 凝集素位点均为阴性,证实了小鼠和兔各组织细胞膜表面无 α1, 3Gal 糖链表达。
不同物种同一类型细胞膜表面相同糖链结构的固定表达可意味其重要的内源性功能,而糖链结构的变异也可能与种群免疫相关[9]。了解不同物种之间同一类型细胞膜表面糖复合物的差异,可更加系统地进行糖生物学比较,对于预测内源聚糖的功能、糖复合物在种群之间的免疫识别有一定帮助。
[1]Pilobello KT, Mahal LK.Deciphering the glycocode: the complexity and analytical challenge of glycomics.Curr Opin Chem Biol, 2007,11(3):300-305.
[2]Gemeiner P, Mislovicová D, Tkác J, et al.Lectinomics II.A highway to biomedical/clinical diagnostics.Biotechnol Adv, 2009, 27(1):1-15.
[3]He Q, Song CY, Zhang Y, et al.Preparation of lectin microarray and cell surface glycome profiling.J China Med Univ, 2008, 37(5):577-579.(in Chinese)何群, 宋春阳, 张艳, 等.细胞膜表面糖识别芯片的制备及其初步应用.中国医科大学学报, 2008, 37(5):577-579.
[4]Gagneux P, Varki A.Evolutionary considerations in relating oligosaccharide diversity to biological function.Glycobiology, 1999,9(8):747-755.
[5]Martinko JM, Vincek V, Klein D, et al.Primate ABO glycosyltransferases: evidence for trans-species evolution.Immunogenetics, 1993, 37(4):274-278.
[6]Angeloni S, Ridet JL, Kusy N, et al.Glycoprofiling with micro-arrays of glucoconjugates and lectins.Glycobiology, 2005, 15(1):31-41.
[7]Pilobello KT, Slawek DE, Mahal LK, et al.A ratiometric lectin microarray approach to analysis of the dynamic mammalian glycome.Proc Natl Acad Sci U S A , 2007, 104(28):11534-11539.
[8]He Q, Li CH, Pan ZC, et al.Glycoprofiling investigation of hepatocellular carcinoma cell surface with lectin microarray.Prog Biochem Biophys, 2010, 37(3):269-277.(in Chinese)何群, 李春辉, 潘忠诚, 等.应用凝集素芯片检测肝癌细胞膜表面糖链变化.生物化学与生物物理进展, 2010, 37(3):269-277.
[9]Wills C, Green DR.A geneic herd-immunity model for the maintenance of MHC poly morphism.Immunol Rev, 1995, 143:263-292.
