禽Ⅰ群腺病毒血清1型株灭活疫苗的研制*
2011-05-31谢芝勋刘加波谢丽基庞耀珊邓显文谢志勤
韦 悠,谢芝勋,范 晴,刘加波,谢丽基,庞耀珊,邓显文,谢志勤
(1.广西大学动物科学技术学院,广西南宁 530005;2.广西兽医研究所 广西畜禽疫苗新技术重点实验室,广西南宁 530001)
禽I群腺病毒血清1型(Fowl adenovirus group I serum type 1,FAV-1)属腺病毒科,鸡腺病毒1型,归属腺病毒Ⅰ群,是其代表种。禽I群腺病毒感染以包涵体肝炎、再生障碍性贫血、呼吸道感染、出血性肠炎和产蛋量减少为主要特征,主要感染2周龄~8周龄的鸡。该病发生后的一大特点是病原复杂,感染率高,常与引起禽类呼吸道疾病的病原微生物混合感染,导致死亡率增加[1-4]。已经证明传染性法氏囊病毒可以增强禽I群腺病毒的致病性,鸡传染性贫血病毒也可以提高禽腺病毒引起肝炎和致死的能力。自1954年Ates等首次从鸡胚中分离到该病毒后,许多国家都先后报道了它的存在。陈溥言[5]的试验结果表明,FAV-1已污染我国研究用和疫苗生产用非免疫蛋,周斌等[6]检测结果也证实了这种污染的严重性。目前国内外均无商品化的禽Ⅰ群腺病毒疫苗,该病毒的防控仍较为薄弱。本研究所研制的灭活油乳剂疫苗将为FAV-1感染的防控提供技术保障,对养禽业的发展具有重要意义。
1 材料与方法
1.1 材料
1.1.1 病毒株、鸡胚和FAV-1阳性及阴性血清FAV-1种毒为中国兽医药品监察所产品;SPF鸡胚为北京梅里亚公司产品;FAV-1阳性血清、阴性血清均由广西兽医研究所生物技术实验室制备保存。
1.1.2 佐剂 10号注射用白油为中国石化集团杭州炼油厂产品;Tween-80及Span-80均为上海高维有限责任公司进口分装产品。
1.1.3 试验用动物 北京梅里亚公司的SPF来航鸡胚由本实验室自行孵化,饲养于SPF隔离器至3周龄。1月龄非免疫鸡三黄鸡、芦花鸡由广西南宁市某两家养禽场提供。
1.2 方法
1.2.1 FAV-1增殖培养条件的优化
1.2.1.1 最佳接种剂量 按基础种子批病毒TCID50分 别 为 104.4、105.4、106.4、107.4、108.4TCID50/mL将病毒通过绒毛尿囊膜接种于SPF鸡胚,37℃孵育96h后收获尿囊液。测定尿囊液中病毒粒子含量。
1.2.1.2 最佳收获时间 将基础种子批病毒(105.4TCID50/mL)通过尿囊膜接种于SPF鸡胚,37℃孵育48、72、96、120、144h后收获尿囊液,测定尿囊液量及尿囊液中病毒粒子含量。
1.2.2 灭活剂及灭活终浓度 将按谢芝勋方法[7-8]制备的抗原液(109.31、108.55、108.14TCID50/mL,病毒粒子 数 为108.74copies/mL)50mL 加 入 终 浓 度 为0.05、0.1、0.5、1、3、5mL/L的甲醛,置于37℃灭活16h。再将另50mL抗原液加入终浓度为1、0.5、0.25、0.125、0.06、0.03mL/L的β-丙内酯(β-propionolactone,BPL),置于20℃灭活16h。将灭活后的抗原液接种SPF鸡胚,盲传2代后检测是否有病毒增殖。
1.2.3 最佳成分比例的研究
1.2.3.1 亲油亲水平衡值的确定 按谢芝勋计算方法[9],制备亲油亲水平衡值(hydrophile-lipophile balance,HLB)分别为5.0、6.0、7.0、8.0的4组疫苗,置于4℃及20℃保存检测其稳定性。将4组疫苗分别免疫3周龄SPF鸡,每组10羽。测定其免疫后2、3、4、6、8周后的抗体水平,比较HLB值对抗体效价及稳定性的影响。
1.2.3.2 乳化剂含量的确定 按最佳HLB值的Span-80与Tween-80的比例,制备乳化剂含量分别为2.5%、5%、10%、15%的4组疫苗,置于4℃及20℃保存检测其稳定性。4组疫苗分别免疫3周龄SPF鸡,每组10羽。免疫后2、3、4、6、8周后测定抗体水平,比较不同乳化剂含量对稳定性及抗体水平的影响。
1.2.3.3 油水比的确定 按照最佳HLB及乳化剂含量,制备油水比分别为3∶1、4∶1、5∶1、9∶1的四组疫苗,同样进行稳定性试验。将4组疫苗分别免疫3周龄SPF鸡,每组10羽。比较其免疫后2、3、4、6、8周后的抗体水平。
1.2.4 灭活疫苗的乳化制备 按比例将抗原与灭菌Tween-80预混成水相;将白油与Span-80预混灭菌后为油相。使用ATS均质机,在500Pa的压力下进行切割混合3次,即为灭活疫苗成品。
1.2.5 疫苗性状检验
1.2.5.1 剂型检测 观察成品疫苗外观,将疫苗滴于盛有清洁冷水的平皿,观察疫苗滴扩散情况,判定其剂型。
1.2.5.2 稳定性 取灭活疫苗成品5mL离心3 000r/min 15min后,观察其外观性状,是否有分层及抗原析出现象。
1.2.5.3 黏度测定 用上口内径为2.7mm,下口内径为1.2mm的1mL玻璃吸管吸满25℃ 的1 mL成品疫苗,记录垂直释放出0.4mL所需要的时间。
1.2.5.4 无菌检验 将灭活过的抗原液、白油、乳化剂及制成的成品疫苗接种于普通LB肉汤、厌氧肉汤及普通琼脂、血液琼脂等培养基,分别放置37℃培养24h和25℃进行培养7d,观察有无微生物生长。
1.2.5.5 安全性检测 免疫3周龄SPF鸡5羽,每羽通过颈背部皮下注射疫苗2mL(4羽份),免疫14d后进行观察及解剖,记录是否出现由免疫注射引起的局部和全身反应。
1.2.5.6 保存期检测 3个批次疫苗分别保存于4℃、20℃及37℃,观察12个月。逐月观察其外观性状,记录其分层、析出情况。
1.2.5.7 最小免疫剂量试验 将3周龄SPF白航鸡分为7组,每组4羽。其中1~5组分别免疫FAV-1灭活苗25、50、100、250、500μL;第6组为不免疫攻毒对照组;第7组为空白对照组。在免疫后3周采集所有鸡的血清测定抗体水平,对1~6组的试验鸡进行攻毒,每羽鸡攻毒0.2mL FAV-1病毒液(108.14TCID50/mL, 病 毒 粒 子 数 为 108.74copies/mL)。于攻毒后3、5、7、10、14d分别采集咽喉及泄殖腔棉拭子,检验是否出现排毒。
1.2.6 疫苗免疫抗体水平的监测 将3周龄SPF白航鸡分为2组,每组20羽。第1组为免疫组,每羽鸡免疫本研究所制备的FAV-1灭活油乳剂疫苗0.5mL(含病毒粒子106.615copies);第2组为空白对照组,不进行免疫。于免疫前及免疫后的第2、3、4、6、8周分别采集每羽鸡的血清。采用FAV-1全病毒包被间接ELISA方法进行抗体水平测定。
1.2.7 免疫攻毒试验 将3周龄SPF白航鸡分为3组。第1组为免疫攻毒组,共20羽,每羽鸡免疫本研究所制备的FAV-1灭活油乳剂疫苗0.5mL(含病毒粒子106.615copies),在免疫后的第3周通过肌肉 注 射 0.1mL 的 FAV-1 病 毒 液 (108.14TCID50/mL,病毒粒子数为108.74copies/mL)进行攻毒。并于攻毒后的3、5、7、10、14d采集所有鸡的咽喉及泄殖腔棉拭子,PCR检验是否出现排毒阳性。
第2组为攻毒对照组,共20羽。不进行疫苗免疫。与免疫攻毒组同时通过肌肉注射0.1mL的FAV-1病 毒 液 (108.14TCID50/mL,病 毒 粒 子 数 为108.74copies/mL)进行攻毒。并于攻毒后的3、5、7、10、14d采集所有鸡的咽喉及泄殖腔棉拭子,PCR检验是否出现排毒阳性。
第3组为空白组,共10羽。与免疫攻毒组及攻毒对照组同时采集所有鸡的咽喉及泄殖腔棉拭子,PCR检验是否出现排毒阳性。
1.2.8 田间试验 将广西南宁市郊区某2家蛋鸡养殖场所养殖1月龄三黄鸡3 000只、芦花鸡3 000只作为田间试验所用动物,通过颈背部皮下注射的方式进行免疫接种所研制疫苗0.5mL/羽。在免疫后的1、2、3、4、5、6月分别随机抽查取50只免疫鸡的血清,通过FAV-1全病毒间接ELISA方法检测免疫抗体水平。
2 结果
2.1 FAV-1最佳增殖条件优化
经优化可知,当接种剂量为105.4TCID50/mL时可获得最高病毒粒子浓度的抗原液;在接毒后72 h~96h病毒毒价达峰值,平均尿囊液收获量为8.7mL/胚,因此将这段时间确定为尿囊液最佳收获期。
2.2 灭活剂及灭活终浓度
使用终浓度为1、3、5mL/L的甲醛灭活16h,病毒液盲传2代后没有出现病毒增殖;0.05、0.1、0.5mL/L终浓度灭活的病毒液盲传2代后病毒发生增殖。将病毒液使用终浓度为0.5mL/L和1 mL/L的BPL灭活16h,进行2代盲传后检测没有增殖病毒;使用0.25、0.125、0.06、0.03mL/L终浓度的BPL在盲传后发生病毒增殖。因此,本研究确定灭活使用1mL/L终浓度的甲醛或0.5mL/L终浓度的BPL。
2.3 疫苗成分最佳配比
2.3.1 HLB确定 当FAV-1灭活油苗的HLB值为7.0,Span-80与 Tween-80比例为3∶1时,该组(组3)油苗免疫SPF鸡后血清抗体的ELISA OD450值最高,且放置于4℃及20℃两个月不分层,且无抗原析出现象。从效价上看4组免疫的抗体水平差异不显著(P>0.05),可知HLB值主要影响疫苗溶液的稳定性(表1)。
2.3.2 乳化剂含量确定 当油苗的乳化剂含量为10%时,第3组油苗免疫SPF鸡免疫后血清抗体的ELISA OD450值最高,放置于4℃及20℃保存2个月内均无出现抗原析出及分层。第1、4组在免疫后8周抗体水平迅速下降,组别间差异不显著(P>0.05),见表2。
2.3.3 油水比确定 FAV-1灭活油苗的油水比为4∶1时,第2组油苗免疫SPF鸡免疫后血清抗体的ELISA OD450值最高,且放置于4℃及20℃保存2个月均无出现抗原析出及分层。第4组在30d内迅速出现分层并有抗原析出,在免疫后6周起出现了抗体水平的迅速下降。第4组与第1、2、3组之间差异及其显著(P<0.01),见表3。
2.4 疫苗性状检验
2.4.1 疫苗的剂型 疫苗为白色状乳液,显微镜下观察质地均一,无颗粒状杂质。将疫苗滴于装有清洁室温水的平皿中,疫苗成水滴状漂浮于水面,边缘圆滑规整,表明该剂型为油包水剂型。
2.4.2 稳定性检测 将5mL疫苗3 000r/min离心15min,均无出现水相析出、分层。
2.4.3 黏度测定 使用1mL的吸管吸取FAV-1灭活疫苗1mL,使其自然垂直流出,流出0.4mL疫苗的平均时间为5s,在规定的油苗黏度范围内。
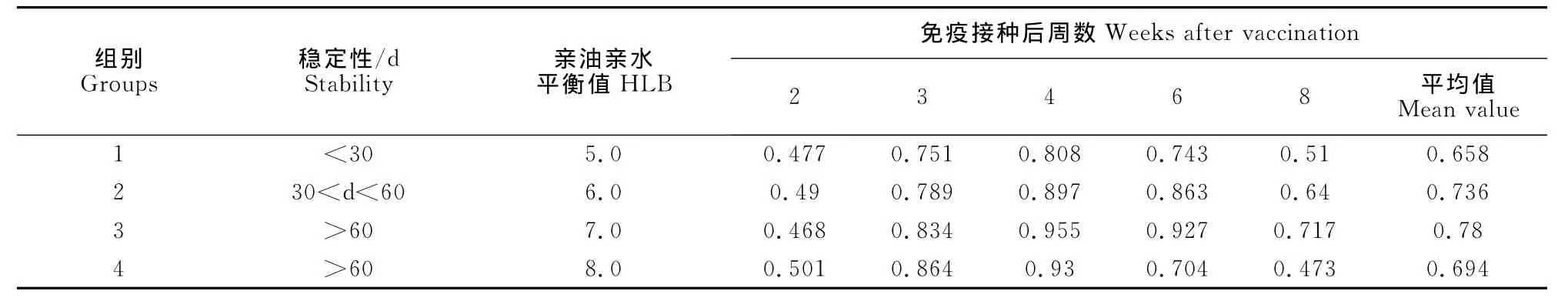
表1 亲油亲水平衡值对FAV-1油苗免疫效果的影响Table 1 Vaccination effect of chicken following administration of FAV-1oil emulsions with varing hydrophile-lipophile balance(HLB)
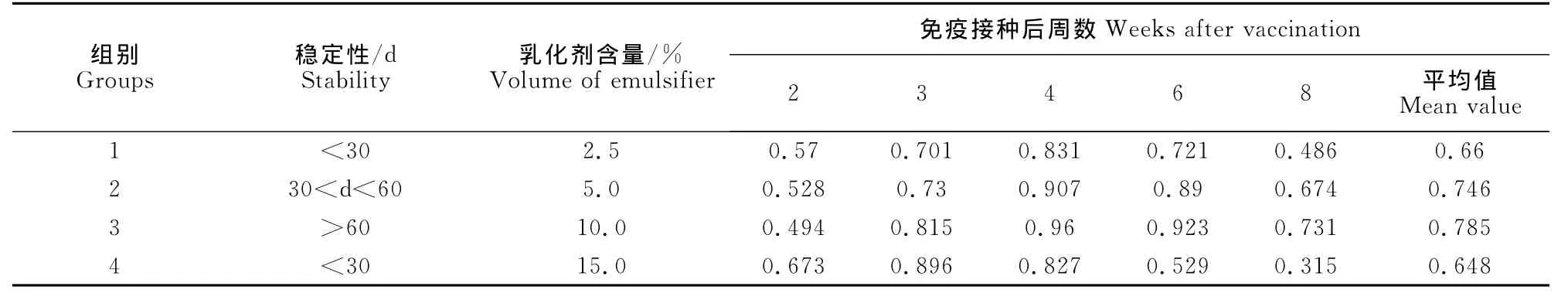
表2 不同乳化剂含量对FAV-1油苗免疫效果的影响Table 2 Vaccination effect of chicken following administration of FAV-1oil emulsions with varing constant volume of surfactant quantity
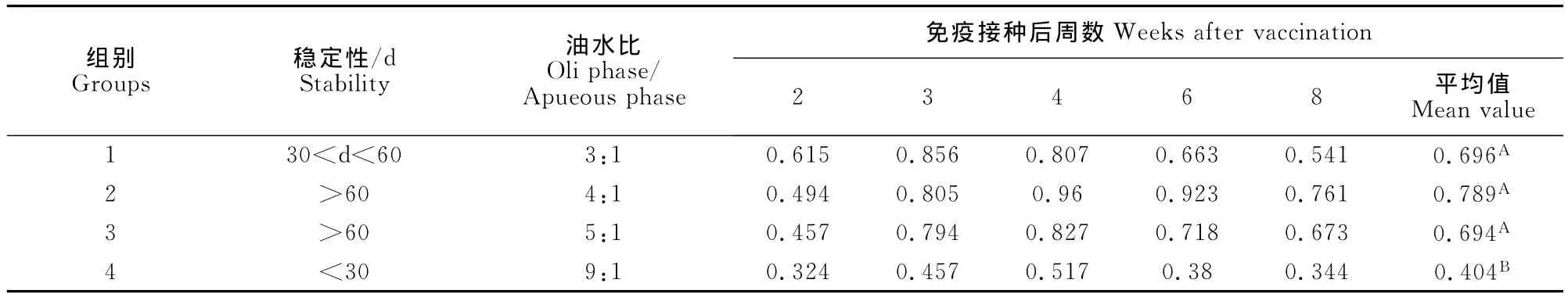
表3 不同油水比对FAV-1油苗免疫效果的影响Table 3 Vaccination effect of chicken following administrationof FAV-1oil emulsions with varing antigen aqueous-phase
2.4.4 无菌检验 接种过后的普通LB肉汤、厌氧肉汤及普通琼脂、血液琼脂等培养基均无微生物的生长,证明制备疫苗所用佐剂及疫苗成品均无微生物污染。
2.4.5 安全性试验 将5只SPF鸡免疫1mL(2羽份)的灭活疫苗后观察14d并解剖,没有出现任何由疫苗注射引起的局部和全身反应,注射部位吸收良好,无肌肉坏死现象。
2.4.6 保存期试验 将三个批次的疫苗分别保存于4℃、20℃及37℃,观察12个月。逐月观察其外观性状,记录其分层、析出情况(表4)。
2.4.7 最小免疫剂量试验结果 将咽喉及泄殖腔棉拭子排毒的结果表5所示,免疫剂量为0.25mL时产生的抗体,能完全抵抗 TCID50为108.14TCID50/mL、病毒粒子浓度为107.615copies/mL 的FAV-1攻击,所以本试验将0.25mL确定为所研究疫苗的最小免疫剂量,并提示当免疫抗体水平为0.565及以上时,足够抵抗病毒的侵害而不产生排毒(表5)。

表4 疫苗保存期试验Table 4 Test of vaccine preseving time
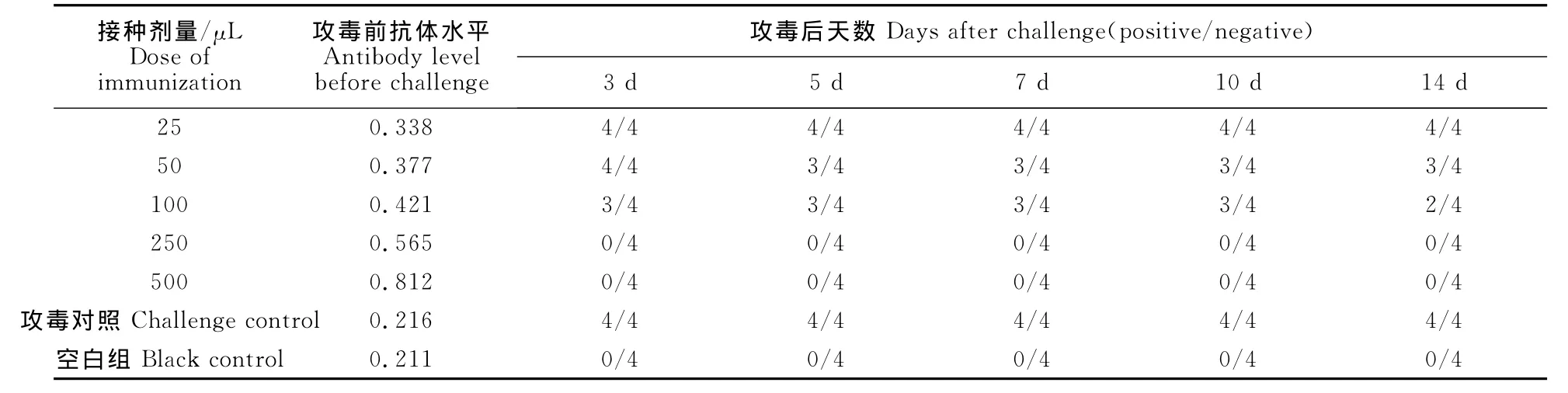
表5 最小免疫剂量试验结果Table 5 The result of minimum immune dose test
2.5 疫苗免疫抗体水平检测结果
抗体免疫水平测定结果如图1所示,在免疫后第2周开始进行免疫抗体水平的检测。在免疫后的第4周免疫鸡组的抗体水平达到了最高峰ELISA OD4500.96。而从免疫后第4周开始,抗体水平缓慢滑落,在免疫后第8周时维持ELISA OD4500.731的水平(图1)。
2.6 免疫攻毒试验结果
攻毒后免疫攻毒组鸡没有出现临床症状,从攻毒后的第3天至第14天的咽喉及泄殖腔棉拭子没有出现咽喉、泄殖腔排毒现象。攻毒对照组在攻毒后3d时,20只鸡中有19只出现排毒现象,一直持续到攻毒后的第14天。FAV-1灭活油乳剂疫苗对免疫组鸡的保护率为100%,达到完全抵抗病毒的攻击(表6和表7)。
2.7 田间试验
检测结果如图2所示,在免疫初期FAV-1油苗抗体达到预期免疫抗体水平,在免疫后4个月内保持高效价。而在免疫后5个月抗体水平出现下降,到免疫后6个月时保持在中等水平。试验结果证明该疫苗达到了试验预期水平,能较好的诱导鸡体产生FAV-1抗体。
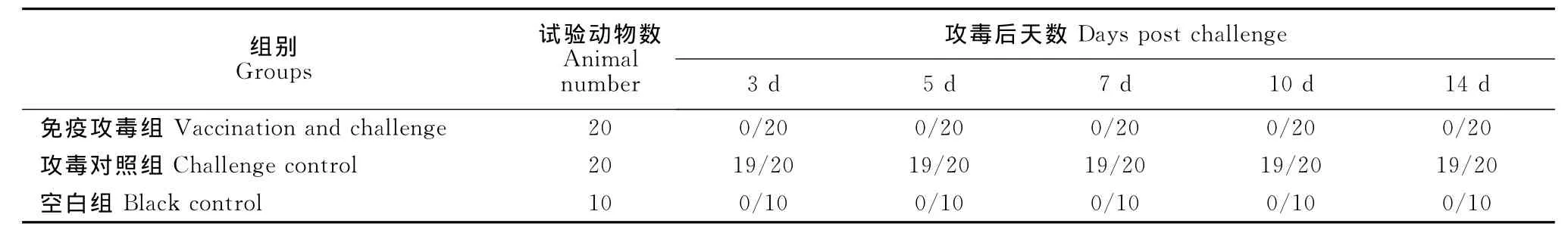
表6 FAV-1病毒攻毒试验数据记录Table 6 Data of FAV-1challenge test

表7 FAV-1病毒攻毒试验统计结果Table 7 The statistics result of FAV-1challenge test
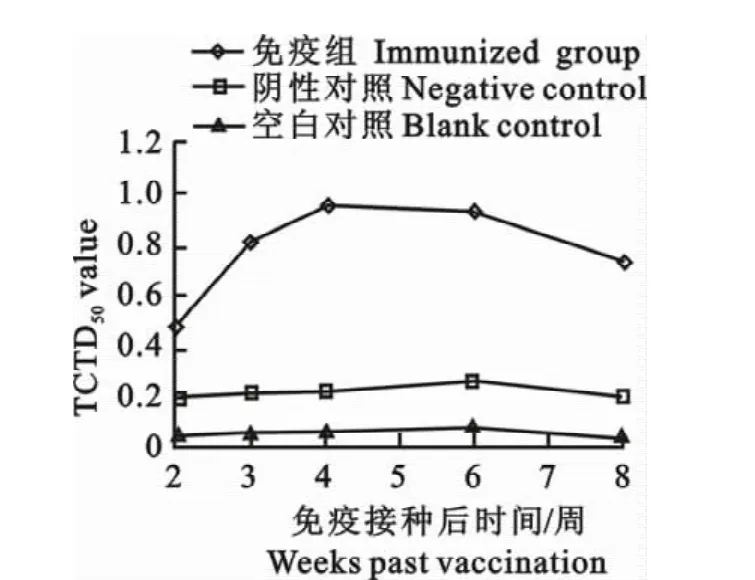
图1 FAV-1灭活苗免疫抗体水平ELISA检测结果Fig.1 The detection result of antibody level of FAV-1 inactivated oil-emulsion vaccine by ELISA
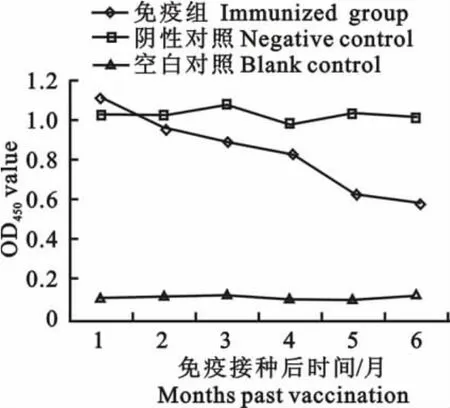
图2 FAV-1灭活油乳剂苗免疫抗体水平检测Fig.2 The detection of antibody level of FAV-1 inactived oil-emulsion vaccine by ELISA
3 讨论
病毒分离、PCR诊断或病毒特异性抗体的存在均证明了FAV-1在健康鸡和病鸡中普遍存在[10],目前为止国内没有任何用于预防FAV-1感染的疫苗。灭活疫苗具有安全性高,不易散毒且免疫效果好等特点。因此,本研究选用灭活油苗的剂型来进行FAV-1疫苗的研制。
甲醛是目前国内兽用灭活疫苗常用的一种灭活剂。其以成本低,灭活效果好为优点。但是对于机体刺激性大,对蛋鸡产蛋有一定的影响。且甲醛本身带有毒性,过高的灭活终浓度易使动物产生甲醛中毒。β-丙内酯 (BPL)[11-16]是一种杂环化合物,是目前国外疫苗常用的灭活剂,对病毒具有很强的灭活作用,比甲醛的作用强25倍,而且对病毒表面抗原影响或破坏作用较小,其作用机制通过与嘌呤碱基(主要是鸟嘌呤)反应改变病毒核酸结构达到灭活病毒的目的。本研究对两种灭活剂的灭活应用均进行了研究,对生产上成本计算给予一定空间。
本研究从亲油亲水平衡值、乳化剂含量、油水比三个方面探讨了油乳剂苗成分的比例对其稳定性及免疫效果上的影响。①亲油亲水平衡值由油苗的乳化剂组分HLB平衡值所决定,它对油包水油苗的油苗中抗原的释放和稳定性有影响。本试验得出灭活疫苗HLB值7.0为最佳,为疫苗的制备提供了参考意见。②乳化剂含量对稳定性和抗原的释放快慢有决定性的作用。当疫苗内乳化剂含量少时,疫苗将抗原迅速释放,在免疫初期是迅速引起抗体升高,而后期不足,免疫保护期相对较短。为了保证疫苗的免疫有效期,本研究测定出使用10%的乳化剂可以使抗原缓慢而有效的释放,使抗体在一定时间内保持中高水平。③疫苗中油水比决定了疫苗中抗原的含量及疫苗体系的稳定性,如果疫苗中含有的抗原量过多,会由于机体内产生免疫抗体的极限而造成抗原的浪费,增加不必要的成本。而疫苗中抗原过少则会导致免疫抗体的分泌持续时间不长,免疫抗体水平不高,甚至是产生的抗体水平不足以抵抗病毒的侵害。本试验中使用4∶1的配比,能够保证疫苗中含有足够量的抗原来诱导免疫反应的产生且不造成抗原的浪费。
免疫抗体水平的监测结果显示,本研究所研制疫苗能够较好的诱导免疫抗体的产生,在免疫后4周时达到最高峰,且在免疫后8周时维持高水平的免疫抗体。田间试验表明在大型养殖场中大批量的在不同品种鸡中应用本课题所研制疫苗所产生免疫效果与SPF白航鸡试验相似,能达到预期免疫抗体水平且鸡群中未出现食欲不振、产蛋下降或死亡,与未免疫鸡群相比并无差异,安全性好。综上所述,本研究所研制疫苗安全性好,保存期长,保护效果显著。
[1]殷 震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997.
[2]SziIvia L,Benk P,Farkas M,et al.Genomic and phylogenetic analyses of an adenovirus isolated from a corn snake imply a common origin with members of the proposed new genus at adenovirus[J].J General Virol,2002,83:2303-2310.
[3]Duncan J.Integrating reptilian herpesviruses into the family herpesviridae[J].J Virol,2005,79(2):725-731.
[4]Fauquet C M,Maniloff J,Mayo M A,et al.Virus taxonomies 8th report of ICTV[M].Amsterdaml:Elsevier Academic Press,2005.
[5]陈溥言.禽腺病毒I型(鸡胚致死孤儿病毒)在非免疫鸡胚中隐性感染可能己经严重危害到我国疫苗生产[J].中国家禽,2002,24(14):43.
[6]周斌.鸡胚致死孤儿病毒的分离鉴定及其Ⅲa蛋白的原核表达的抗原性的分析[D].南京农业大学硕士论文,2003.
[7]Xie Z X,Stone H D.Irnmune response to oil-emulsion vaccine single or mixed antigens of Newcastle diseases,avian influenza and inflectious bronchitis[J].Avi Dis,1990,34:154-162.
[8]谢芝勋,刘加波.手工乳化制备新城疫油乳剂苗的试验[J].中国兽医科技,2001,31(8):24-25.
[9]谢芝勋,刘加波.亲油亲水平衡值对鸡新城疫油苗免疫力影响的研究[J].中国预防兽医学报,2001,23(4):128-129.
[10]Esther S,Ron J.Specific-pathogen-free chickens vaccinated with a live fadV-4vaccine are fully protected against a severe challenge ever in the absence of neutralizing antibodies[J].Avi Dis,2010,54(2):905-910.
[11]陈 伟,李忠义,刘江秋,等.β-丙内酯在Vero细胞HFRS疫苗中的应用[J].中国公共卫生,2003,19(6):669-670.
[12]刘 兆,文李福,安钱浩,等.β-丙内酯在人用纯化地鼠肾细胞狂犬疫苗制备中的应用研究[J].中国人兽共患病杂志,1999,15(6):71-72.
[13]李福安,窦志勇,鲁 宏.β-丙内酯在人用狂犬病疫苗制备中的应用[J].中国生物制品学杂志,1999,12(1):7-8.
[14]Lawrence S A.β-propiolactone:Viral inactivation in vaccines and plasma products[J].PDA J Pharm Sci Technol,2000,54:209.
[15]Perrin P,Morgeaux S.Inactivation of DNA by beta-propiolactone[J].Biologicals,1995:23(3):207.
[16]张松乐,马丽娟,田 光,等.SARS2CoV的培养和灭活条件的研究[J].中华实验和临床病毒学杂志,2005,19(2):135-140.
