猪源乳酸杆菌的分离鉴定及生物学特性分析
2011-05-29苗玉和闫艳丽舒秀伟
苗玉和,刘 岩,闫艳丽,郭 宇,舒秀伟
(辽宁益康生物股份有限公司,辽宁辽阳 111000)
仔猪腹泻是影响养猪业发展的主要疾病之一,以往大多采用抗生素治疗,由此导致的耐药性菌株的出现、动物肠道微生态平衡的破坏、畜禽产品药物残留等严重问题,已经威胁到人类和动物的健康。研制无毒副作用、无残留、无污染的微生态制剂,已成为必然的发展趋势。目前,应用于微生态制剂的菌种主要有乳酸杆菌、链球菌、双歧杆菌、某些芽孢杆菌、酵母菌等。乳酸杆菌是仔猪肠道正常微生物区系中的优势菌群,可利用糖类发酵产生大量乳酸,有的还产生乙酸及其他挥发性脂肪酸,对致病菌具有很好的抑制作用,对维持仔猪肠道微生物区系平衡和消化机能起着重要作用[1-7]。目前,已有众多学者报道利用乳酸杆菌制成的微生态制剂,替代抗生素预防和治疗畜禽消化道疾病[8-9]。本研究拟从健康仔猪肠道中分离筛选出抗逆性乳酸杆菌,用来研制高效、专一的乳酸杆菌猪用微生态制剂。
1 材料与方法
1.1 材料 在辽阳市某猪场,选定12~60日龄健康仔猪,截取肠道,冷藏并迅速送实验室进行细菌分离。
1.2 菌株 猪源致病性大肠杆菌 C83902株(CVCC196)、仔猪副伤寒沙门氏菌 C500株(CVCC79500)、金黄色葡萄球菌(CVCC1882)均购自中国兽医药品监察所。
1.3 培养基 MRS培养基[1]。
1.4 主要试剂 各种糖发酵管购自杭州天和微生物试剂有限公司;基因组提取试剂盒、Ex-taq、dNTP等PCR试剂等购自宝生物(大连)有限公司;其余均为分析纯试剂。
1.2 方法
1.2.1 乳酸杆菌的分离鉴定 参照文献[1,3]方法进行。
1.2.2 抑菌试验 采用牛津杯法[8],测定5株乳酸杆菌对猪源致病性大肠杆菌、沙门氏菌、金黄色葡萄球菌的抑菌能力。
1.2.3 生长曲线的测定 将分离菌株活化后以2%(V/V)的接种量接入MRS液体培养基,37℃培养,每隔2 h取样至30 h,测定 OD600值,绘制生长曲线。
1.2.4 耐酸试验 将抑菌试验筛选出的菌株活化后,按 2%接种量接种于 pH 值为 1.5、2.5、3.5、4.5的液体培养基中,37℃培养8 h;用无菌移液管取出1 mL菌液进行梯度稀释,取3个适宜稀释度菌液各0.1 mL,涂布MRS固体培养基,进行平板菌落计数,并计算菌株存活率[11]。
1.2.5 耐胆盐试验 将抑菌试验筛选出的菌株活化后,按2%的接种量接种于胆盐浓度为(W/V)0.1%、0.2%、0.3%、0.4% 液体培养基中,37 ℃ 培养16 h,平板计数法进行菌落计数,并计算菌株的存活率[12]。
1.2.6 耐胰酶试验 将抑菌试验筛选出的菌株活化后,按2%的接种量分别接种于含有胰蛋白酶的液体培养基中,胰蛋白酶的浓度分别为(W/V)0.8%、1.0%、1.2%、1.4%,37 ℃培养16 h,平板计数法进行菌落计数,并计算菌株的存活率[11]。
1.2.7 PCR鉴定 对上述试验筛选出的抗逆性较强的约氏乳杆菌进行PCR鉴定。根据Genbank上登录的约氏乳杆菌16S rDNA序列设计一对特异性引物:P1(上游):5’-TGGGCGTCTATAATGCAG -3’;P2(下游):5’-CTCTGTCTACTTAGACGG -3’,引物由宝生物(大连)有限公司合成。以提取的细菌基因组DNA为模板,进行目的片段的扩增。反应参数为:95℃预变性5 min;94℃变性50 s、54℃退火1 min、72℃延伸1 min,30个循环后72℃延伸10 min。反应结束后,取5 μL产物用1%琼脂糖凝胶电泳观察。
2 结果
2.1 细菌分离鉴定 本试验共分离到5株革兰氏阳性无芽孢杆菌,编号分别为 LY1、LY7、LY11、LY16、LY25。根据革兰氏染色及生化鉴定结果,对照《伯杰氏细菌鉴定手册》和《乳酸细菌分类鉴定方法》,初步鉴定为 LY1为罗伊氏乳杆菌;LY7、LY16为约氏乳杆菌;LY11为嗜酸乳杆菌;LY25为植物乳杆菌。
2.2 抑菌试验结果 结果见表1。5株乳酸杆菌对3株猪源致病菌均有一定的抑制能力。其中,LY7、LY11、LY25菌株对大肠杆菌、沙门氏菌的抑菌能力较强,且LY7最强;LY11、LY25对金黄色葡萄球菌的抑菌效果较好,LY7对金黄色葡萄球菌的抑菌能力虽不及LY11、LY25,但也明显强于LY1、LY16。LY1、LY164菌株对3种致病菌的抑菌能力均相对较差。综合试验结果,选择 LY7、LY11、LY25菌株进行后续试验。

表1 乳酸菌抑菌圈直径测定结果 mm
2.3 生长曲线测定 图1结果表明,LY7、LY11、LY25菌株在液体MRS培养基中,起初0~4 h处于延滞期,而LY25菌株延滞期较长,为0~6 h;LY7、LY11在4~8 h进入对数生长期,而LY25在6~12 h进入对数生长期;LY7在14 h的OD600达到最高并开始进入稳定期,而LY11在12 h OD600达到最高并开始进入稳定期,LY25在16 h OD600达到最高并开始进入稳定期。
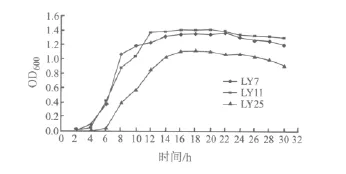
图1 3株乳酸杆菌生长曲线
2.4 耐酸试验 由图2可知,LY7、LY11在pH2.5条件下,培养8 h 后仍有较高存活率,pH3.5、pH4.5对菌株生长无抑制;而LY25对低pH耐受力较差。

图2 不同pH值条件下乳酸杆菌的存活率
2.5 耐胆盐试验 结果见表2。LY7对高浓度胆盐有很强的耐受能力,在0.3%胆盐浓度下,培养16 h,存活率仍能达到55%;而LY11、LY25对胆盐耐受能力很差,特别是LY25,基本对胆盐无耐受能力。
2.6 耐胰酶试验 由图3可知,LY7对胰酶有一定的耐受能力,在1.2%胰酶浓度下作用16 h,存活率可达65%,而LY11、LY25对胰酶耐受能力较差。

表2 不同胆盐浓度下的乳酸杆菌存活率

图3 不同胰酶浓度下的乳酸杆菌存活率
2.7 PCR鉴定结果 电泳检测显示(图4),扩增到约1 500 bp的目的条带。PCR产物经纯化后测序,扩增到的目的片段大小为1 467 bp,对照NCBI上发表的约氏乳杆菌16S rDNA序列,进行同源性分析,与AB295648、FJ557011等菌株同源性为99.1%,进一步从分子水平证实该菌株为约氏乳杆菌。

图4 PCR鉴定结果
3 讨论
3.1 目前,市售的微生态制剂菌种绝大部分来自土壤、水等环境,与动物体内环境存在着较大差异,真正应用于动物时,使用效果将大打折扣。本试验分离得到的5株乳酸杆菌均来自健康仔猪肠道,理论上讲,能够很好的适应仔猪肠道环境。
3.2 我们首先经抑菌试验,初步筛选出3株(LY7、LY11、LY25)抑菌能力较强的菌株进行下一步试验。而乳酸菌制剂经口服方式饲喂动物,须能够耐受胃内低pH的环境。本实验选育的LY7、LY11菌株在 pH2.5,8 h 后存活率仍有 78.33%、81.44%,pH3.5、4.5对菌株生长无抑制。而 LY25菌株在pH2.5,8 h后存活率仅为6.73%。仔猪出生时胃内pH值在5~6之间,因高产酸细菌定植而逐渐下降,数小时后pH值即降至4左右,2月龄前pH值保持在3左右,成年猪的最低pH值可达到1.5[12]。因此,LY7、LY11菌株相对LY25菌株更有可能通过猪的胃进人肠道。
3.3 作为口服制剂,还需具备耐受小肠中胆盐等形成的高渗透压环境的能力。0.1%和0.2%胆盐对LY7菌株生长没有影响,在胆盐浓度升至0.3%以后,LY7菌株在16 h时存活率仍能达到55%,而LY11、LY25菌株对胆盐的耐受性较差。对哺乳仔猪而言,其胆囊内胆汁量很少,在出生后3周内胆汁量增加缓慢,一般在0.03% ~0.3%范围内波动[13-14]。所以LY7菌株在肠道的存活机会很大。
3.4 本实验同时对 LY7、Y11、LY25菌株的耐胰酶能力进行了测定,结果表明,LY7菌株可耐受1.0%的胰酶,而 LY11、LY25菌株对胰酶的耐受性较差。
3.5 综合上述试验结果,约氏乳杆菌LY7株可以作为研制猪用微生态制剂的候选菌株,我们将开展进一步的试验研究。
[1]凌代文.乳酸菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:1 -25.
[2]何明清,程安春.动物微生态学[M].成都:四川科学技术出版社,2004:263-264.
[3]R.E.布坎南,N.E吉本斯等.伯杰细菌鉴定手册(第8版)[M].北京:科学出版社,1984:797~820.
[4]Ogawa M,Shimizu K,Nomoto K,et al.Inhibition of in vitro Growth of Shiga Toxin-producing Escherichia coli O157:H7 by Probiotic Lactobacillus Strains due to Production of Lactic Acid[J].International Journal of food Microbiology,2001,68(1/2):135-140.
[5]Jin L Z,Marquardt Baidoo S K.Inhibition of Enterotoxigenic Escherichia coli K88,K99 and 987P by the Lactobacillus Isolates from Porcine Intestine[J].Journal of the Science of food and Agriculture,2000,80(5):619 -624.
[6]华均超,张邦辉.微生态制剂对仔猪肠道微生态调控的研究与应用进展[J].中国饲料,2011,3:19 -22.
[7]张 凯,方热军.动物微生态制剂在无污染畜牧业上的研究与应用[J].江西饲料,2011,2:22 -24.
[8]张丽芳.仔猪肠道益生菌的分离筛选及生物学特性研究[M].河北农业大学,2005.
[9]戴荣国,曹国文,姜永康,等.不同益生菌组合对断奶仔猪生产性能的影响[J].黑龙江畜牧兽医,2005,10:35 -36.
[10]吴惠芬,毛胜勇,姚 文,等.猪源乳酸菌产乳酸及其抑菌特性研究[J].微生物学通报,2005,32(1):79 -84.
[11]刘 宇.猪用乳酸杆菌、双歧杆菌、纳豆芽孢杆菌复合活菌制剂的研制[D].黑龙江八一农垦大学,2008.
[12]邱进杰,熊 焰,杨 智,等.健康仔猪肠道内抗逆性乳酸菌的选育[J].中国兽医杂志,2008,44(4):86 -87.
[13]顾瑞霞,谭东兴,郭久和,等.胆汁酸盐和低pH值对乳酸菌活性的影响[J].微生物学通报,1996,23(3):144 -146.
[14]Chang Y H,Kim J K,Kim H J,et al.Selection of a Potential Lactobacillus Strain and Subsequent in vivo Studies[J].Antonie van Leeuwenhoek,2001,80(2):193 -199.
