氟对小鼠睾丸间质细胞凋亡与caspase-3表达的影响
2011-04-26王海龙宋国华山西医科大学实验动物中心太原030001通讯作者mailghsonggyahoocomcn
张 斌, 郭 民, 王海龙, 宋国华 (山西医科大学实验动物中心, 太原 030001;通讯作者,E-mail:ghsongg@yahoo.com.cn)
细胞凋亡即程序性细胞死亡,是多细胞生物更新正常细胞和清除异常细胞的重要手段。半胱氨酸天冬氨酸蛋白酶3(caspase-3)在凋亡信号传递中起关键作用,甚至有人认为它是凋亡的执行者[1]。氟对雄性生殖系统有毒性作用,可直接作用于睾丸、附睾、前列腺等,破坏其结构,导致生育能力的下降[2]。研究表明间质细胞受损,线粒体和滑面内质网的变化显著,可能通过增强脂质过氧化作用,抑制物质和能量代谢过程,损伤DNA等途径对雄性生殖系统结构和功能造成直接损害[3]。本实验通过观察氟化钠对体外培养的小鼠睾丸间质细胞进行染毒,观察间质细胞凋亡以及caspase-3表达的变化,进一步证实氟化钠对间质细胞的毒性作用,为氟中毒的雄性生殖系统损伤机制的研究提供基础资料。
1 材料与方法
1.1 细胞 本实验室培养的小鼠睾丸间质细胞。取睾丸间质细胞,待细胞单层长满95%左右后,将培养瓶内的培养液弃掉,先用1 ml左右的消化液润洗培养瓶,弃去消化液,再加2 ml左右新鲜的消化液,当单层细胞呈白色,细胞间出现裂缝且细胞开始收缩时弃掉消化液,终止消化;加入10 ml DMEM/F12培养基,用吸管吹打散开。将一瓶传两瓶,如果生长不好,浓度不高,但又需要传代时也可采用原瓶传原瓶的方式。传代后几小时就可以观察到先贴壁的间质细胞,表示传代成功。传代细胞培养温度条件为37℃,密封培养。取第3代睾丸间质细胞接种于盖玻片上,细胞接种密度为1×106个/ml,待细胞长至汇合后取出盖玻片,以常规3β-HSD法染色鉴定。
1.2 主要试剂和仪器 DMEM/F12培养基(Gibco公司);胎牛血清(杭州四季青公司);胰蛋白酶(Gibco公司);胶原酶(Sigma公司);超净工作台(哈尔滨市东联电子技术开发有限公司);CO2培养箱(Forma scientific美国);超低温冰箱(Sanyo公司);氟化钠(分析纯,天津化学试剂厂);Annexin-Ⅴ-FITC(Sigma公司);casepase-3试剂盒(武汉博士德生物公司)。
1.3 染毒处理 细胞生长增殖形成单层细胞,镜下观察以1×106/ml接种于预置玻片的6孔培养板,每孔1 ml。48 h后弃旧培养液,PBS洗涤后换为含不同浓度氟化钠的培养液,参考毒理学实验一般进行低、中、高剂量染毒和氟化钠对大鼠成骨细胞的研究[4],本实验氟化钠的浓度设为 0 mg/L、5 mg/L、10 mg/L和20 mg/L。37℃恒温混合气体(5%CO2和95%O2)环境中培养,隔天换液。于不同时间在倒置显微镜下观察成骨细胞的生长情况和形态变化。1.4 睾丸间质细胞凋亡的测定 各组细胞每个浓度设6个重复组。继续培养48 h后,用0.25%胰蛋白酶消化并离心收集各组细胞。用PBS洗涤细胞3次;1×binding buffer重新悬浮细胞至1×106/ml;取100 μl细胞至5 ml管;加入5 μl Annexin-Ⅴ-FITC,5 μl碘化丙锭(PI)混匀;于室温避光孵育15 min;每管加入300 μl 1 × binding buffer,1 h 内用流式细胞仪检测荧光强度[5]。
1.5 caspase-3蛋白表达的测定 调节细胞浓度为1×106/ml;将细胞培养于载玻片,载玻片置于6孔板内,先生长约4 h,使细胞贴壁后再小心加入培养基3 ml,常规培养48 h,选对数生长期细胞用于实验。
分组:PBS洗涤后换为含不同浓度氟化钠(0 mg/L,5 mg/L,10 mg/L,20 mg/L)的培养液,每组设3个复孔。
固定:氟作用48 h后,用PBS(pH 7.2)缓慢冲洗3次,倒掉PBS,加入4%多聚甲醛室温下固定30 min,蒸馏水冲洗3次,每次2 min,取出载玻片。30%H2O21份+蒸馏水10份混合,室温5-10 min以灭活内源性酶;蒸馏水洗3次。滴加5%BSA封闭液,室温20 min,甩去多余液体。加入caspase-3适当稀释的一抗(1∶100),37℃30 min,然后4℃过夜;加入二抗4℃过夜后取出,室温放置10 min,PBS洗3次,每次5 min;滴加生物素化山羊抗小鼠IgG,37 ℃ 20 min。PBS(pH7.2-7.6)洗2 min×3次。滴加SABC,20-37℃ 20 min。PBS(pH7.2-7.6)洗5 min×4次。
DAB显色:使用DAB显色试剂盒(AR1022)。取1 ml蒸馏水,加试剂盒中A,B,C试剂各1滴,混匀后加至切片。室温显色,镜下控制反应时间,至出现棕黄色阳性颗粒时,蒸馏水洗涤。
苏木素复染细胞核10 min,1%盐酸酒精分化,镜下控制,自来水返蓝10 min;脱水、透明:70%、80%、90%、100%、100%酒精各 5 min,二甲苯 10 min;封片:中性树胶封片。
1.6 显微图像分析 在光学显微镜OlympusAX70下观察切片,从每组中选取8-10张切片,每张切片随机选取5-7个视野,利用BI-2000医学图像分析系统将图像采集并转化到计算机中,通过MetaMorph4.5图像分析软件自动测定每个视野阳性细胞的灰度值,并计算其平均值。
1.7 统计学分析 采用SPSS11.5软件进行统计处理,计量资料以±s表示,方差齐的多组比较采用单因素方差分析和LSD-t检验,P<0.05差异具有统计学意义。
2 结果
2.1 氟对体外培养小鼠睾丸间质细胞形态的影响
在倒置显微镜下观察时,实验组(5,10,20 mg/L)24 h内睾丸间质细胞的数量增多,形态变化不明显;从24 h开始细胞数量开始少于正常对照组,细胞数量显著下降,细胞形态发生明显变化,睾丸间质细胞呈明显的长梭形、星形,细胞收缩变形,细胞间隙增大。各处理组随着氟浓度的增高和时间的延长,细胞的变化逐渐明显。对照组细胞生长旺盛,细胞形态自然。
2.2 氟诱导体外培养小鼠睾丸间质细胞凋亡的影响 实验小鼠经不同浓度氟化钠(0 mg/L,5 mg/L,10 mg/L,20 mg/L)染毒48 h后,间质细胞凋亡结果见表1和图1,各实验组与同期对照组比较差异显著(P <0.01)。结果表明,5,10,20 mg/L 的氟作用于小鼠睾丸间质细胞均可诱导小鼠睾丸间质细胞发生凋亡。20 mg/L氟作用48 h后,早期凋亡率最高,10 mg/L氟作用48 h后,晚期凋亡率最高,染氟各组小鼠睾丸间质细胞凋亡率高于同期对照组(P<0.01)。各染氟小鼠睾丸间质细胞凋亡率随染氟剂量的增加逐渐升高。结果提示,一定剂量的氟化钠能引起小鼠睾丸间质细胞凋亡率的升高。
表1 不同浓度氟化钠干预48 h的间质细胞的凋亡率(±s)Tab 1 Leydig cell apoptosis rate after treated with different concentrations of sodium fluoride for 48 h(±s)

表1 不同浓度氟化钠干预48 h的间质细胞的凋亡率(±s)Tab 1 Leydig cell apoptosis rate after treated with different concentrations of sodium fluoride for 48 h(±s)
与同期0 mg/L(对照组)比较,*P<0.01
?
2.3 氟对体外培养小鼠睾丸间质细胞caspase-3表达的影响 免疫组化结果显示,对照组染色细胞数少且着色浅,睾丸间质细胞胞质内可见少量棕黄色颗粒,表明caspase-3表达弱;5 mg/L组睾丸间质细胞胞质内可见较多的棕黄色颗粒沉积,caspase-3表达强;10 mg/L和20 mg/L组细胞核周围均被染成棕黄色(见图2),caspase-3强表达。caspase-3在睾丸间质细胞胞质中表达,随着氟浓度的增高,间质细胞细胞胞膜和胞质出现棕黄色颗粒也增多。图像分析结果说明caspase-3灰度值在20 mg/L组低于10 mg/L组。由此可见,随着氟浓度的增加,灰度值降低。因此,氟浓度与caspase-3灰度值呈负相关,即阳性率越高,灰度值越低,蛋白表达越强。
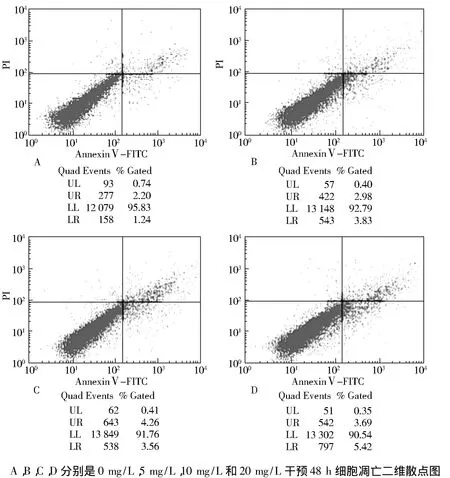
图1 不同浓度氟化钠干预48 h的间质细胞的凋亡率Fig 1 The apoptosis of Leydig cell after treated with different concentrations of sodium fluoride for 48 h by flow cytometry
表2 不同浓度氟化钠组caspase-3表达的平均灰度值(±s,n=30)Tab 1 Average gray value of caspase-3 expression after treated with different concentrations of sodium fluoride(±s,n=30)

表2 不同浓度氟化钠组caspase-3表达的平均灰度值(±s,n=30)Tab 1 Average gray value of caspase-3 expression after treated with different concentrations of sodium fluoride(±s,n=30)
与0 mg/L(对照组)比较,*P <0.01
?
3 讨论
细胞凋亡既是间质细胞发育中的重要方式,又是致畸因素导致间质细胞异常发育的重要形式[6,7]。因此,细胞凋亡的研究有助于间质细胞发育机制的阐明。实验采用体外培养方式,用氟化钠染毒,观察其对小鼠间质细胞凋亡的影响,这样可以排除动物个体因素的干扰。结果在对照组和低高剂量氟化钠组均观察到亚二倍体峰值的显著变化(P<0.01),说明存在细胞凋亡。同时也证实氟化钠随着浓度的增加,细胞凋亡也增强,因为亚二倍体峰值高剂量氟化钠组与空白对照组和低剂量氟化钠组相比均存在统计学差异。
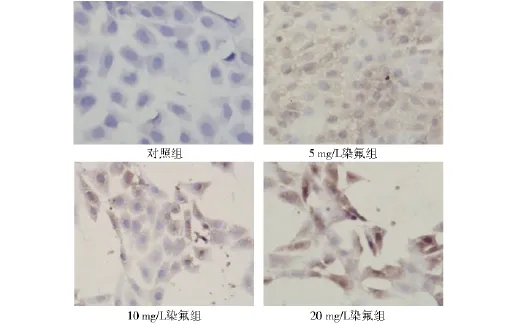
图2 caspase-3的阳性表达细胞形态(免疫组织化学染色,×200)Fig 2 Caspase-3 positive expression in each group(immunohistochemical staining,×200)
细胞凋亡是细胞受死亡信号刺激后发生的主动性细胞死亡过程。凋亡不足时,易发生自身免疫性疾病、病毒性疾病和癌变等,这个过程涉及到多个家族的蛋白质。目前已证明caspase家族在诱导细胞凋亡的分子机制中起关键作用,是多条凋亡通路的汇聚点,是执行凋亡的最终途径。在caspase级联反应中,caspases-3处于核心位置。caspases-3被其上游信号激活,活化的caspases-3又进一步作用于其底物导致 caspase级联反应放大,最终使细胞凋亡[8]。有研究报道关于氟对大鼠成骨细胞中与凋亡密切相关的caspase家族的两个基因caspase-3和caspase-9基因mRNA表达量的检测,发现染氟24 h后,氟的刺激没有引起caspase-3和caspase-9基因mRNA表达量的变化,当氟作用72 h后,5 mg/L NaF组的caspase-3和caspase-9基因mRNA表达量明显升高,分别是对照组的2.03和2.23倍,推断氟导致细胞色素C与Apaf-1激活,然后进一步激活caspase-9,进而激活 caspase-3最终导致细胞凋亡[4]。实验发现在实验组睾丸间质细胞中,caspase-3表达都呈阳性;但与0 mg/L组相比,5 mg/L组氟化钠组睾丸间质细胞中caspase-3表达的平均灰度值无统计学差异,而与0 mg/L组和5 mg/L氟化钠组相比,高剂量氟化钠组caspase-3表达的平均灰度值均存减少。结果证实了caspase-3是睾丸间质细胞发育过程中的重要的细胞因子之一,参与正常和异常间质细胞发育调节。同时也证实了随着氟化钠浓度的增加,细胞凋亡也增强。
有报道认为caspase半胱氨酸蛋白酶家族引发的级联反应是细胞凋亡过程的中心环节,其激活主要包括线粒体依赖途径和死亡受体介导的信号传导途径,激活后的下游caspase通过切割特异性底物,导致细胞凋亡。其中caspase-3处于caspase蛋白酶系的核心地位,可作用于多种底物,其底物改变与细胞凋亡表型密切相关,在caspase酶系级联反应中发挥重要作用[9,10]。那么,氟化钠通过何种方式激活caspases前体蛋白,还需要后续的实验作进一步探讨。
[1] Liu J,Liu J,Mao J,et al.Caspase-3-mediated cyclic stretch-induced myoblast apoptosis via a Fas/FasL-independent signaling pathway during myogenesis[J].J Cell Biochem,2009,107(4):834-844.
[2] 崔留欣,姜春霞,王锡林,等.氟致雄性大鼠生殖功能损害的实验研究[J].中国地方病学杂志,2003,22(3):195 -197.
[3] 袁双虎.睾丸间质细胞凋亡及调控[J].中华男科学,2003,9(3):218-225.
[4] Yan X,Yan X,Morrison A,et al.Fluoride induces apoptosis and alters collagen I expression in rat osteoblasts[J].Toxicol Lett,2011,200(3):133 -138.
[5] 刘纯,孙圣华,张强,等.不同浓度的维生素C对C2C12成肌细胞增殖和凋亡的影响[J].中南大学学报:医学版,2010,35(7):732-737.
[6] Esfandiari N,Falcone T,Goldberg JM.Heat-shock proteins modulate the incidence of apoptosis and oxidative stress in preimplantation mouse embryos[J].Fertil Steril,2007,87(5):1214 -1217.
[7] Pantaleon M,Kaye PL.Glucose transporters in preimplantation development[J].Rev Reprod,1998,3(2):77 -81.
[8] Fan TJ,Han LH,Cong RS,et al.Caspase family proteases and apoptosis[J].Acta Biochim Biophys Sin,2000,37(11):719 -727.
[9] Budihardjo I,Oliver H,Lutter M,et al.Biochemical pathways of caspase activation during apoptosis[J].Annu Rev Cell Dev Biol,1999,15:269 -290.
[10] Cikala M,Wilm B,Hobmayer E,et al.Identification of caspases and apoptosis in the simple metazoan Hydra[J].Curr Biol,1999,9(17):959-962.
