大鼠亚慢性镉中毒模型的建立*
2011-03-07杨鹏辉陈红霞张齐好苏志坚黄亚东
刘 霞,杨 艳,杨鹏辉,陈红霞,仝 雷,张齐好,苏志坚,2,黄亚东*
(1.暨南大学生命科学技术学院 医药生物技术研究开发中心,广东广州510632;2.暨南大学 广东省生物制药重点实验室,广东广州510632)
镉(cadmium,Cd)是一种有色重金属元素,可以对人和动物多种器官[1-4]产生毒害作用,是常见的环境和工业污染物之一。由于镉具有不可降解性和极长的半衰期,因此,微量的镉进入机体即可通过生物放大和积累,对肾、肝、肺、骨、生殖和免疫等器官系统产生一系列损伤。镉污染对动物健康己经构成了巨大的潜在性威胁[5],美国毒物管理委员会(ATSDR)已将其列为第6位危及人类健康的有毒物质。近几年来,镉污染对雄性动物[6]和人类生殖功能的潜在危害作用越来越为科学家所重视。研究发现,镉中毒可以引起家畜尤其是雄性家畜繁殖功能下降,人类男性“勃起功能障碍”(erectile dysfunction,ED)也可能与镉暴露有关[7-8]。本试验通过灌胃的方式,研究不同浓度镉对雄性大鼠肝、肾生理指标的影响及组织病理学改变,旨在更好地模拟镉对机体的亚慢性污染,为深入研究与防治亚慢性镉中毒提供较好的实验动物模型。
1 材料与方法
1.1 材料
1.1.1 氯化镉(CdCl2°2.5H2O) 分析纯,天津科密欧试剂,批号61504;其他试剂均为国产优级纯和分析纯。
1.1.2 仪器 IL-551型原子吸收分光光度计,O-lympus显微照相系统,推拉式三用切片机,电热恒温干燥箱,电子天平(0.000 1 g),大鼠弯头灌胃针,岛津AA-6300型石墨炉原子吸收分光光度计,日立7180型全自动生化分析仪。
1.2 方法
1.2.1 动物分组及染毒 140 g~160 g SPF级雄性Wistar大鼠30只由广东省实验动物中心提供,实验大鼠适应性喂饲7 d后,随机分为5组并分别命名为A、B、C、D、E组,每组6只。A为对照组,用去离子水灌胃。模型组B、C、D、E组大鼠,用浓度为1.25、2.5、5、10 mg/kg的CdCl2溶液灌胃,每周一至周五灌胃,周末2 d正常饲养,试验周期为8周,共计56 d。各组大鼠均以普通饲料饲养(实验动物中心提供),自由饮水,每隔1 d称重。动物房温度17℃~23℃,相对湿度45%~55%。
1.2.3 样品采集及处理 取血样前大鼠禁食1 d,每隔两周尾静脉取血1次,检测血清中尿素、肌酐含量和丙氨酸氨基转移酶(ALT)、乳酸脱氢酶活力。第8周尾静脉取血后将大鼠断颈处死,解剖切取肝、肾组织,于40 mg/L多聚甲醛溶液中固定备用。
1.2.4 测定指标及方法 大鼠体重从试验开始起,隔天称量,收集数据。采用日立全自动生化分析仪测定血清中尿素和肌酐含量、丙氨酸氨基转移酶和乳酸脱氢酶活力。于试验第56天,采用石墨子原子吸收光谱法[9]测定血液和肝、肾中镉的含量。肝肾组织病理形态学检查为常规病理样品处理制片,HE染色镜检。
1.2.5 统计学处理 原始数据计算平均值及标准差,结果以_X±S的形式表示,不同处理组间差异显著性检验用SPSS 12.0软件进行统计分析。
2 结果
2.1 镉对大鼠体重的影响
不同染镉剂量及染镉时间对大鼠体重的影响见表1。
各染镉组大鼠体重增长与正常组基本保持一致,随时间呈递增趋势,与染镉剂量和时间无依赖性关系(表1)。

表1 不同染镉剂量及染镉时间对大鼠体重的影响Table 1 Effects of different CdCl2dosages on weight of ratsg
2.2 镉对大鼠肝功能的影响
在染毒56 d后,C、D、E组丙氨酸氨基转移酶活力显著升高,而乳酸脱氢酶活性与对照组相比较无显著差异(表2,表3)。

表2 不同时期各组大鼠血清丙氨酸氨基转移酶活性Table 2 AL T activity in the serum of rats at different treatment timeU/L

表3 不同时期各组大鼠血清乳酸脱氢酶活性T able 3 LDH activity in the serum of rats at different treatment-timeU/L
2.3 镉对大鼠肾功能的影响
镉对大鼠肾功能的影响主要通过测定血清中尿素(BUN)、肌酐(Cr)的含量来进行评估(表4和表5)。灌胃处理28 d后,E组大鼠血清中尿素含量与对照组相比有显著差异。而随着染镉时间的延长,42 d和56 d,D和C组大鼠血液中的尿素亦逐渐上升,与对照组相比,也有显著差异。血尿素浓度与大鼠染镉剂量及时间呈线性依赖关系,但血液中的肌酐含量在整个镉处理的过程无显著性变化。

表4 不同时期各组大鼠血清中尿素浓度T able 4 BUN concentration in the serum of rats at different treatment timemmol/L

表5 不同时期各组大鼠血清中肌酐浓度Table 5 Cr concentration in serum of rats at different treatment timeμ mol/L
2.4 不同浓度氯化镉处理后血液中镉的蓄积量
大鼠处理56 d后氯化镉在血液中的蓄积量与氯化镉的浓度呈正相关,即随着灌服氯化镉浓度的增大,血液中蓄积的镉离子增多(图1)。

图1 不同浓度氯化镉处理后血液中镉浓度的变化Fig.1 Cadmium concentration in serum of rats with different CdCl2treatment
2.5 不同浓度氯化镉处理后肝肾组织中镉的蓄积量
对照组大鼠肾中未检测到镉的蓄积,肝中有极少量的镉。试验组肝镉和肾镉的浓度随着染镉浓度的增加而增加,其中肝对镉的蓄积能力高于肾(图2)。
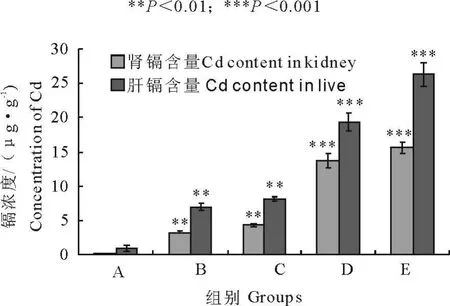
图2 不同浓度氯化镉处理后肝肾中镉浓度的变化Fig.2 Cadmium concentration in the liver and kidney of rats with different CdCl2treatment
2.6 染镉后大鼠肝肾组织学变化
各组大鼠染镉56 d后,肾脏外观呈不同程度肿大,肾小管扩张,部分肾小管萎缩,肾近曲小管上皮细胞浑浊。当大鼠染CaCl2°2.5H2O剂量每天大于5 mg/kg时,肾近曲小管和远曲小管有水样变性,管腔增大,间质水肿,部分细胞坏死脱落。在D和E组大鼠的肾组织中,在光学显微镜下观察到肾小管发生细胞凋亡的现象(图3)。
染镉大鼠肝脏外观颜色变暗,最高剂量组E组大鼠的肝脏接近暗黑色。当染CaCl2°2.5H2O剂量每天高于5 mg/kg时,肝细胞呈现疏松肿胀,部分变性。肝小梁拥挤,排列受破坏,肝窦受压变窄,中央静脉大量充血(图4)。相同染镉剂量下,病理学检测结果发现,大鼠的肾损伤比肝损伤更为明显。

图3 不同剂量染镉大鼠肾组织HE染色(400×,F200×)Fig.3 Pathohistological sections of kidney tissues in rats of different CdCl2treatment
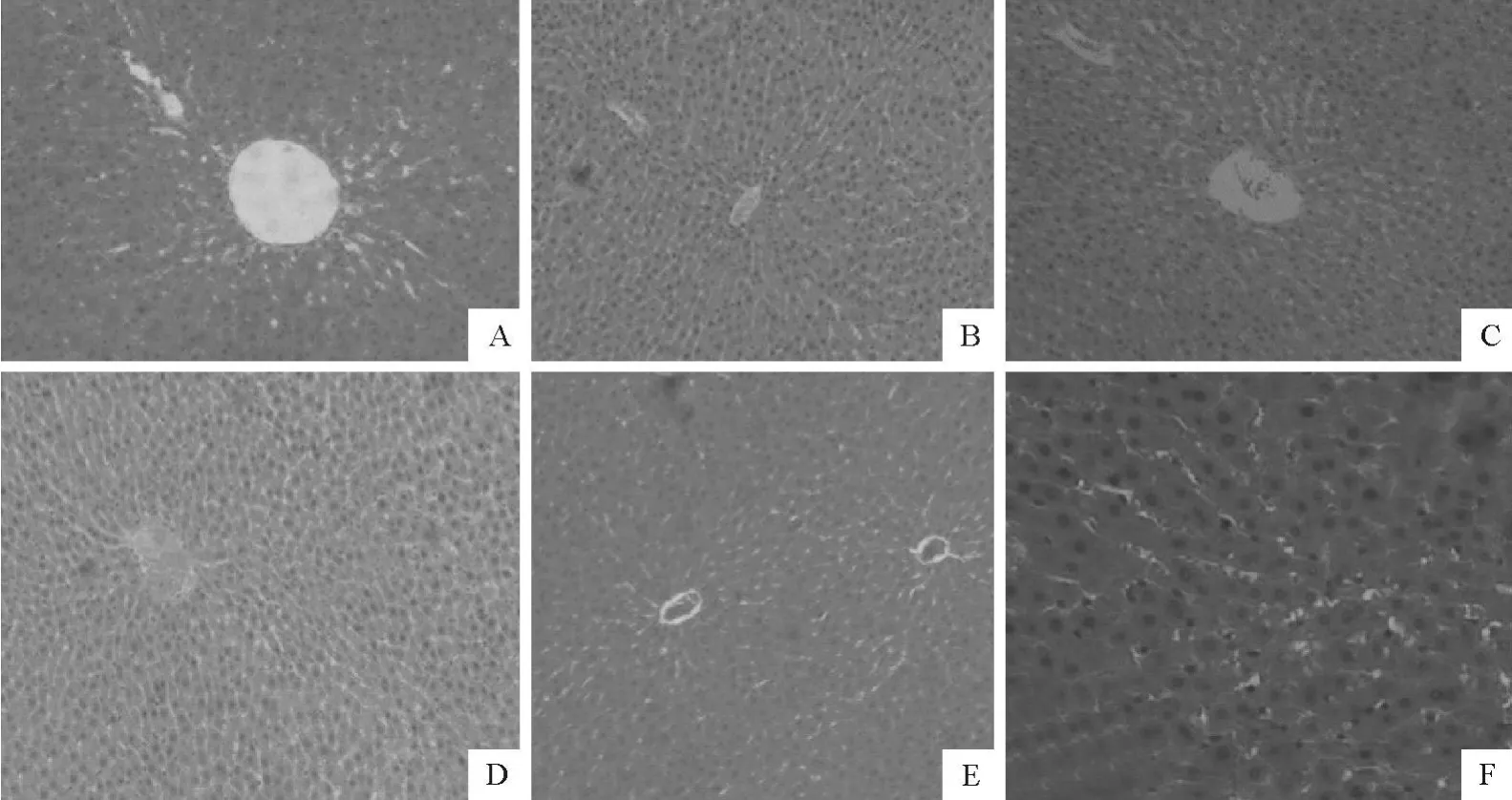
图4 不同剂量染镉大鼠肝组织HE染色(200×,F400×)Fig.4 Pathohistological sections of liver tissues in rats with treatment of defferent concentration of CdCl2
3 讨论
重金属污染已成为社会十分关注的问题,它对人体造成危害的主要途径是随着各种食物和水进入人体。一般来说,重金属污染常以慢性中毒的方式危害人类。而镉是一种常见的可通过接触、呼吸道、消化道等途径进入人体的有毒重金属,且其对人体肝、肾脏器的损伤较为明显。目前关于镉中毒性实验动物模型建立的研究,主要包括:使用外科手术损伤肝、肾[10-11],CdCl2或镉金属硫蛋白复合物(Cd-M T)腹腔注射[12],饮食含镉的水或食物[13]等。镉在肝、肾脏器内蓄积和产生毒作用均为一缓慢过程,急性CdMT注射或是外致损伤建立的模型[14-21]不适合研究慢性镉中毒对肝肾损伤的机制。本研究采用灌胃方式,制备不同浓度镉亚慢性大鼠中毒模型。此方法与自然条件下的镉中毒比较相似,为镉中毒的防治研究提供了可靠的基础,同时也为研究亚慢性镉中毒对大鼠肝肾损伤的机制提供依据。
染镉剂量对雄性Wistar大鼠的体重无显著性影响。生化指标检测结果发现,染镉组大鼠均有不同程度的肝肾功能损害,损伤情况均随着染镉时间和染镉剂量的增加而加重。其中大鼠血清LDH活力及肌酐含量在整个试验过程中没有显著性改变,但血清中的ALT酶活力和尿素含量与大鼠染镉剂量及时间呈线性依赖关系。当染CaCl2°2.5H2O剂量每天为2.5 mg/kg、染镉时间为56 d及染CaCl2°2.5H2O剂量为每天10 mg/kg、染镉时间为28 d时,血清中的尿素含量相比于对照组呈显著性差异。而血清中丙氨酸氨基转移酶活性只有在染镉时间达到56 d时,各模型组大鼠才呈现差异。这些结果说明,相同染镉条件下镉对大鼠的肾损伤较肝更为明显。血液、肝脏、肾镉含量测定结果则表明,肝脏在染毒过程中有较强的镉结合能力,使肝脏镉含量呈线性快速增加。尽管肝对镉的蓄积能力高于肾,但肾也是重金属镉的重要贮存器官和主要排泄器官,因此镉作用于机体易表现出肾脏功能或形态的损伤。大鼠肝肾病理组织学检测结果同样证明了相同染镉条件下,大鼠的肾损伤更为明显。
本试验中每天灌胃镉水剂量大于5 mg/kg且灌胃时间超过42 d而建立的动物模型可以很好地作为模拟镉慢性中毒机制的动物模型,为研究亚慢性镉中毒对大鼠肝肾的损伤机制提供理论依据。
[1] Olsson I M,Bensry d I,Lundh T,et al.Cadmium in blood and urine-impact of sex,age,dietary intake,iron status,and former smoking-association of renal effects[J].Environ Health Perspect,2002,110(12):1185-1190.
[2] Brz′oska M M,Jakoniuk J M.Effect of chronic exposure to cadmium on the mineral status and mechanical properties of lumbar spine of male rats[J].Toxicology Letters,2005,157:161-172.
[3] Brz oska M M,Jakoniuk J M.Historical perspectives on cadmium toxicology[J].Toxicol Appl Pharmacol,2005,207:195-211.
[4] 刁书永,张立志,袁慧.镉中毒机理研究进展[J].动物医学进展,2005,26(5):49-51.
[5] Egan S K,Bolger P M,Carring ton C D.Update of US FDA's total diet study food list and diets[J].Expo Sci Environ Epidemiol,2007,17(6):573-582.
[6] Kim S G,Jee J H,Kang J C.Cadmium accumulation and elimination intissues of juvenileolive flounder,Paralichthys olivaceus after sub-chronic cadmium exposure[J].Environ Pollu,2004,127:117-123.
[7] T hevenod F.Nephrotoxicity and the proximal tubule.Insights from cadmium[J].Nephron Physiol,2003,93(4):87-93.
[8] Ochocka T M,Jakubowski M,Razniewska G,et al.The effects of environmental cadmium ex posure on kidney function:the possible influence of age[J].Environ Res,2004,95:143-150.
[9] 何祥来,王捍东,袁 燕,等.微波消解-原子吸收法检测鸡组织中的重金属含量[J].动物医学进展,2005,26(1):85-88.
[10] Bertani T,Poggi A,Pozzoni R,et al.Adriamycin-induced nephrotic sy ndrome in rats[J].Lab Invest,1982,46(1):16-23.
[11] Yokozawa T,Zheng P D,Oura H,et al.Animal model of adenine-induced chronic renal failure in rats[J].Nephron,1986,44:230-234.
[12] Kasiske B L,O'Donnell M P,Garvis W J,et al.Pharmacologic treatment of hyperlipidemia reduces glomerular injury in rat 5/6 nephrectomy model of chronic renal failure[J].Circulation Res,1988,62:367-374.
[13] Zamlauski M J,Liew J B V,Noble B.Pathophysiology of the kidney in rats with Heyman nephritis[J].Kidney Int,1985,28:504-512.
[14] 刘凤军,徐朋朋,杨自军.小鼠实验性镉中毒的病理学变化[J].动物医学进展,2008,29(12):34-36.
[15] 金树兴,朱奎成,徐 敏.小鼠镉的蓄积性毒性试验研究[J].中国畜牧兽医,2009,36(8):20-23.
[16] 叶 萌,韩春姬,李莲姬,等.牛磺酸对氯化镉遗传毒性的保护作用[J].环境与职业医学,2003,20(5):360-363.
[17] Massadeh A M,Al-Safi S A,Momani I F,et al.Garlic(Allium sativumL)as a potential antidote for cadmium and lead intoxication:cadmium and lead distribution and analysis in different mice organs[J].Biological Trace Element Research,2007,120(1-3):227-234.
[18] 袁发焕,廖立生.镉中毒慢性肾衰小鼠模型的建立与评价[J].第三军医大学学报,1993,15(6):487-491.
[19] 黄厚今,金 泰,董国宾,等.镉致大鼠肾损害时尿酶变化及其意义[J].卫生毒理学杂志,1994,8(2):92-94.
[20] 卢 茜,雷毅雄,贺超才,等.氯化镉腹腔注射对SD大鼠的急性毒性研究[J].中国热带医学,2010,10(7):796-797.
[21] Nordberg G F.Historical perspectives on cadmium toxicology[J].Toxicol Appl Pharmacol,2009,238(3):192-200.
