珠三角地区猪圆环病毒2型的分离鉴定及序列分析*
2011-03-07黎丁滔陈芳艳陈瑞爱晏勇邦冯金牛王林川
黎丁滔,陈芳艳,陈瑞爱,晏勇邦,冯金牛,王林川*
(1.华南农业大学兽医学院,广东广州510642;2.广东大华农动物保健品股份有限公司,广东新兴527400;3.华南农业大学动物科技学院,广东广州510642)
猪圆环病毒2型(Porcine circovirus type 2,PCV-2)可引起断奶后仔猪多系统衰竭综合征(PMWS)、猪皮炎肾病综合征(PDNS)、繁殖障碍等相关疾病[1-3],其中以PMWS最为严重。该病主要危害6周龄~12周龄仔猪,引起渐进性消瘦、呼吸困难、腹泻和黄疸等,给世界养猪业造成了巨大的经济损失。国内自2001年报道该病以来,在各省市均有不同程度的流行[4-5]。为了深入研究PCV-2在体外细胞培养增殖的特性,本研究从13份临床PMWS病料中分离PCV-2毒株,经细胞连续传代,获得13株细胞培育适应毒,经聚合酶链式反应(PCR)、间接免疫荧光试验及核酸序列分析等方法鉴定,证实分离株为PCV-2毒株,分别命名为PCV-2-FS1,PCV-2-FS2,PCV-2-ZQ1,PCV-2-ZQ2,PCV-2-YF,PCV-2-SD1,PCV-2-SD2,PCV-2-SS,PCV-2-SH,PCV-2-ZC,PCV-2-GZ1,PCV-2-GZ2,PCV-2-GZ3。
1 材料与方法
1.1 材料
1.1.1 细胞和病料 无PCV-1污染的PK-15细胞由华南农业大学禽病实验室保存;13份病料(淋巴结、脾脏)采自珠三角地区(佛山、肇庆、云浮、顺德、山水、四会、增城和广州)临床症状和剖检病变疑似PMWS猪场,置于—80℃冰柜中保存备用。
1.1.2 主要试剂 DMEM、胎牛血清、荧光抗体FITC-羊抗猪IgG购于广州美津生物技术有限公司;DNA提取试剂盒、PCR纯化试剂盒、质粒DNA小量提取试剂盒、Ex Taq DNA聚合酶购于宝生物工程(大连)有限公司,PCV-2阳性血清、阴性血清(经武汉科前动物生物制品有限责任公司生产的猪圆环病毒2型ELISA抗体检测试剂盒检测为阴性)由华南农业大学禽病室保存。
1.2 方法
1.2.1 引物的设计和合成 参照GenBank收录的猪圆环病毒2型(PCV-2)ORF2基因序列选择保守区域设计合成一对特异性检测引物,上游引物P1:5′-TATCCAAGGAGGCGTTAC-3′,下游引物P2:5′-GTAGT T TACATAGGGGTCATA-3′,扩增片段为464 bp。参照GenBank收录的猪圆环病毒2型全基因组序列合成两对引物用于扩增全基因组片段,上游引物P3:5′-ACCAGCGCACTTCGGCAGCGG-3′,下游引物P4:5′-CCTACCACTCCCGT TACT T-3′,扩增1~1 273 bp的片段;上游引物P5:5′-ACATGGT TACACGGATAT TGT-3′,下游引物P6:5′-AATACTTACAGCGCACTTCT TTCG-3′,扩增1 084 bp~1 768 bp的片段。以上引物由上海生物工程技术服务有限公司合成。1.2.3 模板的制备 13份病料研磨后用组织DNA提取试剂盒抽提DNA,于—20℃保存。
1.2.4 病料的PCR检测 PCR的反应体系:DNA模板2 μ L,上、下游引物各(20 mmol/L)1 μ L,10×buffer 5 μ L,dNTP(10 mmol/L)4 μ L,Ex TaqDNA聚合酶0.2 μ L,双蒸水11.8 μ L。反应条件:94℃预变性5 min;94℃60 s,53℃60 s,72℃90 s,30个循环;最后72℃延伸10 min。取反应产物5 μ L在10 g/L的琼脂糖凝胶上进行电泳。
1.2.5 病毒的分离 将病料研磨后反复冻融3次,上清用0.22 μ L的细菌滤器过滤除菌。取上清接种于PK-15细胞,24 h后用300 mmol/L D-氨基葡萄糖(D-glucosamine)37℃处理30 min,再培养48 h~72 h,将增殖病毒的细胞反复冻融3次,收集细胞毒液[6-7]。将毒液提取DNA后进行PCR检测,用阳性细胞毒液再接种细胞,共传代6次。培养过程中同时设立不接毒的细胞培养物作为阴性对照。
1.2.6 间接免疫荧光试验检测 按照1.2.5的方法将第6代细胞毒液接种到PK-15细胞,37℃培养60 h后,用pH 7.2的PBS洗涤,洗涤后用900 mL/L的丙酮固定30 min;再用PBS洗涤3次,每次5 min;加PCV-2标准阳性血清,对照组加阴性血清,37℃温育1 h;再用PBS洗涤3次,每次5 min;加FITC标记的羊抗猪IgG染色,37℃温育1 h;最后用PBS洗涤3次,每次5 min,自然干燥后至于荧光显微镜下观察[8-9]。
1.2.7 病毒的TCID50测定 先将细胞毒液用细胞维持液做10倍梯度稀释,从10—1~10—8,然后将其接种到有PK-15的12孔细胞板上,每个梯度接种8孔,按照1.2.5的方法处理后,用间接免疫荧光试验测病毒的TCID50。
1.2.8 全基因组序列PCR的扩增 用P3、P4和P5、P6两对引物扩增全基因组序列,PCR的反应体系:DNA模板2 μ L,上、下游引物各(20 mmol/L)1 μ L,10×buffer 5 μ L,dNTP(10 mmol/L)4 μ L,Ex TaqDNA聚合酶0.2 μ L,双蒸水11.8 μ L。反应程序:94℃预变性5 min;94℃60 s,56℃60 s,72℃90 s,30个循环;最后72℃延伸10 min。取反应产物5 μ L在10 g/L的琼脂糖凝胶上进行电泳。1.2.9 全基因组序列分析 两个片段扩增后连接于pMD18-T载体,经PCR鉴定后送往测序。序列测定由广州英骏生物技术公司完成。
2 结果
2.1 病料PCR扩增结果
13份病料DNA的PCR扩增产物经琼脂糖凝胶电泳分析,表明扩增出了464 bp大小的特异性片段,与预期结果相符(图1)。

图1 病料PCR扩增结果Fig.1 Identification of tissues from sick pigs by PCR
2.2 细胞毒液PCR扩增结果
第1~6代细胞毒液抽提DNA后经PCR检测,均能扩增出464 bp大小的特异性片段(图2)。

图2 第6代细胞毒液PCR扩增结果Fig.2 Identification of viruses from the sixth generation cell culture poison by PCR
2.3 间接免疫荧光试验检测结果
置于荧光显微镜下,在细胞内观察到了特异性的黄绿色荧光,阴性血清对照无黄绿色荧光(图3)。
2.4 病毒的TCID50测定
利用间接免疫荧光对PCV-2-FS1,PCV-2-ZQ1,PCV-2-SD1,PCV-2-GZ1的第6代细胞毒的TCID50进行测定,按Reed-Muench氏法计算(表1)。

图3 间接免疫荧光试验结果Fig.3 The results of IFA

表1 PCV-2毒株的TCID50结果T able 1 The results of TCID50of PCV-2 strains
2.5 全基因组序列PCR扩增结果
以8个不同地方毒株(PCV-2-FS1,PCV-2-ZQ1,PCV-2-YF,PCV-2-SD1,PCV-2-SS,PCV-2-SH,PCV-2-ZC,PCV-2-GZ1)的DNA为模板,分别用P3、P4和P5、P6两对引物进行扩增,结果分别扩增出了1273bp(图4)和685 bp(图5)的特异性片段,与预期结果相符。
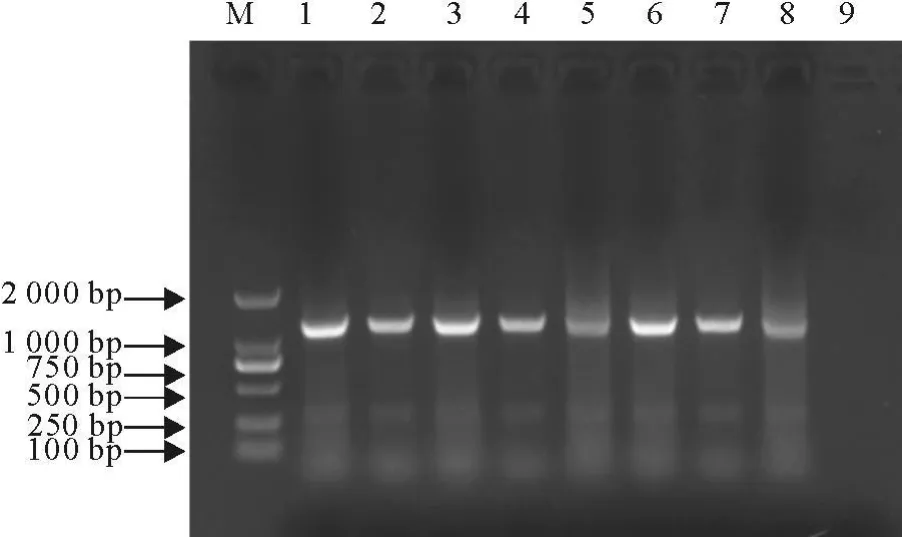
图4 P3、P4引物PCR扩增结果Fig.4 PCR results by using primer P3 and P4

图5 P5、P6引物PCR扩增结果Fig.5 PCR results by using primer P5 and P6
2.6 全基因组序列分析结果
应用DNA Star分析软件将两个片段重叠域拼接后得到了8个不同地区分离株(PCV-2-FS1,PCV-2-ZQ1,PCV-2-YF,PCV-2-SD1,PCV-2-SS,PCV-2-SH,PCV-2-ZC,PCV-2-GZ1)的全基因组序列,长度均为1 767 bp,通过Clustral W方法分别比对8个PCV-2分离株全基因组序列与GenBank已经发表的PCV-2全基因组序列,包括美洲分离株(NC_005148,DQ364650)、英国分离株(AY325495)、中国分离株(AF381175,AF381176,AF381177)、中国台湾分离株(AY180397)、加拿大分离株(AF027217)和澳大利亚分离株(AY754020)。结果发现,不同地域的PCV-2全基因组序列的差异很小,相似性在91.2%~99.8%之间,而本研究的8个PCV-2分离株之间全序列核苷酸相似性为94.2%~99.8%(图6)。
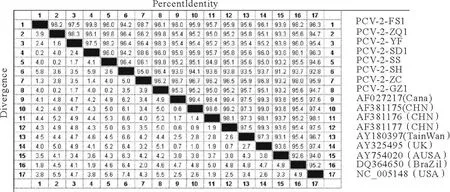
图6 PCV-2全基因组序列比对Fig.6 Homological comparison of the complete genomic sequences of PCV-2 strains
3 讨论
PMWS是近年来新发现的、呈世界性流行分布的猪病毒性疾病,大量证据表明,PCV-2是引起该病的直接原因。PCV-2为DNA病毒,基因组很小,仅有1 768 bp或1 767 bp个碱基[10-13]。本研究先通过PCR方法对临床样品进行检测,将阳性样品处理后接种到细胞上,在细胞传代过程中,每代均进行PCR检测,以证实病毒在细胞中繁殖。同时,以PK-15细胞作阴性对照,将病理材料在细胞上连续传6代,仍然可从细胞上检测出PCV-2,说明病毒已经适应PK-15细胞,已成功将毒株分离出来。
本研究利用间接免疫荧光鉴定病毒时选取了DGlucosamine诱导60 h后的感染细胞,在感染细胞中观察到了大量免疫荧光,文献报道[4,9]和我们的电镜观察结果一致,由于收毒时间较晚,病毒抗原转移到了细胞浆中或病毒借助细胞内的酶系统在细胞浆中合成了病毒抗原[14]。说明我们观察到的荧光是PCV-2特异性的。
PCV-2在细胞上的培养滴度非常低,很多疫苗生产厂家基于成本太高,放弃了开发PCV-2灭活疫苗的打算,因此如何提高PCV-2在细胞上的滴度应该也是今后研究的工作重点之一。董信田等[15]分离出来的PCV-2-SH滴度较高,达到10—5.0TCID50/mL,用此毒株制备的灭活苗有很好的效果。本研究所分离的PCV-2-ZQ1毒株,毒价较高,经6代传代之后为10—6.01TCID50/mL,有作为疫苗研究的价值。另外,不同毒株的毒价差异是否与其致病性有关还有待进一步研究。
应用DNA Star分析软件将两个片段重叠区域拼接后得到了8个不同地方分离株的全基因组序列,长度均为1 767 bp,与PCV-2的另一亚型(1 768 bp)相比,在1042位缺失1个碱基T。将与其他序列比对后发现全序列核苷酸相似性在91.2%~99.8%之间,而本研究的8个PCV-2分离株之间全序列核苷酸相似性为94.2%~99.8%。这表明不同地域和地区的PCV-2存在一些差异,但是PCV-2全基因组从总体上来说遗传进化相对稳定,本研究分离的8个毒株彼此关系密切,没有因为时间和地区的不同发生较大的变异,这可能与本地区习惯性引种有关。
[1] Allan G M,Mc Neilly F,Meehan B M,et al.Isolation and characterization of circoviruses from pigs with wasting syndromes in Spain,Denmark and Northern Ireland[J].Vet Microbiol,1999,66(2):115-123.
[2] Hamel A L,Lin L L,Nayar G P.Nucleotide sequence of porcine circovirus associated with post weaning multi systemic wasting syndrome in pigs[J].Virology,1998,72(6):5262-5267.
[3] 陈 涛,闫若潜,谢彩华,等.猪圆环病毒2型ORF2基因的表达及活性研究[J].动物医学进展,2009,30(2):35-38.
[4] 郎洪武,王 力,张广川,等.猪圆环病毒分离鉴定及猪断奶多系统衰竭综合征的诊断[J].中国兽医科技,2001,31(3):3-5.
[5] 于 周,李 俊,程凯慧,等.猪圆环病毒2型毒株的分离鉴定[J].中国兽医杂志,2009,45(1):19-20.
[6] 何世成,刘道新,张 志,等.猪圆环病毒2型湖南株的分离与序列分析[J].动物医学进展,2010,31(1):31-35.
[7] 白 静,梁月丽.猪圆环病毒河南株的分离与鉴定[J].安徽农业科学,2008,36(13):5444-5445.
[8] 芦银华,谈国蕾,华修国,等.应用间接免疫荧光试验检测猪圆环病毒抗体[J].中国兽医科技,2002,32(8):19-20.
[9] 崔尚金,全滟平,李 曦,等.猪圆环病毒间接免疫荧光方法的建立[J].中国预防兽医学报,2007,29(1):19-20.
[10] 徐绍建,李 俊,曹 帅,等.猪圆环病毒2型全序列分析及感染性克隆的构建[J].中国兽医杂志,2009,45(1):21-22.
[11] 柳美玲,秦晓冰,王爱华,等.猪圆环病毒2型山东分离株全基因组的克隆与序列分析[J].动物医学进展,2008,29(1):13-17.
[12] 王生育,颜江华,孔繁德,等.猪圆环病毒2型ORF1和O RF2基因的克隆与表达[J].中国预防兽医学报,2007,29(12):934-937.
[13] 何逸民,罗玉均,潘全会,等.两株猪圆环病毒2型ORF2基因的克隆和序列分析[J].动物医学进展,2007,28(11):4-7.
[14] 吕艳丽,杨汉春,郭 鑫,等.猪圆环病毒2型的分离与鉴定[J].中国兽医杂志,2004,40(2):14-18.
[15] 董信田,李玉峰,姜 平,等.猪圆环病毒2型灭活疫苗的制备与免疫效力研究[J].畜牧兽医学报,2008,39(5):639-644.
